Đề thi học kì 1 Hóa 11 Cánh diều - Đề số 1Cho các phát biểu sau : (1) Acid H2SO4 loãng không tác dụng với kim loại Cu.Đề bài
I. Trắc nghiệm
Chọn đáp án đúng
Câu 1 :
Cho các phát biểu sau : (1) Acid H2SO4 loãng không tác dụng với kim loại Cu. (2) Khi cho Fe vào các acid H2SO4 đặc, nguội có xảy ra phản ứng. (3) Cách pha loãng H2SO4 đặc an toàn là rót nhanh acid vào nước và khuấy đều. (4) Tác nhân chính tạo ra mưa acid là SO2, NOx. (5) Biện pháp tốt nhất khi nhiệt kế bị vỡ người ta thường dùng muối ăn để thu hồi mercury (thủyngân). Số phát biểu đúng là
Câu 2 :
Sulfur được dân gian sử dụng để pha chế vào thuốc trị các bệnh ngoài da. Tên gọi dân gian của sulfur là
Câu 3 :
Sulfur tác dụng với dung dịch H2SO4 đặc nóng: S + 2H2SO4🡒 3SO2\( \uparrow \)+ 2H2O. Trong phản ứng này có tỉ lệ số nguyên tử S bị khử với số nguyên tử S bị oxi hóa là
Câu 4 :
Trong phương trình SO2 + Br2 + 2H2O ⟶ 2HBr + H2SO4. vai trò của các chất là:
Câu 5 :
Kết quả phân tích thành phần một muối sulfate cho thấy nguyên tố kim loại M chiếm 28% về khối lượng, còn lại là oxygen và lưu huỳnh. Kim loại M là
Câu 6 :
Đặc điểm chung của các phân tử hợp chất hữu cơ là 1. thành phần nguyên tố chủ yếu là C và H 2. có thể chứa nguyên tố khác như Cl, N, P, O 3. liên kết hóa học chủ yếu là liên kết cộng hóa trị 4. liên kết hóa học chủ yếu là liên kết ion 5. dễ bay hơi, khó cháy 6. phản ứng hóa học xảy ra nhanh Các phát biểu đúng là
Câu 7 :
Cho các chất sau: AlCl3, HNO3, CH3–CH2–CH3, CH2=CH–CH2CH3, NaOOC-COONa, CH2OH-CH2OH, H-CH=O, Ba(OH)2, Na2CO3, CO, CaC2, NaCN. Số hợp chất hữu cơ là:
Câu 8 :
Cặp chất nào sau đây là đồng phân của nhau?
Câu 9 :
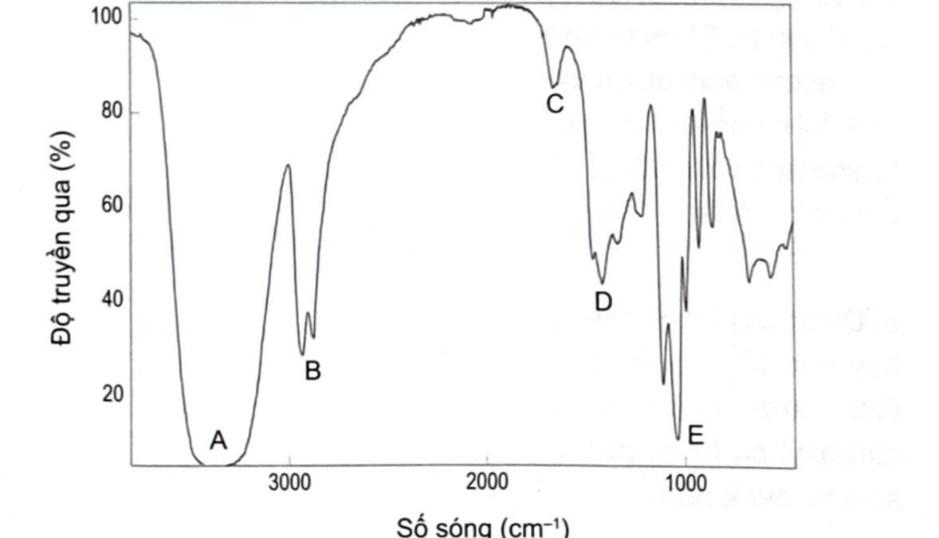
Glycerol là hợp chất dùng làm dược phẩm để giảm cân, cải thiện hoạt động tập thể dục, giúp cơ thể bù lượng nước bị mất trong suốt thời gian bị tiêu chảy và nôn mửa cũng như làm giảm áp lực bên trong mắt ở những người bị tăng nhãn áp. Dựa vào phổ IR dưới đây, hãy cho biết peak nào có thể xác định được nhóm chức –OH có trong hợp chất (X).
Câu 10 :
Cặp chất nào sau đây là đồng đẳng của nhau?
Câu 11 :
Để tách các chất từ một hỗn hợp lỏng không đồng nhất thường dùng phương pháp
Câu 12 :
Cắt nhỏ lá và thân cây sả, cho vào nước, đổ dầu nền vào, nấu đến khi tinh dầu ngả sang màu vàng rồi lọc lấy dung dịch màu. Phương pháp tách biệt và tinh chế nào đã được sử dụng?
Câu 13 :
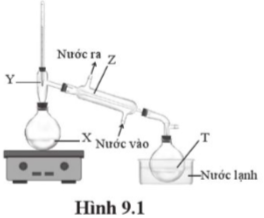
Một học sinh tiến hành chưng cất để tách CHCl3 (ts = 61 °C) ra khỏi CHCl2CHCl2 (ts = 146 °C) bằng bộ dụng cụ như ở Hình 9.1.Khi bắt đầu thu nhận CHCl3 vào bình hứng thì nhiệt độ tại vị trí nào trong hình đang là 61 °C?
Câu 14 :
Từ phổ MS của acetone, người ta xác định được ion phân tử [CH3COCH3] có giá trị m/z lớn nhất bằng 58. Vậy, phân tử khối của acetone là:
Câu 15 :
Lindane hay hexachlorane là chất có tác dụng trừ sâu mạnh, từng được sử dụng phổ biến trong nông nghiệp và làm dược phẩm (trị ghẻ, diệt chấy...). Tuy nhiên, do là chất độc phân huỷ rất chậm trong tự nhiên nên vào năm 2009, hexachlorane đã bị đưa vào phụ lục cấm sản xuất và sử dụng của Công ước Stockholm về các chất ô nhiễm hữu cơ khó phân huỷ và bị cấm sử dụng tại 169 quốc gia trên thế giới. Thành phần phần trăm khối lượng của các nguyên tố có trong hexachlorane là: 24,78% C; 2,08% H và 73,14% Cl. Dựa vào phổ MS, xác định được phân tử khối của hexachlorane là 288 (ứng với 35Cl) hoặc 300 (ứng với 37Cl). Trong tự nhiên, 35Cl chiếm 75,77% lượng nguyên tử còn 37Cl chiếm 24,23% số lượng nguyên tử. Công thức phân tử của hexachlorane là:
Câu 16 :
Cho công thức khung phân tử của chất hữu cơ sau:
Có bao nhiêu nguyên tử carbon trong khung phân tử trên
Câu 17 :
Methanol, ethanol, propanol, butanol thuộc cùng một dãy đồng đẳng. Phát biểu nào sau đây về các hợp chất này là đúng?
Câu 19 :
Phân tích định lượng Atabrine, một loại thuốc chống sốt rét, người ta xác định được chất này chứa 69,1% carbon, 7,5% hydrogen, 10,5% nitrogen, 8,9% chlorine và 4,0% oxygen về khối lượng. Công thức thực nghiệm của Atabrine là:
Câu 20 :
Cho ba chất hữu cơ : acetic acid (C2H4O2) và acid lactic (C3H6O3) và glucose (C6H12O6). Phát biểu nào sau đây
II. Tự luận
Lời giải và đáp án
I. Trắc nghiệm
Chọn đáp án đúng
Câu 1 :
Cho các phát biểu sau : (1) Acid H2SO4 loãng không tác dụng với kim loại Cu. (2) Khi cho Fe vào các acid H2SO4 đặc, nguội có xảy ra phản ứng. (3) Cách pha loãng H2SO4 đặc an toàn là rót nhanh acid vào nước và khuấy đều. (4) Tác nhân chính tạo ra mưa acid là SO2, NOx. (5) Biện pháp tốt nhất khi nhiệt kế bị vỡ người ta thường dùng muối ăn để thu hồi mercury (thủyngân). Số phát biểu đúng là
Đáp án : C Phương pháp giải :
Dựa vào tính chất vật lí và hóa học của acid H2SO4 Lời giải chi tiết :
(1) đúng (2) sai, vì Fe bị thụ động trong H2SO4 đặc, nguội (3) sai, cách pha acid đặc có tính háo nước là rót từ từ acid vào nước và khuấy đều (4) đúng (5) sai, dùng đơn chất sulfur để thu hồi thủy ngân vì sulfur phản ứng với Hg ở điều kiện thường Đáp án C
Câu 2 :
Sulfur được dân gian sử dụng để pha chế vào thuốc trị các bệnh ngoài da. Tên gọi dân gian của sulfur là
Đáp án : A Lời giải chi tiết :
Sulfur có tên khác là diêm sinh Đáp án A
Câu 3 :
Sulfur tác dụng với dung dịch H2SO4 đặc nóng: S + 2H2SO4🡒 3SO2\( \uparrow \)+ 2H2O. Trong phản ứng này có tỉ lệ số nguyên tử S bị khử với số nguyên tử S bị oxi hóa là
Đáp án : C Phương pháp giải :
Dựa vào phương pháp thăng bằng electron Lời giải chi tiết :
\(\begin{array}{l}\mathop S\limits^0 \to \mathop S\limits^{ + 4} + 4e\\\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} \end{array}\) Đơn chất sulfur thể hiện tính khử, H2SO4 thể hiện tính oxi hóa Tỉ lệ: 1: 3
Câu 4 :
Trong phương trình SO2 + Br2 + 2H2O ⟶ 2HBr + H2SO4. vai trò của các chất là:
Đáp án : A Phương pháp giải :
Dựa vào sự thay đổi số oxi hóa của SO2 và Br2 Lời giải chi tiết :
SO2 thể hiện tính khử, Br2 thể hiện tính oxi hóa Đáp án A
Câu 5 :
Kết quả phân tích thành phần một muối sulfate cho thấy nguyên tố kim loại M chiếm 28% về khối lượng, còn lại là oxygen và lưu huỳnh. Kim loại M là
Đáp án : A Phương pháp giải :
Dựa vào % của nguyên tố kim loại để xác định công thức Lời giải chi tiết :
Gọi công thức tổng quát của muối sulfate là M2(SO4)x Vì %M = 28% => \(\begin{array}{l}\% M = \frac{{2M}}{{2M + 96x}}.100\% = 28\% \\ \to M = 18,67x \to x = 3;M = 56(Fe)\end{array}\) Đáp án A
Câu 6 :
Đặc điểm chung của các phân tử hợp chất hữu cơ là 1. thành phần nguyên tố chủ yếu là C và H 2. có thể chứa nguyên tố khác như Cl, N, P, O 3. liên kết hóa học chủ yếu là liên kết cộng hóa trị 4. liên kết hóa học chủ yếu là liên kết ion 5. dễ bay hơi, khó cháy 6. phản ứng hóa học xảy ra nhanh Các phát biểu đúng là
Đáp án : B Phương pháp giải :
Dựa vào các đặc điểm chung của phân tử hợp chất hữu cơ Lời giải chi tiết :
1. đúng 2. đúng 3. đúng 4. sai, chủ yếu là liên kết cộng hóa trị 5. sai, hợp chất hữu cơ dễ cháy 6. sai, phản ứng hóa học xảy ra chậm, diễn ra nhiều giai đoạn Đáp án B
Câu 7 :
Cho các chất sau: AlCl3, HNO3, CH3–CH2–CH3, CH2=CH–CH2CH3, NaOOC-COONa, CH2OH-CH2OH, H-CH=O, Ba(OH)2, Na2CO3, CO, CaC2, NaCN. Số hợp chất hữu cơ là:
Đáp án : C Phương pháp giải :
- Hợp chất hữu cơ là hợp chất của carbon, trừ một số hợp chất oxide của carbon, muối carbonate, các carbide,… Lời giải chi tiết :
Chất hữu cơ: CH3–CH2–CH3, CH2=CH–CH2CH3, NaOOC-COONa, CH2OH-CH2OH, H-CH=O. Chất vô cơ: AlCl3, HNO3, Ba(OH)2, Na2CO3, CO, CaC2, NaCN.
Câu 8 :
Cặp chất nào sau đây là đồng phân của nhau?
Đáp án : A Phương pháp giải :
Những hợp chất khác nhau nhưng có cùng công thức phân tử được gọi là những chất đồng phân. Lời giải chi tiết :
→ Chọn A.
Câu 9 :
Glycerol là hợp chất dùng làm dược phẩm để giảm cân, cải thiện hoạt động tập thể dục, giúp cơ thể bù lượng nước bị mất trong suốt thời gian bị tiêu chảy và nôn mửa cũng như làm giảm áp lực bên trong mắt ở những người bị tăng nhãn áp. Dựa vào phổ IR dưới đây, hãy cho biết peak nào có thể xác định được nhóm chức –OH có trong hợp chất (X).
Đáp án : C Phương pháp giải :
Để xác định được peak của nhóm (alcohol) OH trên phổ IR, ta xác định số sóng của nhóm chức OH rồi tìm số sóng có giá trị nằm trong khoảng đó trên phổ IR của X. Lời giải chi tiết :
Số sóng (peak) đặc trưng của nhóm chức OH nằm trong khoảng 3600 – 3300 (cm-1) → Peak đặc trưng với số sóng tương ứng của nhóm -OH trên phổ IR của X là A.
Câu 10 :
Cặp chất nào sau đây là đồng đẳng của nhau?
Đáp án : A Phương pháp giải :
Đồng đẳng là những chất có cấu tạo hoá học tương tự nhau nên có tính chất hoá học cơ bản giống nhau, nhưng phân tử khác nhau một hay nhiều nhóm CH2. Lời giải chi tiết :
CH4, CH3-CH2-CH2-CH3 là đồng đẳng của nhau, chúng đều là những alkane no, đơn, hở. CH3OCH3 là ether, CH3-CH2OH là alcohol no, đơn hở. Hai chất này khác nhau về tính chất hóa học. HCHO là aldehyde, CH3COOH là carboxylic acid. Hai chất này khác nhau về tính chất hóa học. CH2OH-CH2OH, C3H5(OH)3 đều là polyalcohol, nhưng trong phân tử mỗi chất này lại khác nhau một nhóm (-CH(OH)) nên chúng không phải là đồng đẳng của nhau. → Chọn A.
Câu 11 :
Để tách các chất từ một hỗn hợp lỏng không đồng nhất thường dùng phương pháp
Đáp án : B Phương pháp giải :
Chiết là phương pháp tách và tinh chế các chất từ hỗn hợp dựa trên độ hoà tan khác nhau của các chất đó trong hai môi trường không hoà tan vào nhau. Lời giải chi tiết :
Để tách các chất từ một hỗn hợp lỏng không đồng nhất thường dùng phương pháp chiết. → Chọn B.
Câu 12 :
Cắt nhỏ lá và thân cây sả, cho vào nước, đổ dầu nền vào, nấu đến khi tinh dầu ngả sang màu vàng rồi lọc lấy dung dịch màu. Phương pháp tách biệt và tinh chế nào đã được sử dụng?
Đáp án : A Phương pháp giải :
Dựa vào tính chất vật lí khác nhau của tinh dầu và nước Lời giải chi tiết :
Sử dụng phương pháp chiết để lọc lấy tinh dầu xả
Câu 13 :
Một học sinh tiến hành chưng cất để tách CHCl3 (ts = 61 °C) ra khỏi CHCl2CHCl2 (ts = 146 °C) bằng bộ dụng cụ như ở Hình 9.1.Khi bắt đầu thu nhận CHCl3 vào bình hứng thì nhiệt độ tại vị trí nào trong hình đang là 61 °C?
Đáp án : B Phương pháp giải :
Phương pháp chưng cất dựa vào sự khác nhau về nhiệt độ sôi để tách hợp chất hữu cơ. Hợp chất hữu cơ có ts thấp hơn sẽ được tách ra khỏi hỗn hợp. Lời giải chi tiết :
Đáp án B.
Câu 14 :
Từ phổ MS của acetone, người ta xác định được ion phân tử [CH3COCH3] có giá trị m/z lớn nhất bằng 58. Vậy, phân tử khối của acetone là:
Đáp án : D Phương pháp giải :
Dựa vào giá trị m/z lớn nhất Lời giải chi tiết :
Vì giá trị m/z lớn nhất bằng 58 nên phân tử khối acetone là 58
Câu 15 :
Lindane hay hexachlorane là chất có tác dụng trừ sâu mạnh, từng được sử dụng phổ biến trong nông nghiệp và làm dược phẩm (trị ghẻ, diệt chấy...). Tuy nhiên, do là chất độc phân huỷ rất chậm trong tự nhiên nên vào năm 2009, hexachlorane đã bị đưa vào phụ lục cấm sản xuất và sử dụng của Công ước Stockholm về các chất ô nhiễm hữu cơ khó phân huỷ và bị cấm sử dụng tại 169 quốc gia trên thế giới. Thành phần phần trăm khối lượng của các nguyên tố có trong hexachlorane là: 24,78% C; 2,08% H và 73,14% Cl. Dựa vào phổ MS, xác định được phân tử khối của hexachlorane là 288 (ứng với 35Cl) hoặc 300 (ứng với 37Cl). Trong tự nhiên, 35Cl chiếm 75,77% lượng nguyên tử còn 37Cl chiếm 24,23% số lượng nguyên tử. Công thức phân tử của hexachlorane là:
Đáp án : C Phương pháp giải :
Dựa vào phần trăm nguyên tố của hợp chất để tìm được công thức thực nghiệm của chất đó. Lời giải chi tiết :
Nguyên tử khối trung bình của chlorine là: \(\frac{{35.75,77 + 37.24,33}}{{100}} = 35,5\) Gọi công thức phân tử của glyoxaal là CxHyClz. Ta có: x : y : x = \(\frac{{\% C}}{{12}}:\frac{{\% H}}{1}:\frac{{\% Cl}}{{35,5}} = 1:1:1\) Vậy công thức thực nghiệm của X là CHCl. b) Với 35Cl, hexachlorane có phân tử khối 288: (CHCl)n = 288 → n = 6. Với 37Cl, hexachlorane có phân tử khối 300: (CHCl)n = 300 → n = 6. Vậy công thức phân tử của hexaclorane là C6H6Cl6.
Câu 16 :
Cho công thức khung phân tử của chất hữu cơ sau:
Có bao nhiêu nguyên tử carbon trong khung phân tử trên
Đáp án : D Lời giải chi tiết :
Dựa vào khung phân tử của chất hữu cơ Có 8 nguyên tử carbon
Câu 17 :
Methanol, ethanol, propanol, butanol thuộc cùng một dãy đồng đẳng. Phát biểu nào sau đây về các hợp chất này là đúng?
Đáp án : B Phương pháp giải :
Các hợp chất này có tính chất hoá học tương tự nhau và có tính chất vật lí biến đổi theo quy luật. Lời giải chi tiết :
Đáp án B.
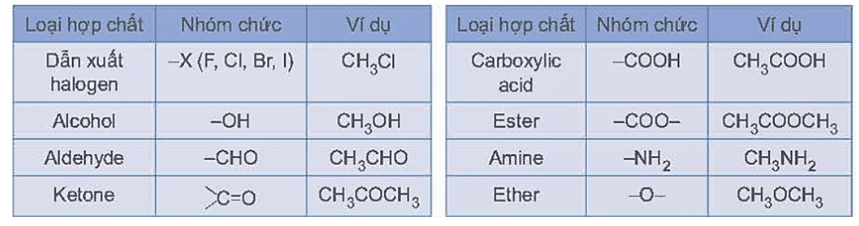
Đáp án : B Phương pháp giải :
Một số loại nhóm chức cơ bản được thể hiện trong bảng sau:
Lời giải chi tiết :
+ X chứa các loại nhóm chức: -OH: Alcohol. -NH2: Amine. -COOH: Carboxyl. + X không chứa loại nhóm chức aldehyde (-CHO). → Chọn B.
Câu 19 :
Phân tích định lượng Atabrine, một loại thuốc chống sốt rét, người ta xác định được chất này chứa 69,1% carbon, 7,5% hydrogen, 10,5% nitrogen, 8,9% chlorine và 4,0% oxygen về khối lượng. Công thức thực nghiệm của Atabrine là:
Đáp án : D Phương pháp giải :
Công thức đơn giản nhất cho biết tỉ lệ số nguyên tử của các nguyên tố có trong phân tử hợp chất hữu cơ (tỉ lệ các số nguyên tối giản). Lời giải chi tiết :
Công thức tổng quát của Atabrine có dạng CxHyOzNtClu. Ta có: \({\rm{x}}:{\rm{y}}:{\rm{z}}:{\rm{t}}:{\rm{u}} = \frac{{69,1}}{{12}}:\frac{{7,5}}{1}:\frac{{4,0}}{{16}}:\frac{{10,5}}{{14}}:\frac{{8,9}}{{35,5}}\) \( = 5,76:7,5:0,25:0,75:0,25\) \( = 23:30:1:3:1\) Công thức thực nghiệm của Atabrine là C23H30ON3Cl.
Câu 20 :
Cho ba chất hữu cơ : acetic acid (C2H4O2) và acid lactic (C3H6O3) và glucose (C6H12O6). Phát biểu nào sau đây
Đáp án : B Lời giải chi tiết :
Ba chất hữu cơ trên khác nhau về công thức phân tử giống nhau về công thức đơn giản nhất (CH2O) Đáp án B
II. Tự luận
Lời giải chi tiết :
\(CaO + {H_2}O \to Ca{(OH)_2}\) \(\begin{array}{l}Ca{(OH)_2}\,\,\,\,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,\,\,\,2HCl \to CaC{l_2}\,\,\, + 2{H_2}O\\\frac{{12,{{1.10}^{ - 3}}.0,1}}{2} \leftarrow 12,{1.10^{ - 3}}.0,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(mol)\,\,\,\,\end{array}\) (a) \( \Rightarrow {C_{M(Ca{{(OH)}_2})}}\, = \,\frac{{12,{{1.10}^{ - 3}}.0,1}}{{{{2.5.10}^{ - 3}}}}\, = 0,121(M)\,\,\) (b) \(\left. \begin{array}{l}CaO\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,\,\,\,{H_2}O \to Ca{(OH)_2}\\\frac{{12,{{1.10}^{ - 3}}.0,1}}{2} \leftarrow \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\frac{{12,{{1.10}^{ - 3}}.0,1}}{2}\,\,mol\end{array} \right\} \Rightarrow {m_{CaO}} = \frac{{12,{{1.10}^{ - 3}}.0,1}}{2}.56 = 3,388\,gam\) (c) \(\left. \begin{array}{l}Ca{(OH)_2} \to C{a^{2 + }} + 2O{H^ - }\\0,121\,\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,\,\,\,\,\,0,242\,M\end{array} \right\} \Rightarrow \left[ {{H^ + }} \right] = \frac{{{{10}^{ - 14}}}}{{0,242}} \Rightarrow pH = - \lg \left[ {\frac{{{{10}^{ - 14}}}}{{0,242}}} \right] = 13,38\)
Lời giải chi tiết :
Số mol khí NH3 = 0,002 mol Số mol BaSO4 = 0,002 mol. Thí nghiệm 1: NH4+ + OH- \( \to {\rm{ }}\)NH3 + H2O \({n_{NH{}_3}} = {n_{NH_4^ + }} = 0,002mol\) Thí nghiệm 2: Ba2+ + SO42- \( \to {\rm{ }}\)BaSO4 \({n_{SO_4^{2 - }}} = {n_{BaS{O_4}}} = 0,002mol\) Áp dung ĐL BTĐT \({n_{F{e^{2 + }}}} = 0,001mol\) CT muối (NH4)2SO4.FeSO4.nH2O = 0,001 mol Áp dụng ĐL BTKL ta có công thức của muối: (NH4)2SO4.FeSO4.6H2O
|



























Danh sách bình luận