Đề thi giữa kì 1 Hóa 11 Cánh diều - Đề số 10Phản ứng nào sau đây viết saiĐề bài
Phần 1. Trắc nghiệm nhiều đáp án lựa chọn
Câu 1 :
Phản ứng nào sau đây viết sai
Câu 2 :
Kim loại nào sau đây không tác dụng với nitric acid?
Câu 5 :
Phú dưỡng là hiện tượng xảy ra do sự gia tăng hàm lượng của nguyên tố nào trong nước?
Câu 6 :
pH của dung dịch KOH 0,004M có giá trị là:
Câu 7 :
Trong phản ứng sau đây, những chất nào đóng vai trò là base theo thuyết Bronsted – Lowry? \(CO_3^{2 - }(aq) + {H_2}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} HCO_3^ - (aq) + O{H^ - }(aq)\)
Câu 8 :
Cho phản ứng A(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)B(g). Hằng số cân bằng của phản ứng đã cho là KC = 1,0.10-3. Tại trạng thái cân bằng, nồng độ của chất A là 1.10-3M thì nồng độ cân bằng B là
Câu 9 :
Cho phản ứng: aFe + b HNO3 \( \to \)c Fe(NO3)3 + d NO2 + e H2O Hệ số tỉ lượng a, b, c, d, e là những số nguyên dương có tỉ lệ tối giản. Tổng a + b + c + d + e bằng
Câu 10 :
Cho phản ứng hóa học sau: \(2NO(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{O_2}(g)\) \({\Delta _r}H_{298}^o = 115kJ\) Nhận xét nào sau đây không đúng?
Câu 12 :
Chất khí nào sau đây không phải là nguyên nhân chính gây nên hiện tượng mưa acid?
Câu 13 :
Cho các phát biểu sau: (1) Dung dịch Na2CO3 làm phenolphtalein chuyển sang màu hồng. (2) Trong phản ứng thuận nghịch, tại thời điểm, tốc độ phản ứng nghịch ban đầu đạt lớn nhất sau đó giảm dần. (3) Nước cất chứa H2O, H+ và OH- (4) Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng dừng lại. (5) Trong dung dịch, ion HS- và HCO3- đều thể hiện tính lưỡng tính Số phát biểu đúng là:
Câu 14 :
Cho các nhận định sau về tính chất hóa học của nitric acid: (1) có tính acid mạnh; (2) có tính acid yếu; (3) có tính oxi hóa mạnh; (4) có tính khử mạnh. Số nhận định đúng là
Câu 15 :
Trong phòng thí nghiệm người ta điều chế NO2 bằng cách cho Cu tác dụng với HNO3 đặc, đun nóng. NO2 có thể chuyển thành N2O4 theo cân bằng: 2NO2(g) N2O4(g) Cho biết NO2 là khí có màu nâu và N2O4 là khí không màu. Khi ngâm bình chứa NO2 vào chậu nước đá thấy màu trong bình khí nhạt dần. Hỏi phản ứng thuận trong cân bằng trên là:
Câu 16 :
Cho phương trình nhiệt hóa học sau: C2H2(g) + H2O(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)CH3CHO(g) \({\Delta _r}H_{298}^o = - 151kJ\) Cân bằng hóa học sẽ chuyển dịch về phía tạo ra nhiều CH3CHO hơn khi
Câu 17 :
Chuẩn độ dung dịch NaOH chưa biết chính xác nồng độ (biết nồng độ trong khoảng gần với 0,1M) bằng dung dịch chuẩn HCl 0,1M với chỉ thị phenolphtalein. Tại thời điểm tương đương, điều nào sau đây không đúng?
Câu 18 :
Cho các phát biểu sau: (1) Các muối ammonium đều là chất điện li mạnh, trong nước muối ammonium điện li hoàn toàn tạo ra ion NH4+ không màu, tạo môi trường base. (2) Khi cho Fe vào các acid HNO3 đặc, nguội có xảy ra phản ứng. (3) Sự chuyển dịch cân bằng là chuyển từ trạng thái cân bằng này thành trạng thái cân bằng khác. (4) Nitrogen được dùng làm căng vỏ bao bì thực phẩm do nitrogen nhẹ hơn không khí. (5) Các dung dịch NaCl, HCl, CH3COOH, H2SO4 có cùng nồng độ mol, dung dịch có pH nhỏ nhất là H2SO4. Số phát biểu không đúng là
Phần 2. Câu hỏi đúng, sai
Câu 1 :
Phản ứng tổng hợp 3-methylbutyl acetate (isoamyl acetate) trong phòng thí nghiệm từ acetic acid và 3-methylbutan-1-ol (isoamyl alcohol) với xúc tác dung dịch H2SO4 đặc, đun nóng xảy ra theo phương trình hóa học sau:
Dùng dư acetic acid có thể làm tăng hiệu suất phản ứng.
Đúng
Sai
Tách lấy ester isoamyl acetate sẽ làm cân bằng chuyển dịch theo chiều thuận.
Đúng
Sai
Khi tăng áp suất cân bằng trên sẽ chuyển dịch theo chiều nghịch.
Đúng
Sai
H2SO4 đặc ngoài vai trò xúc tác còn hút nước làm tăng hiệu suất phản ứng.
Đúng
Sai
Câu 2 :
Cho dung dịch HNO3 0,1 M (bỏ qua sự điện li của H2O). Phương trình điện li của HNO3 là HNO3 → H+ + NO3-.
Đúng
Sai
Dung dịch HNO3 trong nước chứa các phần tử: H+, NO3-, HNO3, H2O.
Đúng
Sai
Nồng độ cation trong dung dịch là 0,1 M.
Đúng
Sai
Nồng độ anion trong dung dịch là 0,3 M.
Đúng
Sai
Câu 3 :
Phú dưỡng là hiện tượng dư thừa quá nhiều các nguyên tố dinh dưỡng (N, P) trong các nguồn nước làm cho các sinh vật trong nước như vi khuẩn, tảo, rong, rêu,… phát triển nhanh. Nguyên nhân gây ra hiện tượng phú dưỡng do nguồn nước thải nông nghiệp, công nghiệp, sinh hoạt, ... chưa xử lí triệt để thải vào ao hồ.
Đúng
Sai
Hiện tượng phú dưỡng làm giảm sự quang hợp của thực vật thủy sinh và làm tăng nguồn oxygen của tôm, cá, … gây mất cân bằng hệ sinh thái.
Đúng
Sai
Các loại tôm, cá, … ở ao hồ có hiện tượng phú dưỡng thường khỏe mạnh và béo tốt vì có nguồn chất dinh dưỡng phong phú.
Đúng
Sai
Để khắc phục hiện tượng phú dưỡng ta cần xử lí nước thải trước khi thải vào môi trường, sử dụng phân bón đúng liều lượng, khơi thông kênh rạch, ao hồ, lưu thông dòng nước.
Đúng
Sai
Câu 4 :
Xét cấu tạo của phân tử NH3. Phân tử NH3 có dạng chóp tam giác gồm 1 nguyên tử N ở đỉnh liên kết với 3 nguyên tử H ở đáy.
Đúng
Sai
Trong NH3 chứa 3 liên kết N – H là các liên kết cộng hóa trị phân cực về phía H.
Đúng
Sai
Trong NH3, nguyên tử N còn cặp electron chưa tham gia liên kết.
Đúng
Sai
Giữa các phân tử NH3 có liên kết hydrogen.
Đúng
Sai
Phần 3. Trả lời ngắn
Lời giải và đáp án
Phần 1. Trắc nghiệm nhiều đáp án lựa chọn
Câu 1 :
Phản ứng nào sau đây viết sai
Đáp án : A Phương pháp giải :
Dựa vào phản ứng nhiệt phân của ammonium. Lời giải chi tiết :
sai vì phân hủy tạo N2 và H2O. Đáp án A
Câu 2 :
Kim loại nào sau đây không tác dụng với nitric acid?
Đáp án : D Phương pháp giải :
Dựa vào tính chất oxi hóa mạnh của nitric acid. Lời giải chi tiết :
Au không tác dụng với nitric acid. Đáp án D Phương pháp giải :
Trong phản ứng oxi hóa khử: + Chất khử là chất nhường electron, có số oxi hóa tăng sau phản ứng. + Chất oxi hóa là chất nhận electron, có số oxi hóa giảm sau phản ứng. Lời giải chi tiết :
Phương pháp giải :
Khi các khí sulfur dioxide, nitrogen dioxide bị oxi hóa và bị hòa tan trong nước tạo thành dung dịch acid HNO3 và H2SO4, làm nước mưa có độ pH < 5,6, gây nên mưa acid. Lời giải chi tiết :
Mưa acid là hiện tượng nước mưa có pH < 5,6. → Chọn A.
Câu 5 :
Phú dưỡng là hiện tượng xảy ra do sự gia tăng hàm lượng của nguyên tố nào trong nước?
Đáp án : B Phương pháp giải :
Dựa vào kiến thức về phú dưỡng. Lời giải chi tiết :
Phú dưỡng là hiện tượng xảy ra do sự gia tăng hàm lượng nguyên tố dinh dưỡng: N, P. Đáp án B
Câu 6 :
pH của dung dịch KOH 0,004M có giá trị là:
Đáp án : B Phương pháp giải :
Dựa vào công thức tính pH. Lời giải chi tiết :
pOH = -lg [OH-] = 2,4 \( \to \)pH = 14 – 2,4 = 11,6 Đáp án B
Câu 7 :
Trong phản ứng sau đây, những chất nào đóng vai trò là base theo thuyết Bronsted – Lowry? \(CO_3^{2 - }(aq) + {H_2}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} HCO_3^ - (aq) + O{H^ - }(aq)\)
Đáp án : A Phương pháp giải :
Dựa vào thuyết Bronsted – Lowry. Lời giải chi tiết :
\(CO_3^{2 - }\)và \(O{H^ - }\)đóng vai trò là base theo thuyết Bronsted – Lowry. Đáp án A
Câu 8 :
Cho phản ứng A(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)B(g). Hằng số cân bằng của phản ứng đã cho là KC = 1,0.10-3. Tại trạng thái cân bằng, nồng độ của chất A là 1.10-3M thì nồng độ cân bằng B là
Đáp án : B Phương pháp giải :
Dựa vào công thức tính hằng số cân bằng. Lời giải chi tiết :
KC = \(\frac{{{\rm{[}}B{\rm{]}}}}{{{\rm{[}}A]}} = \frac{{{\rm{[}}B{\rm{]}}}}{{{{1.10}^{ - 3}}}} = {1.10^{ - 3}} \to {\rm{[}}B{\rm{]}} = 1M\)
Câu 9 :
Cho phản ứng: aFe + b HNO3 \( \to \)c Fe(NO3)3 + d NO2 + e H2O Hệ số tỉ lượng a, b, c, d, e là những số nguyên dương có tỉ lệ tối giản. Tổng a + b + c + d + e bằng
Đáp án : A Phương pháp giải :
Dựa vào Phương pháp thăng bằng electron. Lời giải chi tiết :
Feo \( \to \)Fe+3 + 3e |x1 N+5 +1e\( \to \)N+4 |x3 Fe + 6HNO3 \( \to \) Fe(NO3)3 + 3 NO2 + 3H2O Tổng a + b + c + d + e = 1 + 6 + 1 + 3 + 3 = 14 Đáp án A
Câu 10 :
Cho phản ứng hóa học sau: \(2NO(g) + {O_2}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} N{O_2}(g)\) \({\Delta _r}H_{298}^o = 115kJ\) Nhận xét nào sau đây không đúng?
Đáp án : B Phương pháp giải :
Dựa vào giá trị biến thiên enthalpy của phản ứng. Lời giải chi tiết :
Nếu tăng áp suất thì cân bằng trên chuyển dịch theo chiều thuận do tổng mol khí tham gia lớn hơn mol khí sản phẩm. Đáp án B Phương pháp giải :
Sulfur tác dụng với thủy ngân (mercury) ở ngay nhiệt độ thường: phản ứng này được dùng để xử lí mercury rơi vãi. Hg + S → HgS Lời giải chi tiết :
Khi nhiệt kế thuỷ ngân vỡ, rắc chất bột sulfur lên thuỷ ngân rơi vãi sẽ chuyển hoá chúng thành hợp chất bền, ít độc hại. → Chọn D.
Câu 12 :
Chất khí nào sau đây không phải là nguyên nhân chính gây nên hiện tượng mưa acid?
Đáp án : D Phương pháp giải :
Dựa vào nguyên nhân gây hiện tượng mưa acid. Lời giải chi tiết :
CO2 không phải là nguyên nhân gây hiện tượng mưa acid. Đáp án D
Câu 13 :
Cho các phát biểu sau: (1) Dung dịch Na2CO3 làm phenolphtalein chuyển sang màu hồng. (2) Trong phản ứng thuận nghịch, tại thời điểm, tốc độ phản ứng nghịch ban đầu đạt lớn nhất sau đó giảm dần. (3) Nước cất chứa H2O, H+ và OH- (4) Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng dừng lại. (5) Trong dung dịch, ion HS- và HCO3- đều thể hiện tính lưỡng tính Số phát biểu đúng là:
Đáp án : B Phương pháp giải :
Dựa vào thuyết Bronsed – Lowry. Lời giải chi tiết :
(1) đúng (2) sai, tốc độ phản ứng nghịch ban đầu nhỏ nhất sau đó tăng dần. (3) đúng (4) sai, khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng vẫn tiếp tục. (5) đúng Đáp án B
Câu 14 :
Cho các nhận định sau về tính chất hóa học của nitric acid: (1) có tính acid mạnh; (2) có tính acid yếu; (3) có tính oxi hóa mạnh; (4) có tính khử mạnh. Số nhận định đúng là
Đáp án : B Phương pháp giải :
Dựa vào tính chất hóa học của nitric acid. Lời giải chi tiết :
Nitric acid có tính acid mạnh và tính oxi hóa mạnh Đáp án B
Câu 15 :
Trong phòng thí nghiệm người ta điều chế NO2 bằng cách cho Cu tác dụng với HNO3 đặc, đun nóng. NO2 có thể chuyển thành N2O4 theo cân bằng: 2NO2(g) N2O4(g) Cho biết NO2 là khí có màu nâu và N2O4 là khí không màu. Khi ngâm bình chứa NO2 vào chậu nước đá thấy màu trong bình khí nhạt dần. Hỏi phản ứng thuận trong cân bằng trên là:
Đáp án : A Phương pháp giải :
Dựa vào nguyên lí chuyển dịch cân bằng Le – Chatelier. Lời giải chi tiết :
Phản ứng trên là phản ứng tỏa nhiệt vì phản ứng tỏa nhiệt vì NO2 (nâu đỏ) chuyển dần sang N2O4 (không màu) nên thấy màu trong bình khí nhạt dần. Đáp án A
Câu 16 :
Cho phương trình nhiệt hóa học sau: C2H2(g) + H2O(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)CH3CHO(g) \({\Delta _r}H_{298}^o = - 151kJ\) Cân bằng hóa học sẽ chuyển dịch về phía tạo ra nhiều CH3CHO hơn khi
Đáp án : D Phương pháp giải :
Dựa vào nguyên lí chuyển dịch cân bằng Le – Chatelier. Lời giải chi tiết :
Để cân bằng hóa học chuyển dịch chiều thuận thì tăng áp suất của hệ phản ứng vì tổng số mol khí tham gia lớn hơn mol khí sản phẩm. Đáp án D
Câu 17 :
Chuẩn độ dung dịch NaOH chưa biết chính xác nồng độ (biết nồng độ trong khoảng gần với 0,1M) bằng dung dịch chuẩn HCl 0,1M với chỉ thị phenolphtalein. Tại thời điểm tương đương, điều nào sau đây không đúng?
Đáp án : B Phương pháp giải :
Dựa vào Phương pháp chuẩn độ. Lời giải chi tiết :
Tại thời điểm tương đương, số mol H+ bằng số mol OH – đã phản ứng. Khi thêm tiếp NaOH, bình tam giác chứa phenolphtalein sẽ chuyển sang màu hồng. Đáp án B
Câu 18 :
Cho các phát biểu sau: (1) Các muối ammonium đều là chất điện li mạnh, trong nước muối ammonium điện li hoàn toàn tạo ra ion NH4+ không màu, tạo môi trường base. (2) Khi cho Fe vào các acid HNO3 đặc, nguội có xảy ra phản ứng. (3) Sự chuyển dịch cân bằng là chuyển từ trạng thái cân bằng này thành trạng thái cân bằng khác. (4) Nitrogen được dùng làm căng vỏ bao bì thực phẩm do nitrogen nhẹ hơn không khí. (5) Các dung dịch NaCl, HCl, CH3COOH, H2SO4 có cùng nồng độ mol, dung dịch có pH nhỏ nhất là H2SO4. Số phát biểu không đúng là
Đáp án : A Phương pháp giải :
Dựa vào tính chất của nitric acid Lời giải chi tiết :
(1) sai, vì NH4+ tạo môi trường acid. (2) sai, Fe thụ động trong nitric acid đặc, nguội. (3) đúng (4) đúng (5) đúng Đáp án A
Phần 2. Câu hỏi đúng, sai
Câu 1 :
Phản ứng tổng hợp 3-methylbutyl acetate (isoamyl acetate) trong phòng thí nghiệm từ acetic acid và 3-methylbutan-1-ol (isoamyl alcohol) với xúc tác dung dịch H2SO4 đặc, đun nóng xảy ra theo phương trình hóa học sau:
Dùng dư acetic acid có thể làm tăng hiệu suất phản ứng.
Đúng
Sai
Tách lấy ester isoamyl acetate sẽ làm cân bằng chuyển dịch theo chiều thuận.
Đúng
Sai
Khi tăng áp suất cân bằng trên sẽ chuyển dịch theo chiều nghịch.
Đúng
Sai
H2SO4 đặc ngoài vai trò xúc tác còn hút nước làm tăng hiệu suất phản ứng.
Đúng
Sai
Đáp án
Dùng dư acetic acid có thể làm tăng hiệu suất phản ứng.
Đúng
Sai
Tách lấy ester isoamyl acetate sẽ làm cân bằng chuyển dịch theo chiều thuận.
Đúng
Sai
Khi tăng áp suất cân bằng trên sẽ chuyển dịch theo chiều nghịch.
Đúng
Sai
H2SO4 đặc ngoài vai trò xúc tác còn hút nước làm tăng hiệu suất phản ứng.
Đúng
Sai
Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến cân bằng hóa học. Lời giải chi tiết :
a. Đúng vì khi dùng dư (nhiều) acetic acid thì cân bằng chuyển dịch làm giảm acetic acid \( \Rightarrow \) chiều thuận \( \Rightarrow \) tăng hiệu suất phản ứng. b. Đúng vì khi tách lấy ester thì cân bằng chuyển dịch tạo ra ester \( \Rightarrow \) chiều thuận. c. Sai vì cân bằng hóa học trên không có chất khí tham gia nên áp suất không ảnh hưởng. d. Đúng vì H2SO4 đặc hút nước \( \Rightarrow \) cân bằng chuyển dịch tạo ra nước \( \Rightarrow \) chiều thuận \( \Rightarrow \) tăng hiệu suất phản ứng.
Câu 2 :
Cho dung dịch HNO3 0,1 M (bỏ qua sự điện li của H2O). Phương trình điện li của HNO3 là HNO3 → H+ + NO3-.
Đúng
Sai
Dung dịch HNO3 trong nước chứa các phần tử: H+, NO3-, HNO3, H2O.
Đúng
Sai
Nồng độ cation trong dung dịch là 0,1 M.
Đúng
Sai
Nồng độ anion trong dung dịch là 0,3 M.
Đúng
Sai
Đáp án
Phương trình điện li của HNO3 là HNO3 → H+ + NO3-.
Đúng
Sai
Dung dịch HNO3 trong nước chứa các phần tử: H+, NO3-, HNO3, H2O.
Đúng
Sai
Nồng độ cation trong dung dịch là 0,1 M.
Đúng
Sai
Nồng độ anion trong dung dịch là 0,3 M.
Đúng
Sai
Phương pháp giải :
Dựa vào sự điện li của nitric acid. Lời giải chi tiết :
a. Đúng. b. Sai vì dung dịch HNO3 trong nước chứa: H+, NO3-, H2O. c. Đúng. [H+] = [NO3-] = [HNO3] = 0,1 M. d. Sai vì [NO3-] = 0,1 M.
Câu 3 :
Phú dưỡng là hiện tượng dư thừa quá nhiều các nguyên tố dinh dưỡng (N, P) trong các nguồn nước làm cho các sinh vật trong nước như vi khuẩn, tảo, rong, rêu,… phát triển nhanh. Nguyên nhân gây ra hiện tượng phú dưỡng do nguồn nước thải nông nghiệp, công nghiệp, sinh hoạt, ... chưa xử lí triệt để thải vào ao hồ.
Đúng
Sai
Hiện tượng phú dưỡng làm giảm sự quang hợp của thực vật thủy sinh và làm tăng nguồn oxygen của tôm, cá, … gây mất cân bằng hệ sinh thái.
Đúng
Sai
Các loại tôm, cá, … ở ao hồ có hiện tượng phú dưỡng thường khỏe mạnh và béo tốt vì có nguồn chất dinh dưỡng phong phú.
Đúng
Sai
Để khắc phục hiện tượng phú dưỡng ta cần xử lí nước thải trước khi thải vào môi trường, sử dụng phân bón đúng liều lượng, khơi thông kênh rạch, ao hồ, lưu thông dòng nước.
Đúng
Sai
Đáp án
Nguyên nhân gây ra hiện tượng phú dưỡng do nguồn nước thải nông nghiệp, công nghiệp, sinh hoạt, ... chưa xử lí triệt để thải vào ao hồ.
Đúng
Sai
Hiện tượng phú dưỡng làm giảm sự quang hợp của thực vật thủy sinh và làm tăng nguồn oxygen của tôm, cá, … gây mất cân bằng hệ sinh thái.
Đúng
Sai
Các loại tôm, cá, … ở ao hồ có hiện tượng phú dưỡng thường khỏe mạnh và béo tốt vì có nguồn chất dinh dưỡng phong phú.
Đúng
Sai
Để khắc phục hiện tượng phú dưỡng ta cần xử lí nước thải trước khi thải vào môi trường, sử dụng phân bón đúng liều lượng, khơi thông kênh rạch, ao hồ, lưu thông dòng nước.
Đúng
Sai
Phương pháp giải :
Dựa vào hiện tượng phú dưỡng. Lời giải chi tiết :
a. đúng b. sai, làm giảm nguồn oxygen hòa tan trong nước. c. sai, các loại tôm, cá,… ở ao hồ có hiện tượng phú dưỡng thường chết, sinh trưởng chậm. d. đúng
Câu 4 :
Xét cấu tạo của phân tử NH3. Phân tử NH3 có dạng chóp tam giác gồm 1 nguyên tử N ở đỉnh liên kết với 3 nguyên tử H ở đáy.
Đúng
Sai
Trong NH3 chứa 3 liên kết N – H là các liên kết cộng hóa trị phân cực về phía H.
Đúng
Sai
Trong NH3, nguyên tử N còn cặp electron chưa tham gia liên kết.
Đúng
Sai
Giữa các phân tử NH3 có liên kết hydrogen.
Đúng
Sai
Đáp án
Phân tử NH3 có dạng chóp tam giác gồm 1 nguyên tử N ở đỉnh liên kết với 3 nguyên tử H ở đáy.
Đúng
Sai
Trong NH3 chứa 3 liên kết N – H là các liên kết cộng hóa trị phân cực về phía H.
Đúng
Sai
Trong NH3, nguyên tử N còn cặp electron chưa tham gia liên kết.
Đúng
Sai
Giữa các phân tử NH3 có liên kết hydrogen.
Đúng
Sai
Phương pháp giải :
Dựa vào cấu tạo của phân tử NH3 Lời giải chi tiết :
a. đúng b. sai, N – H là liên kết cộng hóa trị phân cực về phía N. c. đúng d. đúng
Phần 3. Trả lời ngắn
Phương pháp giải :
Dựa vào môi trường của các loại muối. Lời giải chi tiết :
Na2CO3, KOH, K3PO4 có môi trường base làm quỳ tím chuyển sang màu xanh. Đáp án 3 Phương pháp giải :
Dựa vào công thức tính hằng số cân bằng hóa học. Lời giải chi tiết :
[N2O4] = \(\frac{{0,02}}{{0,5}} = 0,04M\) N2O4(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2NO2(g) Trước phản ứng: 0,04 0 Phản ứng: x 2x Cân bằng: 0,0055 2x [NO2] = 2.(0,04 – 0,0055) = 0,069M KC = \(\frac{{{{{\rm{[}}N{O_2}]}^2}}}{{{\rm{[}}{N_2}{{\rm{O}}_4}]}} = \frac{{{{(0,069)}^2}}}{{0,0055}} = 0,865\) Phương pháp giải :
Dựa vào tính chất hóa học của nitrogen. Lời giải chi tiết :
n N2 = 9,916 : 24,79 = 0,4 mol N2 + 3H2 \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2NH3 n NH3 = 0,4.2.25% = 0,2 mol m NH3 = 0,2.17 = 3,4 g Phương pháp giải :
Dựa vào Phương pháp chuẩn độ. Lời giải chi tiết :
n OH – = 0,04.V n H+ = 0,02V \(O{H^ - } + {H^ + } \to {H_2}O\) 0,04V 0,02V n OH – dư = 0,04V – 0,02V = 0,02V [OH-] dư = \(\frac{{0,02V}}{{2V}} = 0,01M\) pOH = -lg[OH-] = 2 \( \to \) pH= 14 – 2 = 12
|














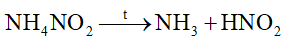
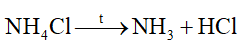
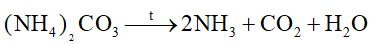
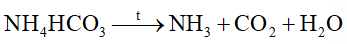
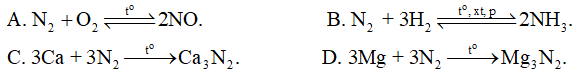
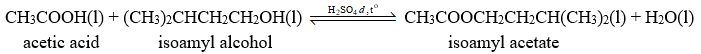
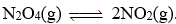 Ban đầu có 0,02 mol N2O4 trong bình kín có thể tích 500 mL, khi phản ứng đạt trạng thái cân bằng thì nồng độ của N2O4 là 0,0055 M. Giá trị của hằng số cân bằng KC là
Ban đầu có 0,02 mol N2O4 trong bình kín có thể tích 500 mL, khi phản ứng đạt trạng thái cân bằng thì nồng độ của N2O4 là 0,0055 M. Giá trị của hằng số cân bằng KC là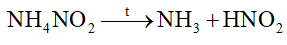







Danh sách bình luận