Trắc nghiệm Bài 5. Cấu tạo của bảng tuần hoàn các nguyên tố hóa học - Hóa 10 Kết nối tri thứcĐề bài
Câu 1 :
Các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử là
Câu 2 :
Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và số chu kì lớn là
Câu 3 :
Số nguyên tố trong chu kì 3 và 5 là
Câu 4 :
Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo nguyên tắc nào?
Câu 5 :
Tìm câu sai trong các câu sau đây:
Câu 6 :
Trong bảng tuần hoàn các nguyên tố hóa học, trừ chu kì 1, các chu kì đều bắt đầu bằng
Câu 7 :
Nguyên tử của nguyên tố X cố tổng số các hạt (p, n, e) bằng 40. Biết số khối A < 28. Trong bảng tuần hoàn các nguyên tố hóa học X thuộc
Câu 8 :
Cấu hình electron nguyên tử của các nguyên tố có số thứ tự lần lượt là 11, 19, 24 có đặc điểm gì giống nhau?
Câu 9 :
Các nguyên tố nhóm A trong bảng tuần hoàn là
Câu 10 :
Nguyên tố hóa học ở vị trí nào trong bảng tuần hoàn có các electron hóa trị là 3d34s2
Câu 11 :
Trong 20 nguyên tố đầu tiên của bảng tuần hoàn, có bao nhiêu nguyên tố khí hiếm?
Câu 12 :
Điện tích hạt nhân của các nguyên tử là : X (Z =6 ) , A ( Z = 7 ), M(z = 20 ) , Q (z = 19 ) Nhận xét nào đúng :
Câu 13 :
Cấu hình electron của ion Y2+ là [Ar]3d6. Cấu hình electron của nguyên tử Y là
Câu 14 :
Cấu hình electron của ion Y2+ là [Ar]3d6 . Vị trí của Y trong bảng tuần hoàn
Câu 15 :
Cation R+ có cấu hình electron 1s22s22p63s23p6. Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là
Câu 16 :
Anion X- và cation Y2+ đều có cấu hình electron lớp ngoài cùng là 3s23p6. Vị trí của các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học là:
Câu 17 :
Cấu hình electron của ion X2+ là 1s22s22p63s23p63d6. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X thuộc
Câu 18 :
Nguyên tử của nguyên tố X có tổng số electron trong các phân lớp p là 7. Số hạt mang điện của nguyên tử Y nhiều hơn số hạt mang điện của nguyên tử X là 8 hạt. Cấu hình electron và số hiệu nguyên tử của X là
Câu 19 :
Nguyên tử của nguyên tố X có khả năng tạo được anion X- có 117 hạt cơ bản (p, n, e). Vị trí của X trong bảng tuần hoàn là:
Câu 20 :
Một ion M3+ có tổng số hạt proton, neutron, electron là 73, biết trong ion M3+ có số hạt mang điện nhiều hơn số hạt không mang điện là 17. Vị trí của M trong bảng tuần hoàn hóa học là
Lời giải và đáp án
Câu 1 :
Các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử là
Đáp án : C Phương pháp giải :
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần Lời giải chi tiết :
Số thứ tự chu kì = số lớp electron của nguyên tố => Các nguyên tố ở chu kì 6 có 6 lớp electron
Câu 2 :
Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và số chu kì lớn là
Đáp án : B Phương pháp giải :
- Chu kì 1, 2, 3 được gọi là chu kì nhỏ - Chu kì 4, 5, 6, 7 được gọi là chu kì lớn Lời giải chi tiết :
- Có 3 chu kì nhỏ đó là chu kì 1, 2, 3 - Có 4 chu kì lớn đó là chu kì 4, 5, 6, 7
Câu 3 :
Số nguyên tố trong chu kì 3 và 5 là
Đáp án : A Lời giải chi tiết :
- Chu kì 3 có 8 nguyên tố - Chu kì 5 có 18 nguyên tố
Câu 4 :
Trong bảng tuần hoàn, các nguyên tố được sắp xếp theo nguyên tắc nào?
Đáp án : D Phương pháp giải :
- Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn + Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử + Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng + Các nguyên tố có số electron hóa trị trong nguyên tử như nhau được xếp thành một cột Lời giải chi tiết :
Theo nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn => Cả 3 đáp án A, B và C đều đúng
Câu 5 :
Tìm câu sai trong các câu sau đây:
Đáp án : C Lời giải chi tiết :
A. Đúng B. Đúng C. Sai vì số thứ tự của chu kì bằng số lớp electron trong nguyên tử D. Đúng
Câu 6 :
Trong bảng tuần hoàn các nguyên tố hóa học, trừ chu kì 1, các chu kì đều bắt đầu bằng
Đáp án : A Lời giải chi tiết :
Chu kì nào cũng được bắt đầu bằng một kim loại điển hình (trừ chu kì 1) cuối chu kì là phi kim điển hình và kết thúc bằng một khí hiếm.
Câu 7 :
Nguyên tử của nguyên tố X cố tổng số các hạt (p, n, e) bằng 40. Biết số khối A < 28. Trong bảng tuần hoàn các nguyên tố hóa học X thuộc
Đáp án : A Phương pháp giải :
Áp dụng công thức: $1 \leqslant \frac{N}{Z} \leqslant 1,5$ Lời giải chi tiết :
Câu 8 :
Cấu hình electron nguyên tử của các nguyên tố có số thứ tự lần lượt là 11, 19, 24 có đặc điểm gì giống nhau?
Đáp án : A Phương pháp giải :
Viết cấu hình electron => Xét điểm giống nhau Lời giải chi tiết :
Cấu hình electron Z = 11: 1s22s22p63s1 Z = 19: 1s22s22p63s23p64s1 Z = 24:1s22s22p63s23p63d54s1 => Có đặc điểm giống nhau là có cùng 1 electron lớp ngoài cùng
Câu 9 :
Các nguyên tố nhóm A trong bảng tuần hoàn là
Đáp án : C Lời giải chi tiết :
Các nguyên tố nhóm A trong bảng tuần hoàn là các nguyên tố s và nguyên tố p
Câu 10 :
Nguyên tố hóa học ở vị trí nào trong bảng tuần hoàn có các electron hóa trị là 3d34s2
Đáp án : B Phương pháp giải :
Nắm được cách từ cấu hình e nguyên tử suy ra vị trí của nguyên tố trong bảng tuần hoàn Lời giải chi tiết :
Nguyên tố có 4 lớp e => Chu kì 4 Nguyên tố có e cuối cùng được điền vào phân lớp d => Thuộc nhóm B Nguyên tố có 5e lớp ngoài cùng => Nhóm VB
Câu 11 :
Trong 20 nguyên tố đầu tiên của bảng tuần hoàn, có bao nhiêu nguyên tố khí hiếm?
Đáp án : A Phương pháp giải :
Dựa vào bảng tuần hoàn hóa học Lời giải chi tiết :
Có 3 nguyên tố khí hiếm là: He, Ar, Ne Đáp án A
Câu 12 :
Điện tích hạt nhân của các nguyên tử là : X (Z =6 ) , A ( Z = 7 ), M(z = 20 ) , Q (z = 19 ) Nhận xét nào đúng :
Đáp án : B Phương pháp giải :
Dựa vào số hiệu nguyên tử nguyên tố để xác định vị trí của nguyên tố trong bảng tuần hoàn Lời giải chi tiết :
M, Q lần lượt là nguyên tố Ca, K thuộc cùng chu kì 4 Đáp án B
Câu 13 :
Cấu hình electron của ion Y2+ là [Ar]3d6. Cấu hình electron của nguyên tử Y là
Đáp án : B Phương pháp giải :
Dựa vào cấu hình electron của ion Y2+ để xác định cấu hình của nguyên tử Y Lời giải chi tiết :
Ion Y2+ đã nhường đi 2 electron => cấu hình nguyên tử Y là: [Ar]3d64s2.
Câu 14 :
Cấu hình electron của ion Y2+ là [Ar]3d6 . Vị trí của Y trong bảng tuần hoàn
Đáp án : A Phương pháp giải :
Dựa vào cấu hình electron của ion Y2+ để xác định vị trí của Y Lời giải chi tiết :
Cấu hình electron của Y là: [Ar]3d64s2. => Y có 26 electron Vị trí của Y trong bảng tuần hoàn: số thứ tự 26, chu kì 4, nhóm VIIIB Đáp án A
Câu 15 :
Cation R+ có cấu hình electron 1s22s22p63s23p6. Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là
Đáp án : A Phương pháp giải :
Dựa vào cấu hình của R+ Lời giải chi tiết :
Cation R+ đã nhường 1 electron => cấu hình electron của R là: 1s22s22p63s23p6 4s1 R thuộc nhóm IA, chu kì 4 Đáp án A
Câu 16 :
Anion X- và cation Y2+ đều có cấu hình electron lớp ngoài cùng là 3s23p6. Vị trí của các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học là:
Đáp án : C Phương pháp giải :
Dựa vào cấu hình của anion X- và cation Y2+ Lời giải chi tiết :
Từ cấu hình electron của anion X- => Cấu hình của X là: 1s2 2s2 2p6 3s2 3p5 Từ cấu hình electron của cation Y2+ => cấu hình của Y là: 1s2 2s2 2p6 3s2 3p6 4s2 => X ở ô số 17, chu kì 3, nhóm VIIA; Y ở ô số 20, chu kì 4, nhóm IIA. Đáp án C
Câu 17 :
Cấu hình electron của ion X2+ là 1s22s22p63s23p63d6. Trong bảng tuần hoàn các nguyên tố hoá học, nguyên tố X thuộc
Đáp án : D Phương pháp giải :
Dựa vào cấu hình electron của ion X2+ Lời giải chi tiết :
Cấu hình electron của X là: 1s22s22p63s23p63d64s2 => X thuộc chu kì 4, nhóm VIIIB Đáp án D
Câu 18 :
Nguyên tử của nguyên tố X có tổng số electron trong các phân lớp p là 7. Số hạt mang điện của nguyên tử Y nhiều hơn số hạt mang điện của nguyên tử X là 8 hạt. Cấu hình electron và số hiệu nguyên tử của X là
Đáp án : A Phương pháp giải :
Tính số hạt p của X và Y để xác định được X Lời giải chi tiết :
X có tổng số electron trong các phân lớp p là 7 => cấu hình electron X: 1s22s22p63s23p1 (Z =13) 2ZY – 2ZX = 8 => ZY – ZX = 4 => ZY =4 + ZX = 4 +13 = 17
Câu 19 :
Nguyên tử của nguyên tố X có khả năng tạo được anion X- có 117 hạt cơ bản (p, n, e). Vị trí của X trong bảng tuần hoàn là:
Đáp án : C Lời giải chi tiết :
X có 116 hạt \( \Rightarrow \) N = 116 – 2Z \(\frac{{116}}{{3,5}} \le Z \le \frac{{116}}{3} \Rightarrow 33,1 \le Z \le 38,7\)
\( \Rightarrow \) Cấu hình electron của Br: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5 \( \Rightarrow \) Chọn C
Câu 20 :
Một ion M3+ có tổng số hạt proton, neutron, electron là 73, biết trong ion M3+ có số hạt mang điện nhiều hơn số hạt không mang điện là 17. Vị trí của M trong bảng tuần hoàn hóa học là
Đáp án : B Lời giải chi tiết :
2Z + N = 73 +3 và 2Z –N = 17+3 => Z = 24; N =28 Cấu hình electron M: 1s2 2s2 2p6 3s2 3p6 3d5 4s1 => chu kì 4, nhóm VIB
|














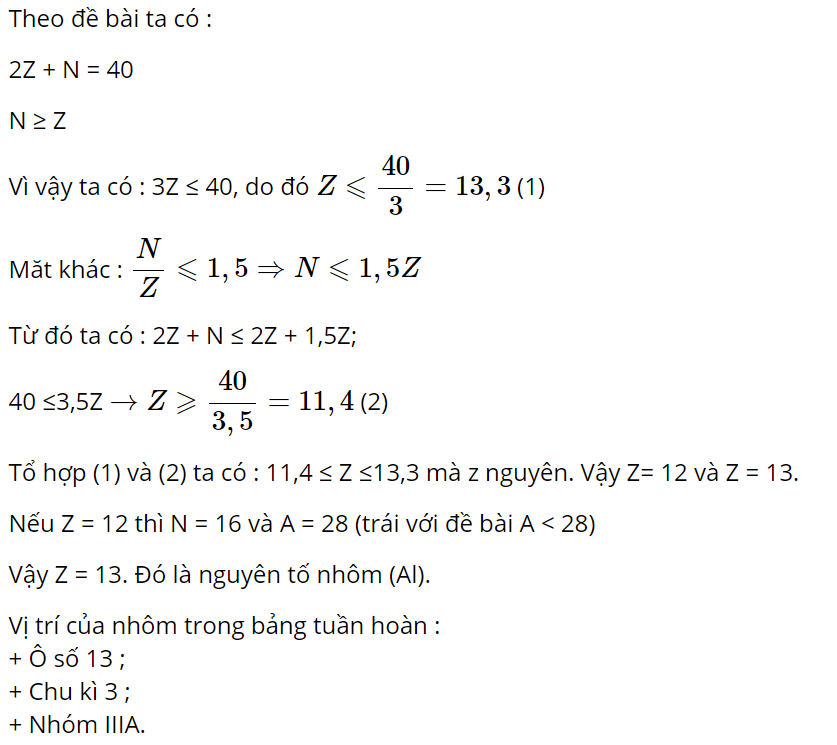





Danh sách bình luận