Trắc nghiệm Bài 10. Quy tắc octet - Hóa 10 Kết nối tri thứcĐề bài
Câu 1 :
Liên kết hóa học là
Câu 2 :
Theo nguyên tắc octet, khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như
Câu 3 :
Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet?
Câu 4 :
Liên kết hoá học là
Câu 5 :
Theo quy tắc octet, khi hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như
Câu 6 :
Khi hình thành liên kết hoá học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet?
Câu 7 :
Công thức cấu tạo nào sau đây không đủ electron theo quy tắc octet?
Câu 8 :
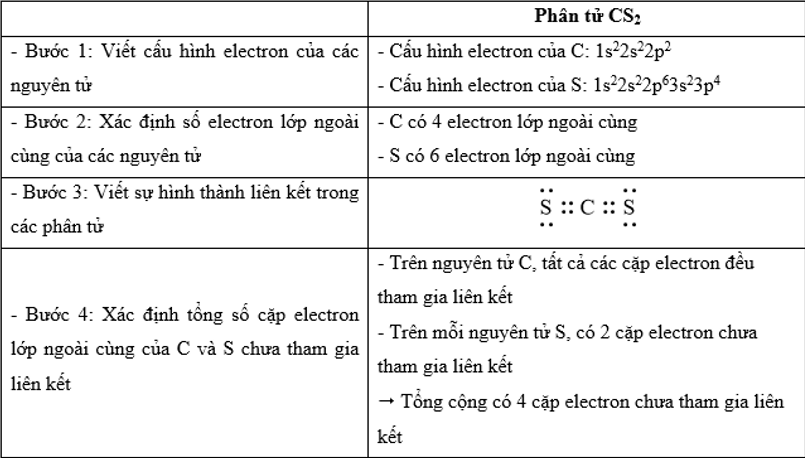
Trong công thức CS2, tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là
Câu 9 :
Phân tử nào sau đây có các nguyên tử đều đã đạt cấu hình electron bão hòa theo quy tắc octet?
Câu 10 :
Quy tắc octet không đúng với trường hợp phân tử chất nào sau đây?
Câu 11 :
Vì sao các nguyên tử lại liên kết với nhau thành phân tử?
Câu 12 :
Nguyên tử nào sau đây có khuynh hướng đạt cấu hình electron bền của khí hiếm neon khi tham gia hình thành liên kết hóa học?
Câu 13 :
Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do khả năng giải phóng hydrogen của nó. Trong sodium hydride, nguyên tử sodium có cấu hình electron bền của khí hiếm
Câu 14 :
Khi tham gia hình thành liên kết hoá học, các nguyên tử lithium và chlorine có khuynh hướng đạt cấu hình electron bền của lần lượt các khí hiếm nào dưới đây?
Câu 15 :
Trong phân tử HBr, nguyên tử hydrogen và bromine đã lần lượt đạt cấu hình electron bền của các khí hiếm nào dưới đây?
Câu 16 :
Trong các hợp chất, nguyên tử magnesium đã đạt được cấu hình bền của khí hiếm gần nhất bằng cách
Câu 17 :
Cho các phân tử sau: Cl2, H2O, NaF và CH4. Có bao nhiêu nguyên tử trong các phân tử trên đạt cấu hình electron bền của khí hiếm neon?
Câu 18 :
Nguyên tử trong phân tử nào dưới đây ngoại lệ với quy tắc octet?
Lời giải và đáp án
Câu 1 :
Liên kết hóa học là
Đáp án : B Lời giải chi tiết :
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn
Câu 2 :
Theo nguyên tắc octet, khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như
Đáp án : D Lời giải chi tiết :
Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của khí hiếm
Câu 3 :
Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet?
Đáp án : A Phương pháp giải :
Viết cấu hình electron của các nguyên tử có số hiệu nguyên tử Z = 12, 9, 11, 10 Nguyên tử nào có 2 electron ở lớp ngoài cùng => Có xu hướng nhường 2 electron Lời giải chi tiết :
Z = 12: 1s22s22p63s2 Z = 9: 1s22s22p5 Z = 11: 1s22s22p63s1 Z = 10: 1s22s22p6 Ta thấy nguyên tử có Z = 12 thì có 2 electron ở lớp ngoài cùng => Có xu hướng nhường 2 electron
Câu 4 :
Liên kết hoá học là
Đáp án : B Phương pháp giải :
Dựa vào định nghĩa của liên kết hóa học: liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn Lời giải chi tiết :
- Đáp án: B
Câu 5 :
Theo quy tắc octet, khi hình thành liên kết hoá học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như
Đáp án : D Phương pháp giải :
Dựa vào - Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium) Lời giải chi tiết :
- Đáp án: D
Câu 6 :
Khi hình thành liên kết hoá học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet?
Đáp án : A Phương pháp giải :
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn - Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó + Nếu khí hiếm đứng trước nguyên tử của nguyên tố đang xét => cho đi (trừ đi) số electron = sự chênh lệch vị trí giữa hai nguyên tố + Nếu khí hiếm đứng sau nguyên tử của nguyên tố đang xét => nhận thêm (cộng thêm) số electron = sự chênh lệch vị trí giữa hai nguyên tố Lời giải chi tiết :
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
- Bước 2: + Nguyên tố này có xu hướng nhường 2 electron để đạt cấu hình electron bền vững + Khí hiếm gần 4 nguyên tố trong đề cho nhất là Z=10 => Nguyên tử này sẽ ở ô số 10 + 2 = 12 => Đáp án: A
Câu 7 :
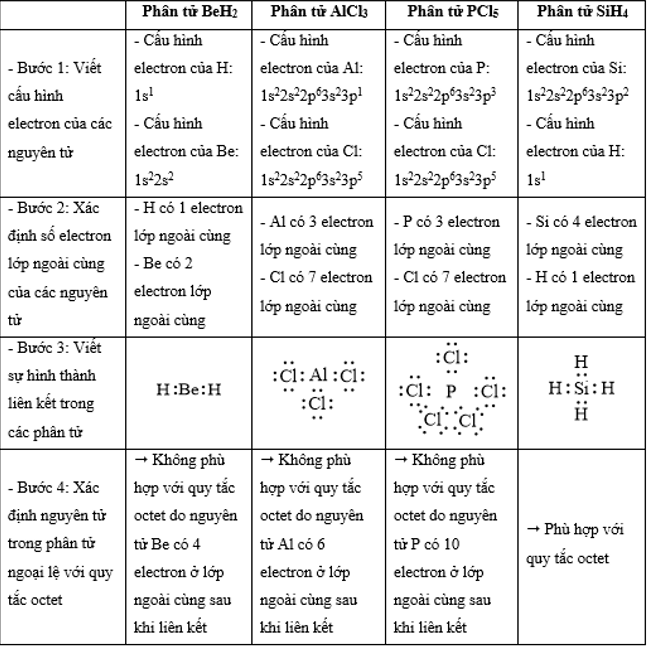
Công thức cấu tạo nào sau đây không đủ electron theo quy tắc octet?
Đáp án : B Phương pháp giải :
Dựa vào - Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium) Lời giải chi tiết :
- Đáp án: B vì lớp vỏ ngoài cùng của nguyên tử B mới chỉ có 6 electron
Câu 8 :
Trong công thức CS2, tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là
Đáp án : C Phương pháp giải :
Dựa vào - Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium) - Các bước thực hiện: + Bước 1: Viết cấu hình electron của các nguyên tử + Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử + Bước 3: Viết sự hình thành liên kết trong các phân tử + Bước 4: Xác định tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết Lời giải chi tiết :
Câu 9 :
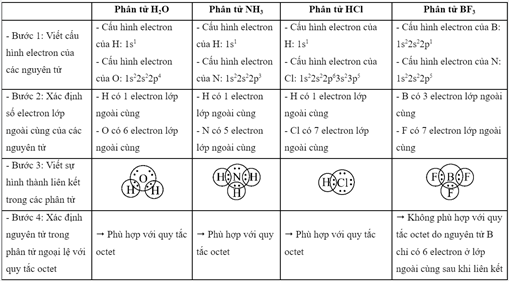
Phân tử nào sau đây có các nguyên tử đều đã đạt cấu hình electron bão hòa theo quy tắc octet?
Đáp án : D Phương pháp giải :
Dựa vào - Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium) - Các bước thực hiện: + Bước 1: Viết cấu hình electron của các nguyên tử + Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử + Bước 3: Viết sự hình thành liên kết trong các phân tử + Bước 4: Xác định nguyên tử trong phân tử ngoại lệ với quy tắc octet Lời giải chi tiết :
Câu 10 :
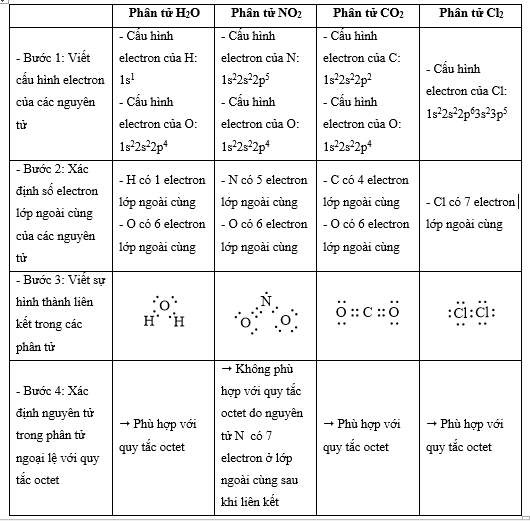
Quy tắc octet không đúng với trường hợp phân tử chất nào sau đây?
Đáp án : B Phương pháp giải :
Dựa vào - Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium) - Các bước thực hiện: + Bước 1: Viết cấu hình electron của các nguyên tử + Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử + Bước 3: Viết sự hình thành liên kết trong các phân tử + Bước 4: Xác định nguyên tử trong phân tử ngoại lệ với quy tắc octet Lời giải chi tiết :
=> Đáp án: B
Câu 11 :
Vì sao các nguyên tử lại liên kết với nhau thành phân tử?
Đáp án : A Phương pháp giải :
Để đạt cấu hình electron bền vững của khí hiếm gần nhất, các nguyên tử của các nguyên tố có xu hướng nhường, hoặc nhận thêm, hoặc góp chung các electron hóa trị với các nguyên tử khác khi tham gia liên kết hóa học. Lời giải chi tiết :
- Đáp án: A
Câu 12 :
Nguyên tử nào sau đây có khuynh hướng đạt cấu hình electron bền của khí hiếm neon khi tham gia hình thành liên kết hóa học?
Đáp án : C Phương pháp giải :
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn - Bước 2: Tìm nguyên tử đó dựa vào: nguyên tử của nguyên tố có khuynh hướng đạt cấu hình electron bền của khí hiếm ở gần nó nhất Lời giải chi tiết :
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
- Bước 2: Nguyên tố Oxygen có vị trí gần với khí hiếm Neon nhất => Đáp án: C
Câu 13 :
Sodium hydride (NaH) là một hợp chất được sử dụng như một chất lưu trữ hydrogen trong các phương tiện chạy bằng pin nhiên liệu do khả năng giải phóng hydrogen của nó. Trong sodium hydride, nguyên tử sodium có cấu hình electron bền của khí hiếm
Đáp án : D Phương pháp giải :
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn - Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó Lời giải chi tiết :
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
- Bước 2: Nguyên tố Sodium có vị trí gần với khí hiếm Neon nhất => Đáp án: D
Câu 14 :
Khi tham gia hình thành liên kết hoá học, các nguyên tử lithium và chlorine có khuynh hướng đạt cấu hình electron bền của lần lượt các khí hiếm nào dưới đây?
Đáp án : A Phương pháp giải :
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn - Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó Lời giải chi tiết :
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
- Bước 2: + Nguyên tố Lithium có vị trí gần với khí hiếm Helium nhất + Nguyên tố Chlorine có vị trí gần với khí hiếm Argon nhất => Đáp án: C
Câu 15 :
Trong phân tử HBr, nguyên tử hydrogen và bromine đã lần lượt đạt cấu hình electron bền của các khí hiếm nào dưới đây?
Đáp án : D Phương pháp giải :
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn - Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó Lời giải chi tiết :
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
- Bước 2: + Nguyên tố Hydrogen có vị trí gần với khí hiếm Helium nhất + Nguyên tố Bromine có vị trí gần với khí hiếm Krypton nhất => Đáp án: D
Câu 16 :
Trong các hợp chất, nguyên tử magnesium đã đạt được cấu hình bền của khí hiếm gần nhất bằng cách
Đáp án : A Phương pháp giải :
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn - Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó + Nếu khí hiếm đứng trước nguyên tử của nguyên tố đang xét " cho đi (trừ đi) số electron = sự chênh lệch vị trí giữa hai nguyên tố + Nếu khí hiếm đứng sau nguyên tử của nguyên tố đang xét " nhận thêm (cộng thêm) số electron = sự chênh lệch vị trí giữa hai nguyên tố Lời giải chi tiết :
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
- Bước 2: Nguyên tố Magnesium (ô số 12) có vị trí gần với khí hiếm Neon (ô số 10) nhất => Nguyên tử của nguyên tố Magnesium sẽ cho đi 12 - 10 = 2 electron để đạt cấu hình của khí hiếm gần nhất => Đáp án: A
Câu 17 :
Cho các phân tử sau: Cl2, H2O, NaF và CH4. Có bao nhiêu nguyên tử trong các phân tử trên đạt cấu hình electron bền của khí hiếm neon?
Đáp án : D Phương pháp giải :
- Bước 1: Xác định vị trí nguyên tử của nguyên tố trong bảng tuần hoàn - Bước 2: Xác định vị trí khí hiếm gần nhất với nguyên tố đó Lời giải chi tiết :
- Bước 1: Vị trí của các nguyên tố trong bảng tuần hoàn hóa học
- Bước 2: Các nguyên tố Carbon, Oxygen, Fluorine và Sodium có vị trí gần với khí hiếm Neon nhất => Đáp án: D
Câu 18 :
Nguyên tử trong phân tử nào dưới đây ngoại lệ với quy tắc octet?
Đáp án : D Phương pháp giải :
- Quy tắc octet: Trong quá trình hình thành liên kết hóa học, nguyên tử của các nguyên tố nhóm A có xu hướng tạo thành lớp vỏ ngoài cùng có 8 electron tương ứng với khí hiếm gần nhất (hoặc 2 electron với khí hiếm Helium) - Các bước thực hiện: + Bước 1: Viết cấu hình electron của các nguyên tử + Bước 2: Xác định số electron lớp ngoài cùng của các nguyên tử + Bước 3: Viết sự hình thành liên kết trong các phân tử + Bước 4: Xác định nguyên tử trong phân tử ngoại lệ với quy tắc octet Lời giải chi tiết :
|














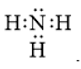
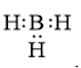
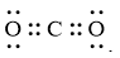
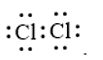





Danh sách bình luận