Trắc nghiệm Bài 15. Phản ứng oxi hóa - khử - Hóa 10 Kết nối tri thứcĐề bài
Câu 1 :
Số oxi hóa của nitơ trong NH4+ , NO2- , và HNO3 lần lượt là:
Câu 2 :
Số oxi hóa của Mn, Fe trong Fe3+ , S trong SO3 , P trong PO43-lần lượt là:
Câu 3 :
Phản ứng nào là phản ứng oxi hoá - khử?
Câu 4 :
Ở phản ứng nào NH3 không đóng vai trò chất khử ?
Câu 6 :
Phản ứng nào là phản ứng oxi hoá - khử?
Câu 7 :
Cho sơ đồ phản ứng : \(F{e_3}{O_4} + HN{O_3} \to Fe{\left( {N{O_3}} \right)_3} + NO + {H_2}O\) Cân bằng PTHH của phản ứng trên. Các hệ số tương ứng với phân tử các chất là dãy số nào sau đây ?
Câu 8 :
Trong phản ứng đốt cháy \(CuFeS_2\) tạo ra sản phẩm \(CuO, Fe_2O_3\) và \(SO_2\) thì một phân tử \(CuFeS_2\) sẽ
Câu 9 :
Cho phản ứng : M2Ox + HN03 —> M(NO3)3 + ... Khi x có giá trị là bao nhiêu thì phản ứng trên không thuộc loại phản ứng oxi hoá - khử ?
Câu 10 :
Trong phản ứng: \(C{l_2} + {H_2}O \to HCl + HClO\), các nguyên tử Cl
Câu 11 :
Để oxi hóa hoàn toàn 0,1 mol hỗn hợp gồm Al và Fe cần dùng V lít O2 (đkc). Giá trị của V là
Câu 12 :
Cho 3,7185 lít khí Cl2 tác dụng với bột Fe (dư). Sau khi phản ứng hoàn toàn thu được m gam muối. Giá trị của m là
Câu 13 :
Cho 4,33825 lít (đkc) hỗn hợp khí X gồm Cl2 và O2 phản ứng vừa đủ với 5,55 gam hỗn hợp Y gồm Mg và Al, thu được 15,05 gam hỗn hợp Z. Phần trăm khối lượng của Mg trong Y là
Câu 14 :
Hỗn hợp X gồm Cl2 và O2 phản ứng vừa hết với 9,6 gam Mg và 16,2 gam Al tạo ra 74,1 gam hỗn hợp muối chloride và oxide. Thành phần % theo khối lượng của Cl2 trong X là
Câu 15 :
Cho 19,2g Cu phản ứng với 500ml dung dịch NaNO3 1M và 500ml HCl 2M thu được V lít NO (sản phẩm khử duy nhất ở đkc). Giá trị của V là
Câu 16 :
Trộn 8,4 gam bột Fe và 3,2 gam bột S, đun nóng hỗn hợp (không có không khí) cho phản ứng xảy ra hoàn toàn. Sản phẩm thu được hòa tan hoàn toàn trong dung dịch H2SO4 đặc nóng thấy thoát ra V lít khí SO2 (ở đkc). Giá trị của V là
Câu 17 :
Tiến hành các thí nghiệm sau: a) Sục khí etilen vào dung dịch KMnO4 loãng. b) Cho hơi ancol etylic đi qua bột CuO nung nóng. c) Sục khí etilen vào dung dịch Br2 trong CCl4. d) Cho dung dịch glucozơ vào dung dịch AgNO3 trong NH3 dư, đun nóng. e) Cho Fe2O3 vào dung dịch H2SO4 đặc, nóng. Trong các thí nghiệm trên, số thí nghiệm có xảy ra phản ứng oxi hóa - khử là
Câu 18 :
Cho từng chất Fe, FeS, FeO, Fe2O3, Fe3O4, Fe(OH)2, Fe(OH)3, FeBr2, FeBr3, FeCl2, FeCl3 lần lượt tác dụng với dung dịch H2SO4 đặc, nóng. Số trường hợp xảy ra phản ứng oxi hóa-khử là:
Lời giải và đáp án
Câu 1 :
Số oxi hóa của nitơ trong NH4+ , NO2- , và HNO3 lần lượt là:
Đáp án : B Phương pháp giải :
Trong hầu hết các hợp chất lấy H có hóa trị I => số oxi hóa là +1 O có hóa trị II => số oxi hóa là -2 Tất cả các kim loại kiềm, kiềm thổ có hóa trị ứng với số nhóm trong bảng tuần hoàn => có số oxi hóa + 1; + 2 Nguyên tử luôn trung hòa về điện => tổng số oxi hóa của các chất trong phân tử = 0 => từ đó tính được số oxi hóa của các chất chưa biết. Lời giải chi tiết :
Gọi số oxi hóa của N trong các hợp chất là x Ta có: NH4+: x + 4 = 1 \( \to\) x = -3 \( \to\) số oxi hóa của N trong NH4+ là -3 NO2-: x + 2.(-2) = -1 \( \to\) x = 3 \( \to\) số oxi hóa của N trong NO2- là +3 HNO3: 1 + x + 3.(-2) = 0 \( \to\) x = 5 \( \to\) số oxi hóa của N trong HNO3 là +5
Câu 2 :
Số oxi hóa của Mn, Fe trong Fe3+ , S trong SO3 , P trong PO43-lần lượt là:
Đáp án : A Phương pháp giải :
Trong hầu hết các hợp chất lấy H có hóa trị I => số oxi hóa là +1 O có hóa trị II => số oxi hóa là -2 Tất cả các kim loại kiềm, kiềm thổ có hóa trị ứng với số nhóm trong bảng tuần hoàn => có số oxi hóa + 1; + 2 Nguyên tử luôn trung hòa về điện => tổng số oxi hóa của các chất trong phân tử = 0 => từ đó tính được số oxi hóa của các chất chưa biết. Lời giải chi tiết :
Mn là đơn chất nên có số oxi hóa 0 Fe3+ có số oxi hóa +3 SO3: x + 3.(-2) = 0 \( \to\) x = 6 \( \to\) số oxi hóa của S là +6 PO43-: x + 4.(-2) = -3 \( \to\) x = 5 \( \to\) số oxi hóa của P là +5
Câu 3 :
Phản ứng nào là phản ứng oxi hoá - khử?
Đáp án : A Phương pháp giải :
Phản ứng oxi hóa khử là phản ứng hóa học trong đó đồng thời xảy ra sự oxi hóa và sự khử. Tức số oxi hóa của các chất trước và sau phản ứng thay đổi. Lời giải chi tiết :
Những phản ứng theo đề bài cho, phản ứng oxi hóa khử là \(2HgO\xrightarrow{{{t^0}}}2Hg + {O_2}\) Hg2+ + 2e \( \to\) Hg0 2O2- \( \to\) O2 + 4e Còn các phản ứng khác không phải là phản ứng oxi hóa khử
Câu 4 :
Ở phản ứng nào NH3 không đóng vai trò chất khử ?
Đáp án : D Phương pháp giải :
NH3 đóng vai trò là chất khử khi số oxi hóa của NH3 tăng sau phản ứng => các phản ứng còn lại NH3 sẽ đóng vai trò là chất oxi hóa Lời giải chi tiết :
A,B,C số oxi hóa của NH3 đều tăng sau phản ứng => đóng vai trò là chất khử => ở phản ứng D NH3 đóng vai trò là môi trường
Đáp án : C Phương pháp giải :
Chất oxi hóa là chất nhận e (tham gia quá trình khử) Chất khử là chất cho e (tham gia quá trình oxi hóa) Lời giải chi tiết :
NO2 đóng vai trò vừa là chất oxi hoá vừa là chất khử
Quá trình 1 là quá trình khử Quá trình 2 là quá trình oxi hóa
Câu 6 :
Phản ứng nào là phản ứng oxi hoá - khử?
Đáp án : C Phương pháp giải :
Phản ứng oxi hóa khử là phản ứng hóa học trong đó đồng thời xảy ra sự oxi hóa và sự khử( tức các chất có sự thay đổi số oxi hóa trước và sau phản ứng) => tìm ra được phản ứng oxi hóa khử. Lời giải chi tiết :
Trong các phản ứng trên chi có phản ứng C là phản ứng oxi hoá - khử vì có sự thay đổi số oxi hoá của các nguyên tố.
Câu 7 :
Cho sơ đồ phản ứng : \(F{e_3}{O_4} + HN{O_3} \to Fe{\left( {N{O_3}} \right)_3} + NO + {H_2}O\) Cân bằng PTHH của phản ứng trên. Các hệ số tương ứng với phân tử các chất là dãy số nào sau đây ?
Đáp án : B Phương pháp giải :
Cân bằng PTHH theo phương pháp thăng bằng electron Lời giải chi tiết :
\(3F{e_3}{O_4} + 28HN{O_3} \to 9Fe{\left( {N{O_3}} \right)_3} + NO + 14{H_2}O\)
Câu 8 :
Trong phản ứng đốt cháy \(CuFeS_2\) tạo ra sản phẩm \(CuO, Fe_2O_3\) và \(SO_2\) thì một phân tử \(CuFeS_2\) sẽ
Đáp án : C Phương pháp giải :
Viết quá trình oxi hóa của \(CuFeS_2\) Lời giải chi tiết :
\(\mathop {CuFe{S_2}}\limits^0 \to \mathop {Cu}\limits^{ + 2} + \mathop {Fe}\limits^{ + 3} + 2\mathop S\limits^{ + 4} + 13e\) => 1 phân tử \(CuFeS_2\) nhường 13e
Câu 9 :
Cho phản ứng : M2Ox + HN03 —> M(NO3)3 + ... Khi x có giá trị là bao nhiêu thì phản ứng trên không thuộc loại phản ứng oxi hoá - khử ?
Đáp án : D Phương pháp giải :
Để phản ứng không là phản ứng oxi hóa khử khi số oxi hóa của các nguyên tố trong phản ứng không thay đổi Lời giải chi tiết :
Vì x = 3 thì số oxi hóa của M trước và sau phản ứng không thay đổi vẫn là +3
Câu 10 :
Trong phản ứng: \(C{l_2} + {H_2}O \to HCl + HClO\), các nguyên tử Cl
Đáp án : C Phương pháp giải :
Xác định số oxi hóa của Cl trước và sau phản ứng Số oxi hóa tăng => Chất khử, bị oxi hóa Số oxi hóa giảm => Chất oxi hóa, bị khử Lời giải chi tiết :
Ta có: \({\mathop {Cl_2}\limits^0} + {H_2}O \to H\mathop {Cl}\limits^{ - 1} + H\mathop {Cl}\limits^{ + 1} O\) Số oxi hóa của Cl vừa tăng, vừa giảm => Cl vừa bị oxi hoá, vừa bị khử.
Câu 11 :
Để oxi hóa hoàn toàn 0,1 mol hỗn hợp gồm Al và Fe cần dùng V lít O2 (đkc). Giá trị của V là
Đáp án : C Phương pháp giải :
Dựa vào phương pháp bảo toàn electron Lời giải chi tiết :
Vì hỗn hợp gồm Al và Fe đều nhường 3 electron => n e nhường = 0,1 . 3 = 0,3 mol \(\begin{array}{l}{\mathop O\limits^o _2}{\rm{ }} + {\rm{ }}4e{\rm{ }} \to {O^{ + 2}}\\{\rm{0,075}} \leftarrow {\rm{0,3}}\end{array}\) VO2 = 0,075. 24,79 = 1,86 lít
Câu 12 :
Cho 3,7185 lít khí Cl2 tác dụng với bột Fe (dư). Sau khi phản ứng hoàn toàn thu được m gam muối. Giá trị của m là
Đáp án : B Lời giải chi tiết :
\(\begin{array}{l}3C{l_2} + 2Fe \to 2FeC{l_3}\\0,15 \to {\rm{ 0,1}}\\{{\rm{m}}_{FeCl3}} = 0,1.162,5 = 16,25g\end{array}\) Đáp án B
Câu 13 :
Cho 4,33825 lít (đkc) hỗn hợp khí X gồm Cl2 và O2 phản ứng vừa đủ với 5,55 gam hỗn hợp Y gồm Mg và Al, thu được 15,05 gam hỗn hợp Z. Phần trăm khối lượng của Mg trong Y là
Đáp án : B Phương pháp giải :
Dựa vào phương pháp bảo toàn khối lượng và bảo toàn electron Lời giải chi tiết :
n X = 4,33825 : 24,79 = 0,175 mol Bảo toàn khối lượng: m X + m Y = m Z => m X = 15,05 – 5,55 = 9,5g Gọi số mol của Cl2 và O2 lần lượt là a và b (mol) Ta có: n Cl2 + n O2 = 0,175 => a + b = 0,175 (1) m Cl2 + m O2 = 9,5 => 71a + 32b = 9,5 (2) từ (1) và (2) ta có: a = 0,1 và b = 0,075 gọi số mol của Mg và Al lần lượt là x và y (mol) \(\begin{array}{l}M{g^0} \to M{g^{ + 2}} + 2e {\rm{ Cl}}_2^0 + 2e \to C{l^{ - 1}}\\x \to {\rm{ 2x 0,1}} \to {\rm{0,2}}\\{\rm{A}}{{\rm{l}}^0} \to A{l^{ + 3}} + 3e{\rm{ O}}_2^0{\rm{ }} + {\rm{ }}4e \to {{\rm{O}}^{ - 2}}{\rm{ }}\\y \to {\rm{ 3y 0,075}} \to 0,3\end{array}\) Theo định luật bảo toàn electron: 2x + 3y = 0,2 + 0,3 24x + 27y = 5,55 => x = 0,175; y = 0,05 %Mg = 75,65%
Câu 14 :
Hỗn hợp X gồm Cl2 và O2 phản ứng vừa hết với 9,6 gam Mg và 16,2 gam Al tạo ra 74,1 gam hỗn hợp muối chloride và oxide. Thành phần % theo khối lượng của Cl2 trong X là
Đáp án : B Phương pháp giải :
Dựa vào định luật bảo toàn khối lượng và bảo toàn electron Lời giải chi tiết :
n Mg = 9,6 : 24 = 0,4 mol; n Al = 16,2 : 27 = 0,6 mol Gọi số mol Cl2 và O2 lần lượt là x và y mol Bảo toàn khối lượng: m X + m Mg + m Al = m hỗn hợp => m X = 74,1 – 9,6 – 16,2 = 48,3g
Câu 15 :
Cho 19,2g Cu phản ứng với 500ml dung dịch NaNO3 1M và 500ml HCl 2M thu được V lít NO (sản phẩm khử duy nhất ở đkc). Giá trị của V là
Đáp án : B Phương pháp giải :
Dựa vào phương pháp bảo toàn electron Lời giải chi tiết :
\(\begin{array}{l}3C{u^0} + 8{H^ + } + 2NO_3^ - \to 3C{u^{2 + }} + 2NO + 4{H_2}O\\0,3{\rm{ 1 0,5}}\end{array}\) Xét tỉ lệ mol: n Cu hết; n NO3- và H+ dư n NO = (0,3.2) : 3 = 0,1 mol => V NO = 0,2 . 24,79 = 4,958 lít đáp án B
Câu 16 :
Trộn 8,4 gam bột Fe và 3,2 gam bột S, đun nóng hỗn hợp (không có không khí) cho phản ứng xảy ra hoàn toàn. Sản phẩm thu được hòa tan hoàn toàn trong dung dịch H2SO4 đặc nóng thấy thoát ra V lít khí SO2 (ở đkc). Giá trị của V là
Đáp án : A Lời giải chi tiết :
n Fe = 8,4 : 56 = 0,15 mol; n S = 3,2 : 32 = 0,1 mol giả sử hỗn hợp Fe và S không phản ứng với nhau, cho hỗn hợp phản ứng trực tiếp với H2SO4 đặc nóng theo bảo toàn khối lượng ta thấy:
Câu 17 :
Tiến hành các thí nghiệm sau: a) Sục khí etilen vào dung dịch KMnO4 loãng. b) Cho hơi ancol etylic đi qua bột CuO nung nóng. c) Sục khí etilen vào dung dịch Br2 trong CCl4. d) Cho dung dịch glucozơ vào dung dịch AgNO3 trong NH3 dư, đun nóng. e) Cho Fe2O3 vào dung dịch H2SO4 đặc, nóng. Trong các thí nghiệm trên, số thí nghiệm có xảy ra phản ứng oxi hóa - khử là
Đáp án : B Phương pháp giải :
Phản ứng oxi hóa khử xảy ra khi có sự thay đổi số oxi hóa của 2 chất Lời giải chi tiết :
(a) đúng vì C và Mn thay đổi số oxi hóa (b) đúng vì C và Cu thay đổi số oxi hóa (c) đúng vì C và Br2 thay đổi số oxi hóa (d) đúng vì C và Ag thay đổi số oxi hóa (e) sai vì Fe không đổi số oxi hóa Đáp án D
Câu 18 :
Cho từng chất Fe, FeS, FeO, Fe2O3, Fe3O4, Fe(OH)2, Fe(OH)3, FeBr2, FeBr3, FeCl2, FeCl3 lần lượt tác dụng với dung dịch H2SO4 đặc, nóng. Số trường hợp xảy ra phản ứng oxi hóa-khử là:
Đáp án : D Phương pháp giải :
Fe chưa đạt số oxi hóa cao nhất + 3 đều thể hiện tính khử Lời giải chi tiết :
Fe, FeS, FeO, Fe3O4, Fe(OH)2, FeBr2, FeCl2 phản ứng oxi hóa với dung dịch H2SO4 đặc, nóng Đáp án D |














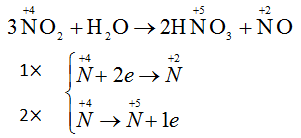
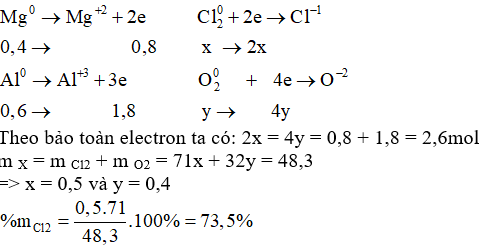
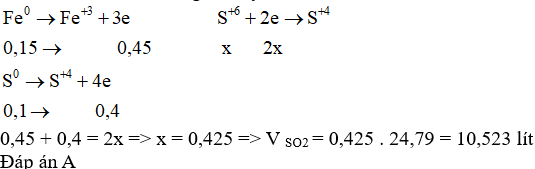





Danh sách bình luận