Trắc nghiệm Bài 11. Liên kết ion - Hóa 10 Kết nối tri thứcĐề bài
Câu 1 :
Liên kết hóa học trong NaCl được hình thành là do
Câu 2 :
Muối ăn ở thể rắn là:
Câu 3 :
Các ion và nguyên tử 9F-, 10Ne, 11Na+ giống nhau về
Câu 4 :
Cấu hình electron nguyên tử X và Y lần lượt là 1s22s22p63s23p64s1 và 1s22s22p5 Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết.
Câu 5 :
X thuộc chu kì 3, nhóm IA, Y thuộc chu kì 3, nhóm VIIA. Công thức phân tử và bản chất liên kết của hợp chất giữa X và Y là
Câu 6 :
Hợp chất trong phân tử có liên kết ion là
Câu 7 :
Khi phản ứng hoá học xảy ra giữa những nguyên tử có cấu hình electron ở trạng thái cơ bản là 1s22s1 và 1s22s22p5 thì liên kết này là
Câu 8 :
Liên kết ion là loại liên kết hóa học được hình thành nhờ lực hút tĩnh điện giữa các phần tử nào sau đây?
Câu 9 :
Tính chất nào sau đây là tính chất của hợp chất ion?
Câu 10 :
Dãy gồm các phân tử đều có liên kết ion là
Câu 11 :
Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H (2,20); Na (0,93). Hợp chất nào sau đây là hợp chất ion?
Câu 12 :
Phân tử KF có kiểu liên kết :
Câu 13 :
M thuộc nhóm IIA, X thuộc nhóm VIA. Trong oxit cao nhất M chiếm 71,43% khối lượng, còn X chiếm 40% khối lượng. Liên kết giữa X và M trong hợp chất thuộc loại liên kết nào sau đây ?
Câu 14 :
Các ion nào sau đây có cấu hình electron ở lớp ngoài cùng là 1s22s22p6?
Câu 15 :
Điều nào dưới đây đúng khi nói về ion S2-?
Câu 16 :
Điều nào dưới đây không đúng khi nói về hợp chất sodium oxide (Na2O)?
Câu 17 :
Tính chất nào dưới đây đúng khi nói về hợp chất ion?
Câu 18 :
Hợp chất A có các tính chất sau: Ở thể rắn trong điều kiện thường, dễ tan trong nước tạo dung dịch dẫn điện được. Hợp chất A là
Câu 19 :
Tính chất nào sau đây không phải của magnesium oxide (MgO)?
Câu 20 :
Cho các ion: Na+, Ca2+, F-, CO32-. Số lượng các hợp chất chứa hai loại ion có thể tạo thành từ các ion này là
Lời giải và đáp án
Câu 1 :
Liên kết hóa học trong NaCl được hình thành là do
Đáp án : D Lời giải chi tiết :
Liên kết trong phân tử NaCl là liên kết ion, do vậy sự hình thành NaCl phải là sự cho nhận e của cation (Na+) và anion (Cl-)
Câu 2 :
Muối ăn ở thể rắn là:
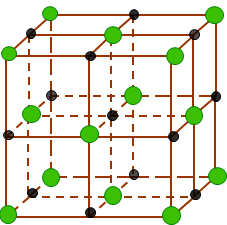
Đáp án : C Lời giải chi tiết :
Ở thể rắn, NaCl tồn tại dưới dạng tinh thể ion. Trong mạng tinh thể NaCl, các ion Na+ và Cl- được phân bố luân phiên đều đặn trên các đỉnh của các hình lập phương nhỏ.
Câu 3 :
Các ion và nguyên tử 9F-, 10Ne, 11Na+ giống nhau về
Đáp án : B Phương pháp giải :
Viết cấu hình e, xác định số p, số e, số n, số khối của từng ion và nguyên tử Lời giải chi tiết :
9F-: (Z = 9): 1s22s22p6 => Có 10e, 9p 10Ne: (Z = 10): 1s22s22p6 => Có 10e, 10p 11Na+ (Z = 11): 1s22s22p6 => Có 10e, 11p
Câu 4 :
Cấu hình electron nguyên tử X và Y lần lượt là 1s22s22p63s23p64s1 và 1s22s22p5 Liên kết hoá học giữa nguyên tử X và nguyên tử Y thuộc loại liên kết.
Đáp án : C Lời giải chi tiết :
X thuộc nhóm IA là kim loại điển hình Y thuộc nhóm VIIA là phi kim điển hình => liên kết giữa X và Y là liên kết ion
Câu 5 :
X thuộc chu kì 3, nhóm IA, Y thuộc chu kì 3, nhóm VIIA. Công thức phân tử và bản chất liên kết của hợp chất giữa X và Y là
Đáp án : B Lời giải chi tiết :
X thuộc nhóm IA là kim loại điển hình, điện tích 1+ Y thuộc nhóm VIIA là phi kim điển hình, điện tích 1- => CT là XY, liên kết giữa X và Y là liên kết ion
Câu 6 :
Hợp chất trong phân tử có liên kết ion là
Đáp án : A Lời giải chi tiết :
Liên kết ion là lực hút tĩnh điện giữa 2 ion mang điện tích trái dấu NH4Cl được tạo thành từ ion NH4+ và Cl-
Câu 7 :
Khi phản ứng hoá học xảy ra giữa những nguyên tử có cấu hình electron ở trạng thái cơ bản là 1s22s1 và 1s22s22p5 thì liên kết này là
Đáp án : C Lời giải chi tiết :
1s22s1 thuộc nhóm IA là kim loại điển hình 1s22s22p5 thuộc nhóm VIIA là phi kim điển hình => liên kết giữa 2 nguyên tố trên là liên kết ion
Câu 8 :
Liên kết ion là loại liên kết hóa học được hình thành nhờ lực hút tĩnh điện giữa các phần tử nào sau đây?
Đáp án : A Lời giải chi tiết :
Lực hút tĩnh điện giữa các ion mang điện tích trái dấu trong phân tử tạo ra liên kết => Lực hút tĩnh điện giữa cation và anion
Câu 9 :
Tính chất nào sau đây là tính chất của hợp chất ion?
Đáp án : B Lời giải chi tiết :
Trong tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, khó nóng chảy
Câu 10 :
Dãy gồm các phân tử đều có liên kết ion là
Đáp án : C Phương pháp giải :
Liên kết ion tạo bởi kim loại điển hình và phi kim điển hình Lời giải chi tiết :
A. Sai vì cả 4 chất đều là liên kết cộng hóa trị B. Sai vì HCl, H2S, N2O là liên kết cộng hóa trị C. Đúng D. Sai vì H2SO4, H3PO4, HCl là liên kết cộng hóa trị
Câu 11 :
Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H (2,20); Na (0,93). Hợp chất nào sau đây là hợp chất ion?
Đáp án : A Phương pháp giải :
Dựa vào độ âm điện của các nguyên tố Lời giải chi tiết :
NaF có hiệu độ âm điện 3,05 > 1,7 => hợp chất ion
Câu 12 :
Phân tử KF có kiểu liên kết :
Đáp án : C Phương pháp giải :
Dựa vào độ âm điện của K và F Lời giải chi tiết :
KF có hiệu độ âm điện > 1,7 => liên kết ion
Câu 13 :
M thuộc nhóm IIA, X thuộc nhóm VIA. Trong oxit cao nhất M chiếm 71,43% khối lượng, còn X chiếm 40% khối lượng. Liên kết giữa X và M trong hợp chất thuộc loại liên kết nào sau đây ?
Đáp án : A Lời giải chi tiết :
Gọi công thức oxide của M là MO %M = \(\frac{M}{{M + 16}}.100\% = 71,43\% \to M = 40(Ca)\) Gọi công thức oxide của X là XO3 %X = \(\frac{X}{{X + 3.16}}.100\% = 40\% \to X = 32(S)\) Liên kết giữa CaS là liên kết ion
Câu 14 :
Các ion nào sau đây có cấu hình electron ở lớp ngoài cùng là 1s22s22p6?
Đáp án : B Lời giải chi tiết :
Các nguyên tố gần với nguyên tố khí hiếm (Z=10) Na+, O2−, Mg2+, N3−
Câu 15 :
Điều nào dưới đây đúng khi nói về ion S2-?
Đáp án : B Phương pháp giải :
- Bước 1: Viết cấu hình electron của S - Bước 2: Viết cấu hình electron của S2- - Bước 3: Xác định số proton và electron trong ion S2- Lời giải chi tiết :
- Nguyên tố S ở ô số 16 trong bảng tuần hoàn => Cấu hình electron của nguyên tử S là 1s22s22p63s23p4 => Cấu hình electron của nguyên tử S2- là 1s22s22p63s23p6 - Trong ion S2- có: 16 proton và 16 + 2 = 18 electron => Đáp án: B - Sửa lỗi: + Đáp án A sai ở “18 proton” sửa thành “16 proton” + Đáp án C sai ở “trung hòa về điện” sửa thành “ion S2- mang điện tích âm” + Đáp án D sai ở “nhận vào 2 proton” sửa thành “nhận vào 2 electron”
Câu 16 :
Điều nào dưới đây không đúng khi nói về hợp chất sodium oxide (Na2O)?
Đáp án : D Phương pháp giải :
Dựa vào đặc điểm của hợp chất ion: Trong điều kiện thường, các hợp chất ion thường tồn tại ở trạng thái rắn, khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn. Hợp chất ion thường dễ tan trong nước, tạo thành dung dịch có khả năng dẫn điện. Lời giải chi tiết :
- Đáp án D, sửa thành “Tan trong nước, không tan trong dung môi không phân cực như benzene, carbon tetrachloride,…” vì Na2O là một chất phân cực thì sẽ tan trong các dung môi phân cực
Câu 17 :
Tính chất nào dưới đây đúng khi nói về hợp chất ion?
Đáp án : C Phương pháp giải :
Dựa vào đặc điểm của hợp chất ion: Trong điều kiện thường, các hợp chất ion thường tồn tại ở trạng thái rắn, khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn. Hợp chất ion thường dễ tan trong nước, tạo thành dung dịch có khả năng dẫn điện. Lời giải chi tiết :
- Đáp án: C - Sửa lại: + Đáp án A, sai ở “nhiệt độ nóng chảy thấp” sửa thành “nhiệt độ nóng chảy cao” + Đáp án B, sai ở “dung môi không phân cực” sửa thành “dung môi phân cực” + Đáp án D, sai ở “dẫn điện ở trạng thái rắn” sửa thành “không dẫn điện ở trạng thái rắn”
Câu 18 :
Hợp chất A có các tính chất sau: Ở thể rắn trong điều kiện thường, dễ tan trong nước tạo dung dịch dẫn điện được. Hợp chất A là
Đáp án : A Phương pháp giải :
Dựa vào đặc điểm của hợp chất ion: Trong điều kiện thường, các hợp chất ion thường tồn tại ở trạng thái rắn, khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn. Hợp chất ion thường dễ tan trong nước, tạo thành dung dịch có khả năng dẫn điện. Lời giải chi tiết :
- Hợp chất A phải là một hợp chất ion => Thường được tạo thành khi kim loại điển hình tác dụng với phi kim điển hình => Đáp án: A (NaCl)
Câu 19 :
Tính chất nào sau đây không phải của magnesium oxide (MgO)?
Đáp án : B Phương pháp giải :
Dựa vào đặc điểm của hợp chất ion: Trong điều kiện thường, các hợp chất ion thường tồn tại ở trạng thái rắn, khó nóng chảy, khó bay hơi và không dẫn điện ở trạng thái rắn. Hợp chất ion thường dễ tan trong nước, tạo thành dung dịch có khả năng dẫn điện. Lời giải chi tiết :
- Phân tử MgO tạo bởi lực hút tĩnh điện giữa ion Mg2+ và O2- " Đây là một hợp chất ion ð Đáp án: B, sửa thành “chất rắn ở điều kiện thường”
Câu 20 :
Cho các ion: Na+, Ca2+, F-, CO32-. Số lượng các hợp chất chứa hai loại ion có thể tạo thành từ các ion này là
Đáp án : C Phương pháp giải :
Dựa vào số lượng cation và số lượng anion, số lượng các hợp chất chứa 2 loại ion = số cation x số anion Lời giải chi tiết :
- Số lượng các hợp chất chứa 2 loại ion = 2x2 = 4 -> Đáp án: C
|



















Danh sách bình luận