Trắc nghiệm Bài 3. Cấu trúc lớp vỏ electron nguyên tử - Hóa 10 Kết nối tri thứcĐề bài
Câu 1 :
Số đơn vị điện tích hạt nhân của nguyên tử fluorine là 9. Trong nguyên tử fluorine, số electron ở phân mức năng lượng cao nhất là
Câu 2 :
Các electron của ngyên tử nguyên tố X được phân ố trên 3 lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân nguyên tử của nguyên tố X là
Câu 3 :
Nguyên tố có Z = 11 thuộc loại nguyên tố
Câu 4 :
Số electron tối đa có thể có ở phân lớp p là
Câu 5 :
Kí hiệu phân lớp nào sau đây không đúng?
Câu 6 :
Phát biểu nào sau đây là đúng?
Câu 7 :
Cho các cấu hình electron sau: (1) 1s22s1. (2) 1s22s22p4. (3) 1s22s22p63s23p63d104s24p5 (4) 1s22s22p63s23p1 (5) 1s22s22p63s23p63d54s1 (6) 1s22s22p63s23p2 (7) 1s2. (8) 1s22s22p63s23p5. (9) 1s22s22p3. Số cấu hình electron của nguyên tố phi kim là
Câu 8 :
Cho các phát biểu sau (1) Phân lớp d có tối đa 10 e (2) Phân lớp đã điền số electron tối đa được gọi là phân lớp electron bão hòa. (3) Nguyên tử nguyên tố kim loại thường có 1 hoặc 2 hoặc 3 electron ở lớp ngoài cùng. (4) Nguyên tử nguyên tố khí hiếm thường có 5 hoặc 6 hoặc 7 electron ở lớp ngoài cùng. (5) Các electron trên cùng một lớp có mức năng lượng bằng nhau. (6) Ở trạng thái cơ bản, nguyên tử trung hòa điện. Số phát biểu đúng là
Câu 9 :
Các electron được điền theo thứ tự nào sau đây?
Câu 10 :
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
Câu 11 :
Cấu hình electron của ion nào dưới đây giống khí hiếm?
Câu 12 :
Nguyên tử M có cấu hình electron 1s22s22p4. Cấu hình electron theo ô orbital là
Câu 13 :
Cấu hình electron của nguyên tử X được biểu diễn bằng ô orbital. Thông tin nào dưới đây không đúng khi nói về cấu hình của nguyên tử X ?
Câu 14 :
Nguyên tử của nguyên tố X có Z = 28, cấu hình electron của ion X2+ là
Câu 15 :
Nguyên tử của nguyên tố X có sự sắp xếp electron trên các orbital của nguyên tử như hình dưới đây. X là nguyên tố nào?
Câu 16 :
Cho các cấu hình sau của N (Z = 7). Hình vẽ nào sau đây đúng với quy tắc Hund?
Câu 17 :
Cation X2+ và Y2- lần lượt có cấu hình electron ở phân lớp ngoài cùng là 3d6 và 2p6. Hợp chất được tạo ra giữa X và Y có công thức:
Câu 18 :
Cho các phát biểu sau: (1) Các electron ở lớp L có mức năng lượng gần bằng nhau (2) Các electron ở lớp M (n = 3) liên kết chặt chẽ với hạt nhân hơn các electron ở lớp K (n = 1) (3) Các electron ở lớp L có mức năng lượng cao hơn các electron ở lớp K. (4) Các electron ở lớp K có mức năng lượng bằng nhau. (5) Các electron ở phân lớp 3s có mức năng lượng thấp hơn các electron ở phân lớp 2p Số phát biểu đúng là
Câu 19 :
Cấu hình e nào sau đây là của nguyên tử Fe ?
Câu 20 :
Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p64s1. Số hiệu nguyên tử của X là
Lời giải và đáp án
Câu 1 :
Số đơn vị điện tích hạt nhân của nguyên tử fluorine là 9. Trong nguyên tử fluorine, số electron ở phân mức năng lượng cao nhất là
Đáp án : B Phương pháp giải :
Thứ tự theo chiều tăng dần của các mức năng lượng: 1s 2s 2p 3s 3p 4s 3d.... Lời giải chi tiết :
Nguyên tử F có điện tích hạt nhân Z = 9 => Số electron của F là 9 Cấu hình electron: 1s22s22p5 Vậy số electron ở phân mức năng lượng cao nhất 2p là 5e.
Câu 2 :
Các electron của ngyên tử nguyên tố X được phân ố trên 3 lớp, lớp thứ ba có 6 electron. Số đơn vị điện tích hạt nhân nguyên tử của nguyên tố X là
Đáp án : D Phương pháp giải :
+ Viết cấu hình electron của nguyên tử nguyên tố X. + Z = số e Lời giải chi tiết :
Cấu hình e của nguyên tử nguyên tố X là: 1s2 2s2 2p6 3s2 3p4 Số đơn vị điện tích hạt nhân = số e = 2+2+6+2+4 = 16
Câu 3 :
Nguyên tố có Z = 11 thuộc loại nguyên tố
Đáp án : A Phương pháp giải :
Nguyên tố s là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s. Tương tự với các nguyên tố p, d, f. Lời giải chi tiết :
Cấu hình electron: 1s22s22p63s1 Nhận thấy e cuối cùng được điền vào phân lớp s nên X thuộc nguyên tố s.
Câu 4 :
Số electron tối đa có thể có ở phân lớp p là
Đáp án : B Lời giải chi tiết :
Phân lớp p chứa tối đa 6 electron
Câu 5 :
Kí hiệu phân lớp nào sau đây không đúng?
Đáp án : D Phương pháp giải :
- Lớp thứ nhất có 1 phân lớp, đó là phân lớp 1s - Lớp thứ 2 có 2 phân lớp, đó là 2s và 2p - Lớp thứ 3 có 3 phân lớp, đó là 3s, 3p và 3d
Lời giải chi tiết :
Lớp thứ 2 chỉ có 2 phân lớp là 2s và 2p, không có phân lớp 2d
Câu 6 :
Phát biểu nào sau đây là đúng?
Đáp án : C Lời giải chi tiết :
A. Sai vì trong nguyên tử, số electron = số proton B. Sai vì các electron trong cùng 1 lớp nhưng khác phân lớp thì năng lượng không bằng nhau C. Đúng D. Sai vì các electron trong cùng phân lớp có năng lượng bằng nhau
Câu 7 :
Cho các cấu hình electron sau: (1) 1s22s1. (2) 1s22s22p4. (3) 1s22s22p63s23p63d104s24p5 (4) 1s22s22p63s23p1 (5) 1s22s22p63s23p63d54s1 (6) 1s22s22p63s23p2 (7) 1s2. (8) 1s22s22p63s23p5. (9) 1s22s22p3. Số cấu hình electron của nguyên tố phi kim là
Đáp án : B Phương pháp giải :
- Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng là các nguyên tố kim loại (trừ H, He và B) - Các nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng thường là phi kim - Các nguyên tử có 4 electron ở lớp ngoài cùng có thể là phi kim hoặc kim loại Lời giải chi tiết :
(1) Có 1 electron lớp ngoài cùng => Kim loại (2) Có 6 electron lớp ngoài cùng => Phi kim (3) Có 7 electron lớp ngoài cùng => Phi kim (4) Có 3 electron lớp ngoài cùng => Kim loại (5) Có 1 electron lớp ngoài cùng => Kim loại (6) Có 4 electron lớp ngoài cùng, là phi kim (7) Có 2 electron lớp ngoài cùng nhưng là cấu hình của He => khí hiếm (8) Có 7 electron lớp ngoài cùng => Phi kim (9) Có 5 electron lớp ngoài cùng => Phi kim => Có 5 cấu hình electron của nguyên tố phi kim
Câu 8 :
Cho các phát biểu sau (1) Phân lớp d có tối đa 10 e (2) Phân lớp đã điền số electron tối đa được gọi là phân lớp electron bão hòa. (3) Nguyên tử nguyên tố kim loại thường có 1 hoặc 2 hoặc 3 electron ở lớp ngoài cùng. (4) Nguyên tử nguyên tố khí hiếm thường có 5 hoặc 6 hoặc 7 electron ở lớp ngoài cùng. (5) Các electron trên cùng một lớp có mức năng lượng bằng nhau. (6) Ở trạng thái cơ bản, nguyên tử trung hòa điện. Số phát biểu đúng là
Đáp án : C Lời giải chi tiết :
(1) Đúng (2) Đúng (3) Đúng (4) Sai, nguyên tố phi kim thường có 5, 6, 7 electron lớp ngoài cùng (5) Sai, các electron trên cùng 1 lớp nhưng khác phân lớp thì năng lượng không bằng nhau (6) Đúng => 4 đáp án đúng
Câu 9 :
Các electron được điền theo thứ tự nào sau đây?
Đáp án : B Lời giải chi tiết :
Thứ tự sắp xếp các electron theo mức năng lượng là 1s 2s 2p 3s 3p 4s 3d 4p 5s...
Câu 10 :
Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
Đáp án : B Phương pháp giải :
Các electron được điền vào phân lớp theo thứ tự 1s 2s 2p 3s 3p 4s 3d 4p 5s... Lời giải chi tiết :
- Nguyên tử Y có electron ở mức năng lượng 3p và có 1 electron ở lớp ngoài cùng => 1s22s22p63s23p64s1 => Nguyên tử Y có 1 electron ở lớp ngoài cùng => Y là kim loại - Nguyên tử X có electron ở mức năng lượng cao nhất là 3p và hơn kém nguyên tử Y 2 elctron => 1s22s22p63s23p5 => Nguyên tử X có 7 electron ở lớp ngoài cùng => X là phi kim
Câu 11 :
Cấu hình electron của ion nào dưới đây giống khí hiếm?
Đáp án : C Phương pháp giải :
Các nguyên tử nguyên tố có xu hướng nhường hoặc nhận electron để giống cấu hình của khí hiếm Lời giải chi tiết :
19K+ có cấu hình giống với khí hiếm Ar (Z=18) Đáp án C
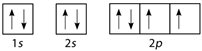
Câu 12 :
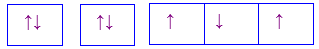
Nguyên tử M có cấu hình electron 1s22s22p4. Cấu hình electron theo ô orbital là
Đáp án : A Phương pháp giải :
Mỗi AO chứa tối đa 2 electron được kí hiệu 2 dấu mũi tên ngược nhau. Điền AO dựa trên nguyên lí Pauli Lời giải chi tiết :
Nguyên tử M có cấu hình electron 1s22s22p4 tương ứng với các orbital là:
Đáp án A
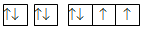
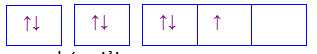
Câu 13 :
Cấu hình electron của nguyên tử X được biểu diễn bằng ô orbital. Thông tin nào dưới đây không đúng khi nói về cấu hình của nguyên tử X ?
Đáp án : B Phương pháp giải :
Dựa vào cấu hình của nguyên tử X Lời giải chi tiết :
Nguyên tử X có 2 lớp electron; lớp ngoài cùng có 5 electron Đáp án B
Câu 14 :
Nguyên tử của nguyên tố X có Z = 28, cấu hình electron của ion X2+ là
Đáp án : A Phương pháp giải :
Ion X2+ đã nhường đi 2 electron Lời giải chi tiết :
Cấu hình của nguyên tố X: 1s22s22p63s23p63d10 => cấu hình ion X2+: 1s22s22p63s23p63d8 Đáp án A
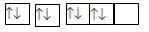
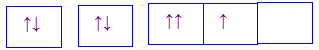
Câu 15 :
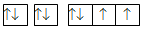
Nguyên tử của nguyên tố X có sự sắp xếp electron trên các orbital của nguyên tử như hình dưới đây. X là nguyên tố nào?
Đáp án : C Phương pháp giải :
Mỗi AO chứa tối đa 2 electron Lời giải chi tiết :
Nguyên tố X có 8 electron Đáp án C
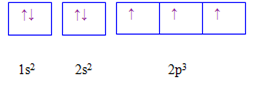
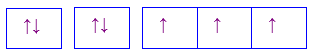
Câu 16 :
Cho các cấu hình sau của N (Z = 7). Hình vẽ nào sau đây đúng với quy tắc Hund?
Đáp án : C Phương pháp giải :
Dựa vào quy tắc Hund Lời giải chi tiết :
N có 7 electron vào có 3 electron phân lớp p, theo quy tắc Hund, các electron được điền đủ vào AO Đáp án C
Câu 17 :
Cation X2+ và Y2- lần lượt có cấu hình electron ở phân lớp ngoài cùng là 3d6 và 2p6. Hợp chất được tạo ra giữa X và Y có công thức:
Đáp án : D Lời giải chi tiết :
X2+: 1s2 2s2 2p6 3s2 3p6 3d6 X: 1s2 2s2 2p6 3s2 3p6 3d6 4s2 X là Fe Y2-: 1s2 2s2 2p6 Y: 1s2 2s2 2p4 Y là O Vậy XY là FeO Chọn D
Câu 18 :
Cho các phát biểu sau: (1) Các electron ở lớp L có mức năng lượng gần bằng nhau (2) Các electron ở lớp M (n = 3) liên kết chặt chẽ với hạt nhân hơn các electron ở lớp K (n = 1) (3) Các electron ở lớp L có mức năng lượng cao hơn các electron ở lớp K. (4) Các electron ở lớp K có mức năng lượng bằng nhau. (5) Các electron ở phân lớp 3s có mức năng lượng thấp hơn các electron ở phân lớp 2p Số phát biểu đúng là
Đáp án : B Phương pháp giải :
Dựa vào kiến thức về cấu hình electron Lời giải chi tiết :
(1), (3), (4) đúng Đáp án B
Câu 19 :
Cấu hình e nào sau đây là của nguyên tử Fe ?
Đáp án : A Phương pháp giải :
Fe có Z = 26 Lời giải chi tiết :
Cấu hình nguyên tử Fe: [Ar]3d64s2 Đáp án A
Câu 20 :
Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p64s1. Số hiệu nguyên tử của X là
Đáp án : B Phương pháp giải :
Dựa vào cấu hình electron của X Lời giải chi tiết :
Cấu hình của nguyên tố X: 1s22s22p63s23p64s1 => X có 19 electron Đáp án B
|





















Danh sách bình luận