Lý thuyết bài 3: Nguyên tố hóa họcNguyên tố hóa học, đồng vị, kí hiệu hóa học Quảng cáo
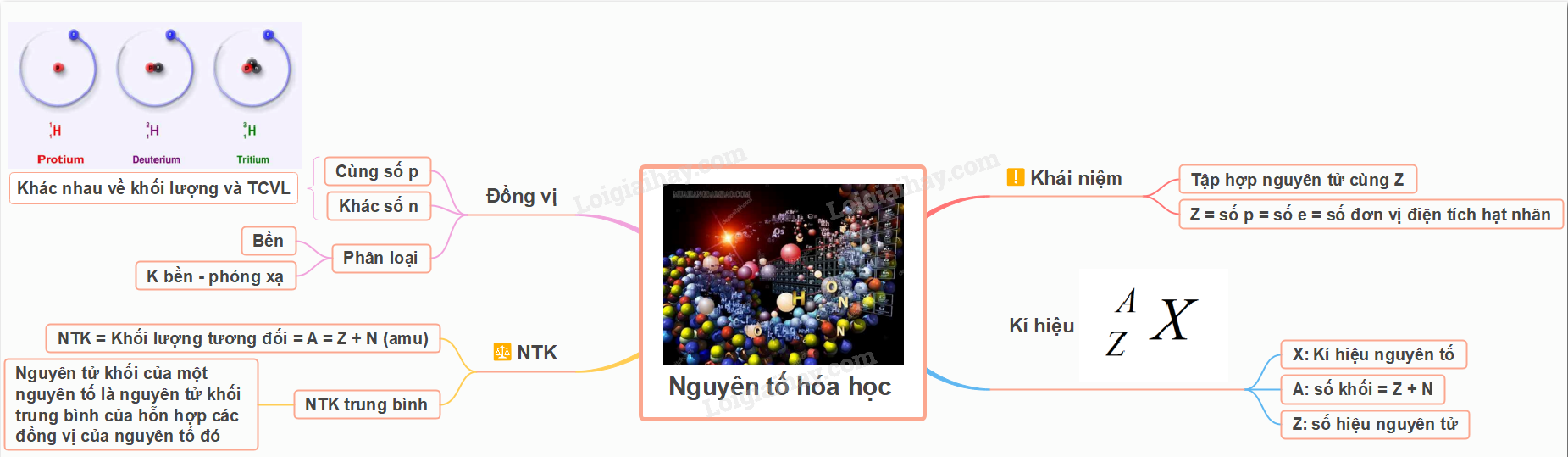
Lý thuyết: Nguyên tố hóa học I. Hạt nhân nguyên tử - Số đơn vị điện tích hạt nhân (Z) = số proton (P) = số electron (E) - Điện tích hạt nhân = +Z - Số khối (A) = số proton (P) + số neutron (N) II. Nguyên tố hóa học - Nguyên tố hóa học là tập hợp những nguyên tử có cùng điện tích hạt nhân. - Số hiệu nguyên tử = số đơn vị điện tích hạt nhân và đều kí hiệu là Z - Số hiệu nguyên tử cho biết: + Số proton trong hạt nhân + Số electron trong nguyên tử - Mỗi nguyên tố hóa học có một số hiệu nguyên tử - Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố hóa học (còn được gọi là số hiệu nguyên tử (Z)) của nguyên tố đó và số khối (A) là những đặc trưng cơ bản của 1 nguyên tử 
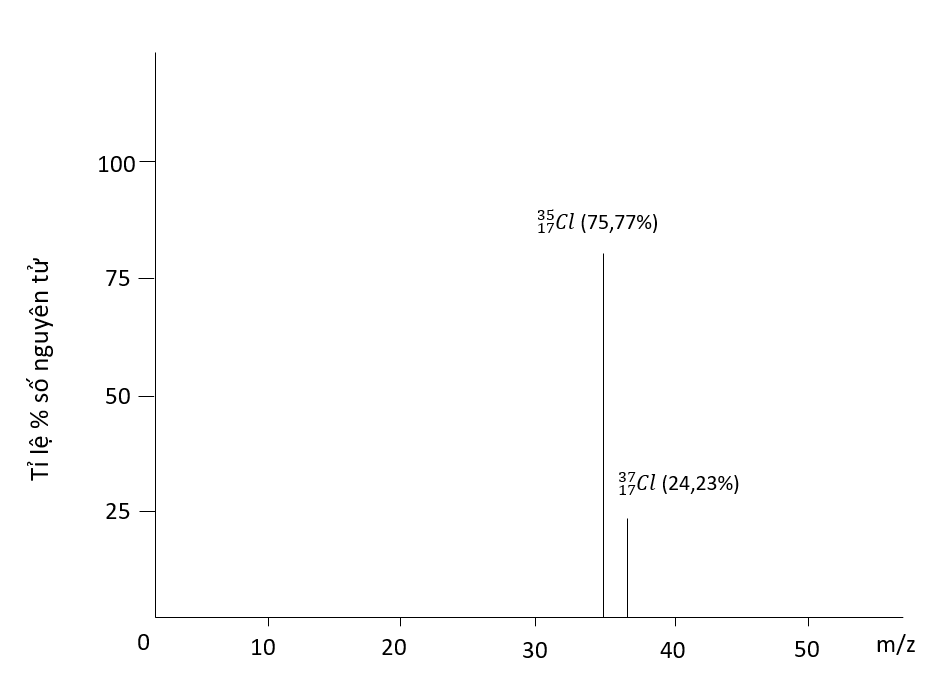
Ví dụ: Kí hiệu \({}_{11}^{23}Na\) cho biết: - Nguyên tử sodium có kí hiệu là Na - Số hiệu nguyên tử sodium = 11 nên hạt nhân sodium có 11 proton, vỏ nguyên tử có 11 electron - Số khối của nguyên tử Na là 23 nên trong hạt nhân có số neutron là 23 – 11 = 12 III. Đồng vị - Một số nguyên tử có cùng số proton nhưng có số neutron khác nhau, những nguyên tử như vậy được gọi là đồng vị 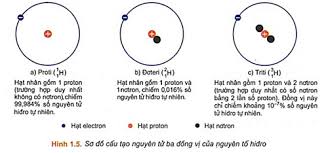 - Các đồng vị khác nhau về số neutron nên cũng khác nhau về khối lượng của hạt nhân nguyên tử, đồng thời cũng khác nhau về một số tính chất vật lí Ví dụ: ở dạng đơn chất, đồng vị \({}_{17}^{37}Cl\) có tỉ khối lớn hơn, nhiệt độ nóng chảy và nhiệt độ sôi cao hơn đồng vị \({}_{17}^{35}Cl\) - Ngoài các đồng vị bền, các nguyên tố hóa học còn có đồng vị không bền được gọi là đồng vị phóng xạ. Nhiều đồng vị phóng xạ được sử dụng trong y học, nông nghiệp, công nghiệp, nghiên cứu khoa học,… IV. Nguyên tử khối và nguyên tử khối trung bình 1. Nguyên tử khối - Nguyên tử khối là khối lượng tương đối của nguyên tử - Do khối lượng của proton và neutron đều xấp xỉ 1,0 amu, còn khối lượng electron nhỏ hơn rất nhiều (0,00055 amu) nên có thể coi nguyên tử khối xấp xỉ số khối hạt nhân Ví dụ: Nguyên tử của nguyên tố potassium (K) có Z = 19; số neutron = 20 nên nguyên tử khối của K là 19 + 20 = 39 2. Nguyên tử khối trung bình - Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình (kí hiệu là \(\overline A \)) của hỗn hợp các đồng vị của nguyên tố đó Ví dụ: Bằng phương pháp phổ khối lượng, người ta xác định được trong tự nhiên, nguyên tố chlorine có 2 đồng bị bền là \({}_{17}^{35}Cl\) (chiếm 75,77%) và \({}_{17}^{37}Cl\) (chiếm 24,23% số nguyên tử)
Phố khối lượng của chlorine Nguyên tử khối trung bình của chlorine:
|














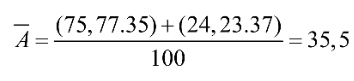






Danh sách bình luận