Đề thi học kì 2 Hóa 10 Kết nối tri thức - Đề số 7Dùng không khí nén thổi vào lò cao để đốt cháyĐề bài
I. Trắc nghiệm
Câu 1 :
Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố nào đã được sử dụng để làm tăng tốc độ phản ứng ?
Câu 2 :
Hằng số tốc độ phản ứng k phụ thuộc yếu tố nào sau đây:
Câu 3 :
Tốc độ phản ứng phụ thuộc vào các yếu tố sau: (1). Nhiệt độ. (2). Nồng độ. (3). Áp suất. (4). Diện tích bề mặt.
Câu 4 :
Khi diện tích bề mặt tăng, tốc độ phản ứng tăng là đúng với phản ứng có chất nào tham gia?
Câu 5 :
Hai nhóm học sinh làm thí nghiệm. nghiên cứu tốc độ phản ứng kẽm tan trong dung dịch hydrochloric acid. Nhóm thứ nhất. Cân miếng kẽm 1g và thả vào cốc đựng 200ml dung dịch acid HCl 2M.
Câu 6 :
Cho hiện tượng sau: Tàn đóm đỏ bùng lên khi cho vào bình oxygen nguyên chất.Hiện tượng trên thể hiện ảnh hưởng của yếu tố nào đến tốc độ phản ứng?
Câu 7 :
Phản ứng nào trong các phản ứng dưới đây là phản ứng thu nhiệt?
Câu 8 :
Trong bảng tuần hoàn, nguyên tố halogen là các nguyên tố nhóm nào?
Câu 9 :
Nguyên tố nào sau đây không phải là nguyên tố halogen?
Câu 10 :
Ở điều kiện thường, đơn chất halogen nào sau đây tồn tại ở thể lỏng?
Câu 11 :
Đi từ fluorine đến iodine, bán kính nguyên tử của các nguyên tố như thế nào?
Câu 12 :
Ở điều kiện thường, đơn chất halogen tồn tại ở dạng gì?
Câu 13 :
Phương trình hóa học nào dưới đây là không chính xác?
Câu 14 :
Trong công nghiệp, người ta sử dụng phản ứng giữa chlorine với dung dịch nào sau đây để tạo ra nước Javel có tính oxi hóa mạnh phục vụ cho mục đích sát khuẩn, vệ sinh gia dụng?
Câu 15 :
Cho các phương trình hóa học sau: (1) 2Ag + F2 \( \to \) 2AgF. (2) 2Fe + 3Cl2 \( \to \) 2FeCl3. (3) 2Al + 3I2 \( \to \) 2AlI3. (4) Cl2 + 2NaOH \( \to \) NaCl + NaClO + H2O. Các halogen phản ứng với kim loại được thể hiện qua những phương trình nào?
Câu 16 :
Dãy tăng dần tính phi kim của các nguyên tố trong nhóm VIIA ?
Câu 17 :
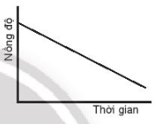
Nếu mỗi đồ thị có các chất phản ứng cùng nồng độ và trục thời gian thì tốc độ của chất phản ứng nào xảy ra nhanh nhất?
Câu 18 :
Cho phản ứng: A + B ⇄ C. Nồng độ ban đầu của chất A là 0,1 mol/l, của chất B là 0,8 mol/l. Sau 10 phút, nồng độ của B giảm 20% so với nồng độ ban đầu. Tốc độ trung bình của phản ứng?
II. Câu hỏi đúng sai
Câu 1 :
Nghiên cứu ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng: CaCO3 + 2HCl → CaCl2 + CO2 + H2O Chuẩn bị: 2 bình tam giác, dung dịch HCl 0,5 M, đá vôi dạng viên, đá vôi đập nhỏ. Tiến hành: - Cho cùng một lượng (khoảng 2 g) đá vôi dạng viên vào bình tam giác (1) và đá vôi đập nhỏ vào bình tam giác (2). - Rót 20 mL dung dịch HCl 0,5 M vào mỗi bình. Quan sát hiện tượng và trả lời câu hỏi: a) Phản ứng trong bình 1 có tốc độ thoát khí nhanh hơn.
Đúng
Sai
b) Đá vôi dạng đập nhỏ có tổng diện tích bề mặt lớn hơn.
Đúng
Sai
c) Diện tích bề mặt tiếp xúc càng lớn thì tốc độ phản ứng càng chậm.
Đúng
Sai
d) Phản ứng trên thuộc loại phản ứng oxi hóa – khử
Đúng
Sai
Câu 2 :
Những câu sau đây là đúng hay sai: a) Điều kiện chuẩn là điều kiện ứng với 1 bar ( đối với chất lỏng).
Đúng
Sai
b) Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất kém bền
Đúng
Sai
c) Vào những ngày trời lạnh, nhiều người hay ngồi bên bếp củi lửa để sưởi. Khi than, củi cháy, không khí xung quanh lạnh hơn do phản ứng thu nhiệt.
Đúng
Sai
d) Điều kiện để xảy ra phản ứng tỏa nhiệt (t= 25oC) là rHo298K
Đúng
Sai
Câu 3 :
Cho các nhận định sau: a) Trong phản ứng: 3CH3CH2OH + K2Cr2O7 + 4H2SO4 \( \to \) 3CH3CHO + Cr2(SO4)3 + K2SO4 + 7H2O Chất đóng vai trò chất oxi hóa là K2Cr2O7
Đúng
Sai
b) Trong phản ứng quang hợp:
CO2 đóng vai trò là chất khử
Đúng
Sai
c) Trong phản ứng oxi hóa - khử chỉ xảy ra quá trình oxi hóa
Đúng
Sai
d) Quá trình khử là quá trình nhận electron
Đúng
Sai
Câu 4 :
Trong công nghiệp, dung dịch sodium chlorine được đem điện phân để có phản ứng theo phương trình hóa học sau: NaCl (aq) + H2O (l) \( \to \) A (aq) + X (g) + Y (g) (*) 2NaOH (aq) + H2 (g) + Cl2 (g) a) Từ phản ứng giữa Y với dung dịch A sẽ sản xuất được hỗn hợp tẩy rửa phổ biến là nước Javel
Đúng
Sai
b) Từ phản ứng kết hợp giữa X và Y sẽ sản xuất được hydrogen chloride.
Đúng
Sai
c) Công thức hóa học của A, X, Y lần lượt là Na(OH)2, Cl2 ,H2
Đúng
Sai
d) Phương trình hóa học (*): 2NaCl (aq) + 2H2O (l) → 2NaOH (aq) + H2 (g) + Cl2 (g)
Đúng
Sai
III. Tự luận
Lời giải và đáp án
I. Trắc nghiệm
Câu 1 :
Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố nào đã được sử dụng để làm tăng tốc độ phản ứng ?
Đáp án : D Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng Lời giải chi tiết :
Dùng không khí nén thổi vào lò cao để đốt cháy than cốc để tăng nồng độ O2. Đáp án D
Câu 2 :
Hằng số tốc độ phản ứng k phụ thuộc yếu tố nào sau đây:
Đáp án : A Phương pháp giải :
Dựa vào biểu thức tính tốc độ phản ứng Lời giải chi tiết :
Hằng số tốc độ phản ứng k phụ thuộc vào bản chất phản ứng và nhiệt độ
Câu 3 :
Tốc độ phản ứng phụ thuộc vào các yếu tố sau: (1). Nhiệt độ. (2). Nồng độ. (3). Áp suất. (4). Diện tích bề mặt.
Đáp án : D Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng Lời giải chi tiết :
Tốc độ phản ứng phụ thuộc vào: nhiệt độ, nồng độ, áp suất, diện tích bề mặt
Câu 4 :
Khi diện tích bề mặt tăng, tốc độ phản ứng tăng là đúng với phản ứng có chất nào tham gia?
Đáp án : B Phương pháp giải :
Dựa vào kiến thức về các yếu tố ảnh hưởng đến tốc độ phản ứng Lời giải chi tiết :
Khi diện tích bề mặt tăng, tốc độ phản ứng tăng là đúng với phản ứng có chất rắn tham gia
Câu 5 :
Hai nhóm học sinh làm thí nghiệm. nghiên cứu tốc độ phản ứng kẽm tan trong dung dịch hydrochloric acid. Nhóm thứ nhất. Cân miếng kẽm 1g và thả vào cốc đựng 200ml dung dịch acid HCl 2M.
Đáp án : B Phương pháp giải :
Dựa vào kiến thức về yếu tố ảnh hưởng đến tốc độ phản ứng Lời giải chi tiết :
Nhóm 2 có bọt khí thoát ra nhanh hơn vì diện tích bề mặt tiếp xúc của kẽm lớn hơn ở dạng bột và nồng độ acid lớn hơn
Câu 6 :
Cho hiện tượng sau: Tàn đóm đỏ bùng lên khi cho vào bình oxygen nguyên chất.Hiện tượng trên thể hiện ảnh hưởng của yếu tố nào đến tốc độ phản ứng?
Đáp án : A Phương pháp giải :
Dựa vào yếu tố ảnh hưởng đến tốc độ phản ứng Lời giải chi tiết :
Tàn đóm đỏ bùng lên khi cho vào bình oxygen nguyên chất. Hiện tượng trên do yếu tố nồng độ làm tăng đến tốc độ phản ứng
Câu 7 :
Phản ứng nào trong các phản ứng dưới đây là phản ứng thu nhiệt?
Đáp án : A Phương pháp giải :
Phản ứng thu nhiệt: phản ứng nung, phản ứng quang hợp Lời giải chi tiết :
Phản ứng nung đá vôi là phản ứng thu nhiệt Đáp án A
Câu 8 :
Trong bảng tuần hoàn, nguyên tố halogen là các nguyên tố nhóm nào?
Đáp án : D Phương pháp giải :
Dựa vào bảng tuần hoàn hóa học Lời giải chi tiết :
Trong bảng tuần hoàn, nguyên tố halogen là các nguyên tố nhóm VIIA.
Câu 9 :
Nguyên tố nào sau đây không phải là nguyên tố halogen?
Đáp án : C Phương pháp giải :
Dựa vào bảng tuần hoàn hóa học Lời giải chi tiết :
Nguyên tố halogen bao gồm: F, Cl, Br, I
Câu 10 :
Ở điều kiện thường, đơn chất halogen nào sau đây tồn tại ở thể lỏng?
Đáp án : C Phương pháp giải :
Dựa vào tính chất vật lí của đơn chất halogen Lời giải chi tiết :
ở điều kiện thường, đơn chất Br2 tồn tại ở thể lỏng Đáp án C
Câu 11 :
Đi từ fluorine đến iodine, bán kính nguyên tử của các nguyên tố như thế nào?
Đáp án : A Phương pháp giải :
Dựa vào tính chất vật lí của đơn chất halogen Lời giải chi tiết :
Đi từ fluorine đến iodine, bán kính nguyên tử của các nguyên tố tăng dần. Đáp án A
Câu 12 :
Ở điều kiện thường, đơn chất halogen tồn tại ở dạng gì?
Đáp án : B Phương pháp giải :
Dựa vào tính chất vật lí của đơn chất halogen Lời giải chi tiết :
Ở điều kiện thường, đơn chất halogen tồn tại dạng phân tử hai nguyên tử
Câu 13 :
Phương trình hóa học nào dưới đây là không chính xác?
Đáp án : D Phương pháp giải :
Dựa vào tính chất hóa học của đơn chất halogen Lời giải chi tiết :
D sai vì I2 không tham gia phản ứng thế nguyên tử Cl-. Đáp án D
Câu 14 :
Trong công nghiệp, người ta sử dụng phản ứng giữa chlorine với dung dịch nào sau đây để tạo ra nước Javel có tính oxi hóa mạnh phục vụ cho mục đích sát khuẩn, vệ sinh gia dụng?
Đáp án : B Phương pháp giải :
Dựa vào ứng dụng của chlorine Lời giải chi tiết :
Trong công nghiệp, người ta điều chế nước Javel bằng phản ứng giữa chlorine với dung dịch NaOH
Câu 15 :
Cho các phương trình hóa học sau: (1) 2Ag + F2 \( \to \) 2AgF. (2) 2Fe + 3Cl2 \( \to \) 2FeCl3. (3) 2Al + 3I2 \( \to \) 2AlI3. (4) Cl2 + 2NaOH \( \to \) NaCl + NaClO + H2O. Các halogen phản ứng với kim loại được thể hiện qua những phương trình nào?
Đáp án : A Phương pháp giải :
Dựa vào các phương trình hóa học Lời giải chi tiết :
(1), (2), (3) là phản ứng giữa halogen với kim loại
Câu 16 :
Dãy tăng dần tính phi kim của các nguyên tố trong nhóm VIIA ?
Đáp án : B Phương pháp giải :
Các nguyên tố trong cùng một nhóm, đi từ trên xuống tính kim loại tăng, tính phi kim giảm Lời giải chi tiết :
Dãy tăng dần tính phi kim: F, Cl, Br, I
Câu 17 :
Nếu mỗi đồ thị có các chất phản ứng cùng nồng độ và trục thời gian thì tốc độ của chất phản ứng nào xảy ra nhanh nhất?
Đáp án : A Phương pháp giải :
Dựa vào đồ thị các chất phản ứng Lời giải chi tiết :
Đồ thị A có tốc độ phản ứng xảy ra nhanh nhất vì độ dốc nhất
Câu 18 :
Cho phản ứng: A + B ⇄ C. Nồng độ ban đầu của chất A là 0,1 mol/l, của chất B là 0,8 mol/l. Sau 10 phút, nồng độ của B giảm 20% so với nồng độ ban đầu. Tốc độ trung bình của phản ứng?
Đáp án : B Phương pháp giải :
Dựa vào công thức tính tốc độ trung bình của phản ứng Lời giải chi tiết :
\(\nu = \frac{{0,8 - 0,8.80\% }}{{10}} = 0,016mol/l.phut\) Đáp án B
II. Câu hỏi đúng sai
Câu 1 :
Nghiên cứu ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng: CaCO3 + 2HCl → CaCl2 + CO2 + H2O Chuẩn bị: 2 bình tam giác, dung dịch HCl 0,5 M, đá vôi dạng viên, đá vôi đập nhỏ. Tiến hành: - Cho cùng một lượng (khoảng 2 g) đá vôi dạng viên vào bình tam giác (1) và đá vôi đập nhỏ vào bình tam giác (2). - Rót 20 mL dung dịch HCl 0,5 M vào mỗi bình. Quan sát hiện tượng và trả lời câu hỏi: a) Phản ứng trong bình 1 có tốc độ thoát khí nhanh hơn.
Đúng
Sai
b) Đá vôi dạng đập nhỏ có tổng diện tích bề mặt lớn hơn.
Đúng
Sai
c) Diện tích bề mặt tiếp xúc càng lớn thì tốc độ phản ứng càng chậm.
Đúng
Sai
d) Phản ứng trên thuộc loại phản ứng oxi hóa – khử
Đúng
Sai
Đáp án
a) Phản ứng trong bình 1 có tốc độ thoát khí nhanh hơn.
Đúng
Sai
b) Đá vôi dạng đập nhỏ có tổng diện tích bề mặt lớn hơn.
Đúng
Sai
c) Diện tích bề mặt tiếp xúc càng lớn thì tốc độ phản ứng càng chậm.
Đúng
Sai
d) Phản ứng trên thuộc loại phản ứng oxi hóa – khử
Đúng
Sai
Lời giải chi tiết :
(a) sai, vì diện tích tiếp xúc của đá vôi dạng viên ít hơn so với đập nhỏ
Câu 2 :
Những câu sau đây là đúng hay sai: a) Điều kiện chuẩn là điều kiện ứng với 1 bar ( đối với chất lỏng).
Đúng
Sai
b) Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất kém bền
Đúng
Sai
c) Vào những ngày trời lạnh, nhiều người hay ngồi bên bếp củi lửa để sưởi. Khi than, củi cháy, không khí xung quanh lạnh hơn do phản ứng thu nhiệt.
Đúng
Sai
d) Điều kiện để xảy ra phản ứng tỏa nhiệt (t= 25oC) là rHo298K
Đúng
Sai
Đáp án
a) Điều kiện chuẩn là điều kiện ứng với 1 bar ( đối với chất lỏng).
Đúng
Sai
b) Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất kém bền
Đúng
Sai
c) Vào những ngày trời lạnh, nhiều người hay ngồi bên bếp củi lửa để sưởi. Khi than, củi cháy, không khí xung quanh lạnh hơn do phản ứng thu nhiệt.
Đúng
Sai
d) Điều kiện để xảy ra phản ứng tỏa nhiệt (t= 25oC) là rHo298K
Đúng
Sai
Lời giải chi tiết :
(a) sai, điều kiện ứng với 1 bar (đối với chất lỏng) (b) sai, Enthalpy tạo thành của một chất là nhiệt kèm theo phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất (c) sai, xung quanh nóng hơn do phản ứng tỏa nhiệt (d) đúng
Câu 3 :
Cho các nhận định sau: a) Trong phản ứng: 3CH3CH2OH + K2Cr2O7 + 4H2SO4 \( \to \) 3CH3CHO + Cr2(SO4)3 + K2SO4 + 7H2O Chất đóng vai trò chất oxi hóa là K2Cr2O7
Đúng
Sai
b) Trong phản ứng quang hợp:
CO2 đóng vai trò là chất khử
Đúng
Sai
c) Trong phản ứng oxi hóa - khử chỉ xảy ra quá trình oxi hóa
Đúng
Sai
d) Quá trình khử là quá trình nhận electron
Đúng
Sai
Đáp án
a) Trong phản ứng: 3CH3CH2OH + K2Cr2O7 + 4H2SO4 \( \to \) 3CH3CHO + Cr2(SO4)3 + K2SO4 + 7H2O Chất đóng vai trò chất oxi hóa là K2Cr2O7
Đúng
Sai
b) Trong phản ứng quang hợp:
CO2 đóng vai trò là chất khử
Đúng
Sai
c) Trong phản ứng oxi hóa - khử chỉ xảy ra quá trình oxi hóa
Đúng
Sai
d) Quá trình khử là quá trình nhận electron
Đúng
Sai
Lời giải chi tiết :
a) đúng b) sai, CO2 đóng vai trò chất oxi hóa c) sai, xảy ra cả quá trình oxi hóa và khử d) đúng
Câu 4 :
Trong công nghiệp, dung dịch sodium chlorine được đem điện phân để có phản ứng theo phương trình hóa học sau: NaCl (aq) + H2O (l) \( \to \) A (aq) + X (g) + Y (g) (*) 2NaOH (aq) + H2 (g) + Cl2 (g) a) Từ phản ứng giữa Y với dung dịch A sẽ sản xuất được hỗn hợp tẩy rửa phổ biến là nước Javel
Đúng
Sai
b) Từ phản ứng kết hợp giữa X và Y sẽ sản xuất được hydrogen chloride.
Đúng
Sai
c) Công thức hóa học của A, X, Y lần lượt là Na(OH)2, Cl2 ,H2
Đúng
Sai
d) Phương trình hóa học (*): 2NaCl (aq) + 2H2O (l) → 2NaOH (aq) + H2 (g) + Cl2 (g)
Đúng
Sai
Đáp án
a) Từ phản ứng giữa Y với dung dịch A sẽ sản xuất được hỗn hợp tẩy rửa phổ biến là nước Javel
Đúng
Sai
b) Từ phản ứng kết hợp giữa X và Y sẽ sản xuất được hydrogen chloride.
Đúng
Sai
c) Công thức hóa học của A, X, Y lần lượt là Na(OH)2, Cl2 ,H2
Đúng
Sai
d) Phương trình hóa học (*): 2NaCl (aq) + 2H2O (l) → 2NaOH (aq) + H2 (g) + Cl2 (g)
Đúng
Sai
Lời giải chi tiết :
Từ phản ứng giữa Y với dung dịch A sẽ sản xuất được hỗn hợp tẩy rửa phổ biến là nước Javel: NaCl và NaClO. Hai chất tác dụng với nhau để tạo thành nước Javel là: NaOH và Cl2. - Vì A ở dạng dung dịch, Y ở dạng khí ⇒ A là dung dịch NaOH, Y là khí Cl2 - Để sản xuất được hydrogen chloride cần: Cl2 và H2 a) Đúng, vì A là NaOH và Y là Cl2 b) đúng, vì X là H2 c) sai, X là H2 d) đúng
III. Tự luận
Lời giải chi tiết :
Phương trình 2,3 \(6H\mathop {Cl}\limits^{ - 1} + 2Al \to 2AlC{l_3} + 3\mathop {{H_2}}\limits^o \) .\(2H\mathop {Cl}\limits^{ - 1} + Fe \to FeC{l_2} + {\mathop H\limits^o _2}\). Phương pháp giải :
Dựa vào ứng dụng của chlorine Lời giải chi tiết :
Chlorine có mùi xốc, nên khi sử dụng nước sinh hoạt có chlorine, chúng ta sẽ ngửi thấy mùi của chlorine. Lời giải chi tiết :
Ta có: n Cl2 = \(\frac{{24,85}}{{71}} = 0,35mol\) R + Cl2 \( \to \) RCl2 0,35 \( \leftarrow \) 0,35 \( \to {M_{\rm{R}}} = \frac{{8,4}}{{0,35}} \to \)R là Mg; m MgCl2 = 0,35.95 = 33,25g Lời giải chi tiết :
1 phương trình phản ứng chứng tỏ Cl- có tính khử: 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2+ 8H2O
|















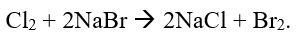
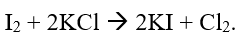















Danh sách bình luận