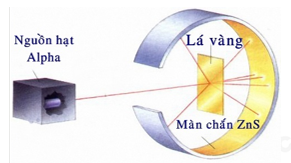
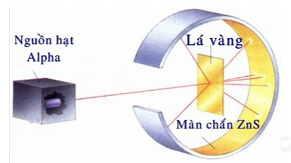
Đề thi giữa kì 1 Hóa 10 Kết nối tri thức - Đề số 8Tải về Hình ảnh dưới đây mô tả thí nghiệm chứng minh nguyên tử có cấu tạo rỗng. Hiện tượng nào chứng tỏ điều đó? Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Đề thi Câu 1: Hình ảnh dưới đây mô tả thí nghiệm chứng minh nguyên tử có cấu tạo rỗng. Hiện tượng nào chứng tỏ điều đó?
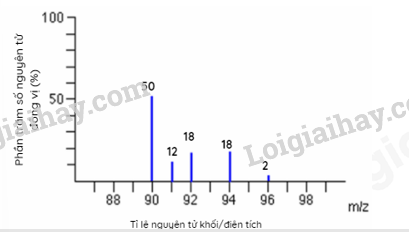
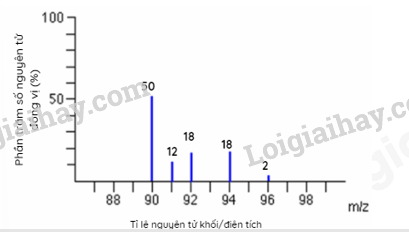
A. Chùm α truyền thẳng. B. Chùm α bị bật ngược trở lại. C. Chùm α bị lệch hướng. D. Chùm α không thể bị xuyên qua. Câu 2: Một nguyên tử X có 19e và 20n. Kí hiệu của nguyên tử X là: Câu 3: Nguyên tố Carbon có 2 đồng vị bền 12C (98,89%) và 13C (1,11%). Nguyên tử khối trung bình của Carbon là Câu 4: Có các nhận định sau: (1) Nguyên tố hóa học là tập hợp các nguyên tử có cùng số neutron. (2) Đồng vị của nguyên tố là những nguyên tử có cùng số proton nhưng khác số neutron. (3) Tất cả những nguyên tử có 1, 2 hoặc 3 electron lớp ngoài cùng đều là nguyên tố kim loại. (4) Lớp M có tối đa 18 electron. Số nhận định sai là: A. 4. B. 1. C. 2. D. 3. Câu 5: Cho phổ khối của nguyên tố A được biểu diễn tại hình 1.4.
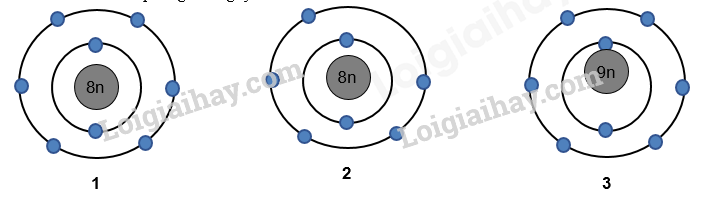
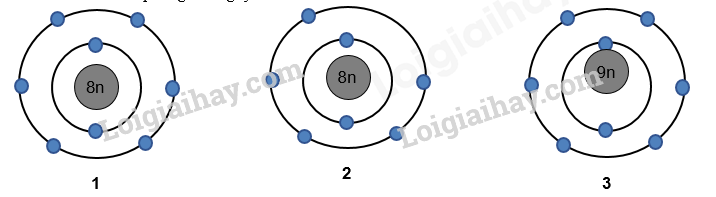
Hình 1.4. Phổ khối của nguyên tố A. Nguyên tử khối trung bình của nguyên tố A là A. 91,32. B. 91,40. C. 90,00. D. 94,23. Câu 6: Nguyên tố hoá học là những nguyên tử có cùng: Câu 7: Cho hình vẽ mô phỏng các nguyên tử với số liệu như sau: Nhận xét nào sau đây không đúng? A. 1 và 2 là các đồng vị của cùng một nguyên tố hóa học. B. 1 và 3 là các đồng vị của cùng một nguyên tố hóa học. C. 1 và 2 là nguyên tử của hai nguyên tố hóa học khác nhau. D. 1 và 3 có cùng số proton trong hạt nhân. Câu 8: Cho cấu hình electron của các nguyên tố sau: Câu 9: Nguyên tử của một nguyên tố có tổng số hạt là 114. Số hạt mang điện nhiều hơn số hạt không mang điện là 26. Kí hiệu nguyên tử của nguyên tố đó là: Câu 10: Nguyên tử của nguyên tố A và B đều có phân lớp ngoài cùng là 2p. Tổng số electron ở hai phân lớp ngoài cùng hai nguyên tử là 3. Số hiệu nguyên tử của A và B lần lượt là A. 1 và 2. B. 5 và 6. C. 7 và 8. D. 7 và 9. II. TỰ LUẬN Bài 1. (1,5 điểm) Biết rằng tổng số các loại hạt (p, n, e) trong nguyên tử R là 40, trong đó hạt không mang điện kém hơn số hạt mang điện là 12. Xác định tên của nguyên tố R và viết kí hiệu nguyên tử R (Biết ZNa=11, ZMg=12, ZAl=13, ZCa=20, ZK=19). Bài 2. (1 điểm) Trong tự nhiên, magnesium có 3 đồng vị bền là 24Mg, 25Mg và 26Mg. Phương pháp phổ khối lượng xác nhận đồng vị 26Mg chiếm tỉ lệ phần trăm số nguyên tử là 11%. Biết rằng nguyên tử khối trung bình của Mg là 24,32. Tính % số nguyên tử của đồng vị 24Mg, đồng vị 25Mg? Đáp án PHẦN I: TRẮC NGHIỆM
Câu 1: Hình ảnh dưới đây mô tả thí nghiệm chứng minh nguyên tử có cấu tạo rỗng. Hiện tượng nào chứng tỏ điều đó?
A. Chùm α truyền thẳng. B. Chùm α bị bật ngược trở lại. C. Chùm α bị lệch hướng. D. Chùm α không thể bị xuyên qua. Lời giải chi tiết Đáp án A Câu 2: Một nguyên tử X có 19e và 20n. Kí hiệu của nguyên tử X là: Phương pháp giải Dựa vào kí hiệu nguyên tố hóa học Lời giải chi tiết Số khối A = E + N = 19 + 20 = 39 Đáp án D Câu 3: Nguyên tố Carbon có 2 đồng vị bền 12C (98,89%) và 13C (1,11%). Nguyên tử khối trung bình của Carbon là Phương pháp giải Dựa vào công thức tính nguyên tử khối trung bình Lời giải chi tiết \({M_{\bar C}} = 98,89\% .12 + 1,11\% .13 = 12,011\) Đáp án D Câu 4: Có các nhận định sau: (1) Nguyên tố hóa học là tập hợp các nguyên tử có cùng số neutron. (2) Đồng vị của nguyên tố là những nguyên tử có cùng số proton nhưng khác số neutron. (3) Tất cả những nguyên tử có 1, 2 hoặc 3 electron lớp ngoài cùng đều là nguyên tố kim loại. (4) Lớp M có tối đa 18 electron. Số nhận định sai là: A. 4. B. 1. C. 2. D. 3. Phương pháp giải Dựa vào kiến thức về nguyên tố hóa học Lời giải chi tiết (1) sai vì tập hợp các nguyên tử có cùng số proton (3) sai vì nguyên tố kim loại có 1,2,3 hoặc 4 số electron ngoài cùng Câu 5: Cho phổ khối của nguyên tố A được biểu diễn tại hình 1.4.
Hình 1.4. Phổ khối của nguyên tố A. Nguyên tử khối trung bình của nguyên tố A là A. 91,32. B. 91,40. C. 90,00. D. 94,23. \({M_{\bar A}} = \frac{{50.90 + 12.90 + 18.92 + 18.94 + 2.96}}{{50 + 12 + 18 + 18 + 2}} = 91,32\) Câu 6: Nguyên tố hoá học là những nguyên tử có cùng: Lời giải chi tiết Đáp án C Câu 7: Cho hình vẽ mô phỏng các nguyên tử với số liệu như sau: Nhận xét nào sau đây không đúng? A. 1 và 2 là các đồng vị của cùng một nguyên tố hóa học. B. 1 và 3 là các đồng vị của cùng một nguyên tố hóa học. C. 1 và 2 là nguyên tử của hai nguyên tố hóa học khác nhau. D. 1 và 3 có cùng số proton trong hạt nhân. Phương pháp giải Dựa vào hình vẽ mô phỏng của các nguyên tử Lời giải chi tiết Đáp án A Câu 8: Cho cấu hình electron của các nguyên tố sau: Phương pháp giải Nguyên tố kim loại có số electron hóa trị 1,2,3 hoặc 4 Lời giải chi tiết Đáp án B Câu 9: Nguyên tử của một nguyên tố có tổng số hạt là 114. Số hạt mang điện nhiều hơn số hạt không mang điện là 26. Kí hiệu nguyên tử của nguyên tố đó là: Phương pháp giải Tính số p, n, e để xác định nguyên tử Lời giải chi tiết E + P = (114+26):2 = 70 ® E = P = 35 Đáp án B Câu 10: Nguyên tử của nguyên tố A và B đều có phân lớp ngoài cùng là 2p. Tổng số electron ở hai phân lớp ngoài cùng hai nguyên tử là 3. Số hiệu nguyên tử của A và B lần lượt là A. 1 và 2. B. 5 và 6. C. 7 và 8. D. 7 và 9. Phương pháp giải Dựa vào tổng số electron ở hai phân lớp ngoài cùng hai nguyên tử là 3 Lời giải chi tiết Nguyên tử của nguyên tố A, B có electron ở phân lớp 2p. Và tổng số electron ở phân lớp 2p = 3 ® nguyên tố A hoặc B có 1 electron phân lớp p hoặc 2 eletrong phân lớp p. A: 1s22s2p1; B: 1s2s22p2 ® ZA = 5; ZB = 6 Đáp án B II. TỰ LUẬN Bài 1. (1,5 điểm) Biết rằng tổng số các loại hạt (p, n, e) trong nguyên tử R là 40, trong đó hạt không mang điện kém hơn số hạt mang điện là 12. Xác định tên của nguyên tố R và viết kí hiệu nguyên tử R (Biết ZNa=11, ZMg=12, ZAl=13, ZCa=20, ZK=19). Lời giải chi tiết - Tổng số hạt = Số p + Số electron + Số n = 40(1) - Số hạt không mang điện kém hơn số hạt mang điện là 12 ⇒ Số p + Số electron – Số n = 12(2) - Từ (1) và (2) suy ra Số n = 14, Số p = Số electron = Z = 13 A = Z + N = 13 +14 = 27 Vậy R là Al và kí hiệu nguyên tử: \({}_{13}^{27}Al\) Bài 2. (1 điểm) Trong tự nhiên, magnesium có 3 đồng vị bền là 24Mg, 25Mg và 26Mg. Phương pháp phổ khối lượng xác nhận đồng vị 26Mg chiếm tỉ lệ phần trăm số nguyên tử là 11%. Biết rằng nguyên tử khối trung bình của Mg là 24,32. Tính % số nguyên tử của đồng vị 24Mg, đồng vị 25Mg? Lời giải chi tiết Gọi phần trăm đồng vị 24Mg là x% ⇒ Phần trăm đồng vị 25Mg là: 100 – 11 – x = (89 – x) % Nguyên tử khối trung bình của Mg = 24,32 Áp dụng công thức:\(\frac{{24.x + 25.(89 - x)}}{{100}} = 24,32\)⇒ x = 79% Vậy phần trăm đồng vị 24Mg là 79% ⇒ Phần trăm đồng vị 25Mg là: 10%
|




















Danh sách bình luận