Đề thi giữa kì 2 Hóa 10 - Kết nối tri thức - Đề số 7Cho các phản ứng sau:Đề bài
Câu 2 :
Phản ứng nào sau đây là phản ứng oxi hóa – khử?
Câu 3 :
Cho phản ứng hóa học sau đây:
Câu 4 :
Fe2O3 là thành phần chính của quặng hematit đỏ, dùng để luyện gang. Số oxi hóa của iron trong Fe2O3 là:
Câu 5 :
Cho phản ứng sau: Fe + HNO3 \( \to \) Fe(NO3)3 + NO + H2O. Tổng hệ số các chất sau khi cân bằng (với hệ số nguyên, tối giản) là
Câu 6 :
Cho phương trình hóa học sau: 3NO2 + H2O \( \to \) 2HNO3 + NO. Vai trò của NO2 trong phản ứng trên là gì
Câu 7 :
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất khử
Câu 8 :
Cho 19,2 gam một kim loại M tan hoàn toàn trong dung dịch HNO3 loãng, dư thu được 4,958 lít khí NO (đkc, sản phẩm duy nhất). Kim loại M là
Câu 9 :
Cho 6,4 gam Cu tác dụng hoàn toàn với dung dịch HNO3 đặc sau phản ứng thu được V (lít) NO2 (đkc) là sản phẩm khử duy nhất của N+5. Tính giá trị của V.
Câu 10 :
Phát biểu nào sau đây sai?
Câu 11 :
Phát biểu nào sau đây không đúng?
Câu 12 :
Dựa vào phương trình nhiệt hóa học của các phản ứng sau: CS2(l) + 3O2(g) \( \to \) CO2(g) + 2SO2(g) \({\Delta _r}H_{298}^0\)= -1110,21 kJ CO2(g) \( \to \) CO(g) + ½ O2(g) \({\Delta _r}H_{298}^0\)= 280,00 kJ Na(s) + 2H2O(l) \( \to \) NaOH(aq) + H2(g) \({\Delta _r}H_{298}^0\)= -367,50 kJ ZnSO4(s) \( \to \) ZnO(s) + SO3(g) \({\Delta _r}H_{298}^0\)= 235,21 kJ Cặp phản ứng thu nhiệt là
Câu 13 :
Đơn vị của nhiệt tạo thành chuẩn là
Câu 14 :
Cho phản ứng: 2ZnS(s) + 3O2 \( \to \) 2ZnO(s) + 2SO2(g) \({\Delta _r}H_{298}^0\)=-285,66 kJ Giá trị của \({\Delta _r}H_{298}^0\)khi lấy gấp 3 lần khối lượng của các chất là
Câu 15 :
Cho các phản ứng dưới đây: (1) CO(g) + ½ O2(g) \( \to \) CO2(g) \({\Delta _r}H_{298}^0\)=-283 kJ (2) C(s) + H2O(g)\( \to \) CO(g) + H2(g) \({\Delta _r}H_{298}^0\)=131,25kJ (3) H2(g) + F2(g) \( \to \) 2HF(g) \({\Delta _r}H_{298}^0\)=-546kJ (4) H2(g) + Cl2(g) \( \to \) 2HCl(g) \({\Delta _r}H_{298}^0\)=-184,62 kJ Phản ứng xảy ra thuận lợi nhất là
Câu 16 :
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau: \( \to \)\({\Delta _r}H_{298}^0\) N2(g) + O2(g) 2NO(g) =180 kJ Kết luận nào sau đây đúng?
Câu 17 :
Cho phương trình nhiệt hóa học sau: NaOH(aq) + HCl(aq) \( \to \) NaCl(aq) + H2O(l) \({\Delta _r}H_{298}^0\)= -57,3 kJ Lượng nhiệt tỏa ra khi dùng dung dịch có chứa 8 gam NaOH trung hòa lượng vừa đủ dung dịch HCl là
Câu 19 :
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn: C2H4(g) + H2(g) \( \to \)C2H6(g) Biết năng lượng liên kết của một số liên kết được cho dưới bảng sau
Cho các mệnh đều sau: a) \({\Delta _r}H_{298}^o = - 134kJ\) b) \(\sum {{E_b}(c{\rm{d}}) = 2720} kJ\) c) \(\sum {{E_b}(sp) = 3254} kJ\) d) Đây là phản ứng thu nhiệt. Số mệnh đề đúng là
Câu 20 :
Cho phản ứng hóa học xảy ra ở điều kiện chuẩn sau: 2NO2 (đỏ nâu) \( \to \) N2O4 (không màu) Biết NO2 và N2O4 có \({\Delta _f}H_{298}^o\)tương ứng là 33,18 kJ/mol và 9,16kJ/mol. Điều này chứng tỏ phản ứng
Lời giải và đáp án
Đáp án : C Phương pháp giải :
Chất khử là chất nhường electron (số oxi hóa tăng) Lời giải chi tiết :
Chất khử là chất nhường electron (số oxi hóa tăng)
Các phản ứng NH3 thể hiện tính khử là: (1), (2), (3) Đáp án C
Câu 2 :
Phản ứng nào sau đây là phản ứng oxi hóa – khử?
Đáp án : C Phương pháp giải :
Phản ứng oxi hóa – khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa Lời giải chi tiết :
Phản ứng oxi hóa – khử là: \(3M{g^o} + 4{H_2}\mathop S\limits^{ + 6} {O_4} \to 3MgS{O_4} + {S^o} + 4{H_2}{\rm{O}}\) Đáp án C
Câu 3 :
Cho phản ứng hóa học sau đây:
Đáp án : B Phương pháp giải :
Khái niệm chất khử, chất oxi hóa, sự khử, sự oxi hóa: - Chất khử (bị oxi hóa) là chất cho electron ⟹ số oxi hóa tăng. - Chất oxi hóa (bị khử) là chất nhận eletron ⟹ số oxi hóa giảm. - Sự khử (quá trình khử) là quá trình nhận electron. - Sự oxi hóa (quá trình oxi hóa) là quá trình cho electron. Lời giải chi tiết :
Sự oxi hóa: Co \( \to \) C+4 + 4e => C là chất khử Sự khử: \(\mathop O\nolimits_2^o + 4{\rm{e}} \to 2\mathop O\limits^{ - 2} \)=> O2 là chất oxi hóa Đáp án B
Câu 4 :
Fe2O3 là thành phần chính của quặng hematit đỏ, dùng để luyện gang. Số oxi hóa của iron trong Fe2O3 là:
Đáp án : A Phương pháp giải :
Dựa vào cách xác định số oxi hóa Lời giải chi tiết :
Gọi số oxi hóa của Fe trong Fe2O3 là x 2.x + 3.(-2) = 0 => x = +3 Đáp án A
Câu 5 :
Cho phản ứng sau: Fe + HNO3 \( \to \) Fe(NO3)3 + NO + H2O. Tổng hệ số các chất sau khi cân bằng (với hệ số nguyên, tối giản) là
Đáp án : B Phương pháp giải :
Cân bằng phản ứng oxi hóa – khử bằng phương pháp thăng bằng electron: 1. Xác định số oxi hóa của những nguyên tố có số oxi hóa thay đổi. 2. Viết quá trình oxi hóa và quá trình khử, cân bằng mỗi quá trình. 3. Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron do chất oxi hóa nhận. 4. Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Hoàn thành phương trình hóa học. Lời giải chi tiết :
Các quá trình nhường, nhận electron \(F{e^o} \to F{e^{ + 3}} + 3{\rm{e}}|x1\) \({N^{ + 5}} + 3{\rm{e}} \to {N^{ + 2}}|x1\) Thêm hệ số vào phản ứng ta có: Fe + 4HNO3 \( \to \) Fe(NO3)3 + NO + 2H2O => Tổng hệ số các chất là: 1 + 4 + 1 + 1 + 2 = 9 Đáp án B
Câu 6 :
Cho phương trình hóa học sau: 3NO2 + H2O \( \to \) 2HNO3 + NO. Vai trò của NO2 trong phản ứng trên là gì
Đáp án : C Phương pháp giải :
Viết các quá trình nhường, nhận electron để xác định vai trò của NO2 (N+4). - Chất khử (bị oxi hóa) là chất cho electron ⟹ số oxi hóa tăng. - Chất oxi hóa (bị khử) là chất nhận eletron ⟹ số oxi hóa giảm. Lời giải chi tiết :
\(3\mathop N\limits^{ + 4} {O_2} + {H_2}{\rm{O}} \to 2H\mathop N\limits^{ + 5} {O_3} + \mathop N\limits^{ + 2} O\) Quá trình nhường electron: N+4\( \to \)N+5 + 1e Quá trình nhận electron: N+4 + 2e\( \to \)N+2 Ta thấy, N+4 vừa tham gia vào quá trình nhường electron (là chất khử), vừa tham gia vào quá trình nhận electron (là chất oxi hóa) Vậy NO2 vừa là chất khử, vừa là chất oxi hóa Đáp án C
Câu 7 :
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất khử
Đáp án : B Phương pháp giải :
Dựa vào lý thuyết về phản ứng oxi hóa – khử Lời giải chi tiết :
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất nhận electron Đáp án B
Câu 8 :
Cho 19,2 gam một kim loại M tan hoàn toàn trong dung dịch HNO3 loãng, dư thu được 4,958 lít khí NO (đkc, sản phẩm duy nhất). Kim loại M là
Đáp án : A Phương pháp giải :
Các quá trình nhường nhận electron M \( \to \) Mn+ + ne N+5 + 3e\( \to \) N+2 Áp dụng bảo toàn electron => mối quan hệ giữa M và n Biện luận với n = 1,2,3 để chọn ra M thỏa mãn => tên kim loại Lời giải chi tiết :
n NO = 0,2 mol Các quá trình nhường nhận e: M – ne \( \to \) Mn+ N+5 + 3e \( \to \) N+2 Bảo toàn electron: n.n M = 3.n NO => \(\frac{{19,2}}{M}.n = 3.0,2 \Rightarrow M = 32n\) Biện luận với n = 1;2;3 thấy với n = 2; M = 64 (Cu) thỏa mãn Đáp án A
Câu 9 :
Cho 6,4 gam Cu tác dụng hoàn toàn với dung dịch HNO3 đặc sau phản ứng thu được V (lít) NO2 (đkc) là sản phẩm khử duy nhất của N+5. Tính giá trị của V.
Đáp án : A Lời giải chi tiết :
Cuo \( \to \) Cu+2 + 2e N+5 + 1e\( \to \) N+4 Bảo toàn electron: 2.nCu = n NO2 Đáp án A
Câu 10 :
Phát biểu nào sau đây sai?
Đáp án : C Lời giải chi tiết :
C sai, vì giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều Đáp án C
Câu 11 :
Phát biểu nào sau đây không đúng?
Đáp án : D Lời giải chi tiết :
Các phản ứng tỏa nhiệt như: CO2 + CaO \( \to \) CaCO3, phản ứng lên men… khó xảy ra khi đun nóng => D sai Đáp án D
Câu 12 :
Dựa vào phương trình nhiệt hóa học của các phản ứng sau: CS2(l) + 3O2(g) \( \to \) CO2(g) + 2SO2(g) \({\Delta _r}H_{298}^0\)= -1110,21 kJ CO2(g) \( \to \) CO(g) + ½ O2(g) \({\Delta _r}H_{298}^0\)= 280,00 kJ Na(s) + 2H2O(l) \( \to \) NaOH(aq) + H2(g) \({\Delta _r}H_{298}^0\)= -367,50 kJ ZnSO4(s) \( \to \) ZnO(s) + SO3(g) \({\Delta _r}H_{298}^0\)= 235,21 kJ Cặp phản ứng thu nhiệt là
Đáp án : D Phương pháp giải :
\({\Delta _r}H_{298}^0\)> 0 => phản ứng thu nhiệt \({\Delta _r}H_{298}^0\)< 0 => phản ứng tỏa nhiệt Lời giải chi tiết :
Cặp phản ứng thu nhiệt là (2) và (4). Đáp án D
Câu 13 :
Đơn vị của nhiệt tạo thành chuẩn là
Đáp án : B Phương pháp giải :
Dựa vào lý thuyết về năng lượng hóa học Lời giải chi tiết :
Đơn vị của nhiệt tạo thành chuẩn là kJ/mol Đáp án B
Câu 14 :
Cho phản ứng: 2ZnS(s) + 3O2 \( \to \) 2ZnO(s) + 2SO2(g) \({\Delta _r}H_{298}^0\)=-285,66 kJ Giá trị của \({\Delta _r}H_{298}^0\)khi lấy gấp 3 lần khối lượng của các chất là
Đáp án : A Phương pháp giải :
Dựa vào lý thuyết về enthalpy Lời giải chi tiết :
Giá trị của \({\Delta _r}H_{298}^0\)khi lấy gấp 3 lần khối lượng của các chất là \({\Delta _r}H_{298}^0\)= -285,66.3 = -856,98 kJ Đáp án A
Câu 15 :
Cho các phản ứng dưới đây: (1) CO(g) + ½ O2(g) \( \to \) CO2(g) \({\Delta _r}H_{298}^0\)=-283 kJ (2) C(s) + H2O(g)\( \to \) CO(g) + H2(g) \({\Delta _r}H_{298}^0\)=131,25kJ (3) H2(g) + F2(g) \( \to \) 2HF(g) \({\Delta _r}H_{298}^0\)=-546kJ (4) H2(g) + Cl2(g) \( \to \) 2HCl(g) \({\Delta _r}H_{298}^0\)=-184,62 kJ Phản ứng xảy ra thuận lợi nhất là
Đáp án : C Phương pháp giải :
Dựa vào lý thuyết về năng lượng hóa học Lời giải chi tiết :
Phản ứng xảy ra thuận lợi nhất là phản ứng (3) Đáp án C
Câu 16 :
Phương trình nhiệt hóa học giữa nitrogen và oxygen như sau: \( \to \)\({\Delta _r}H_{298}^0\) N2(g) + O2(g) 2NO(g) =180 kJ Kết luận nào sau đây đúng?
Đáp án : D Phương pháp giải :
Dựa vào lý thuyết về năng lượng hóa học Lời giải chi tiết :
A sai, vì nitrogen và oxygen phản ứng mạnh hơn khi ở nhiệt độ cao B sai, vì phản ứng thu nhiệt C sai, vì phản ứng xảy ra thuận lợi hơn ở nhiệt độ cao D đúng Đáp án D
Câu 17 :
Cho phương trình nhiệt hóa học sau: NaOH(aq) + HCl(aq) \( \to \) NaCl(aq) + H2O(l) \({\Delta _r}H_{298}^0\)= -57,3 kJ Lượng nhiệt tỏa ra khi dùng dung dịch có chứa 8 gam NaOH trung hòa lượng vừa đủ dung dịch HCl là
Đáp án : C Phương pháp giải :
Dựa vào lý thuyết về biến thiên enthalpy của phản ứng hóa học Lời giải chi tiết :
n NaOH = 8:40 = 0,2 mol => Lượng nhiệt tỏa ra khi cho 8gam NaOH phản ứng vừa đủ với HCl là: (-57,3).0,2 = -11,46 kJ Đáp án C
Đáp án : A Phương pháp giải :
Dựa vào lý thuyết về năng lượng hóa học. Lời giải chi tiết :
\(\begin{array}{l}{\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(C{O_2},g) + 2.{\Delta _f}H_{298}^o({H_2}{\rm{O}},g) - {\Delta _f}H_{298}^o(C{H_4},g) - 0\\ \to {\Delta _r}H_{298}^o = - 393,5 + 2.( - 285,8) - ( - 74,9) = - 890,2kJ/mol\end{array}\) Đáp án A
Câu 19 :
Cho biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn: C2H4(g) + H2(g) \( \to \)C2H6(g) Biết năng lượng liên kết của một số liên kết được cho dưới bảng sau
Cho các mệnh đều sau: a) \({\Delta _r}H_{298}^o = - 134kJ\) b) \(\sum {{E_b}(c{\rm{d}}) = 2720} kJ\) c) \(\sum {{E_b}(sp) = 3254} kJ\) d) Đây là phản ứng thu nhiệt. Số mệnh đề đúng là
Đáp án : C Phương pháp giải :
Dựa vào lý thuyết về năng lượng hóa học Lời giải chi tiết :
a), b) đúng c), d) sai \({\Delta _r}H_{298}^o = \sum {{E_b}(c{\rm{d}}) - \sum {{E_b}(sp) = (4{E_{C - H}} + {E_{C = C}} + {E_{H - H}}) - (6{{\rm{E}}_{C - H}} + {E_{C - C}}) = 2720 - 2854 = - 134kJ/mol} } \) => phản ứng tỏa nhiệt Đáp án C
Câu 20 :
Cho phản ứng hóa học xảy ra ở điều kiện chuẩn sau: 2NO2 (đỏ nâu) \( \to \) N2O4 (không màu) Biết NO2 và N2O4 có \({\Delta _f}H_{298}^o\)tương ứng là 33,18 kJ/mol và 9,16kJ/mol. Điều này chứng tỏ phản ứng
Đáp án : C Phương pháp giải :
Lý thuyết về enthalpy Lời giải chi tiết :
Phản ứng tỏa nhiệt, N2O4 bền vững hơn NO2 Đáp án C
|














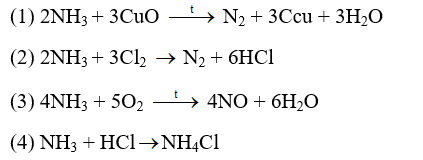

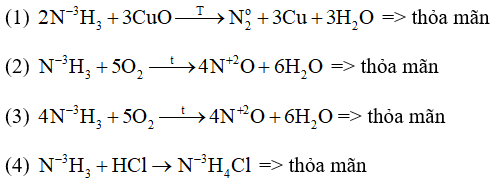









Danh sách bình luận