Đề thi giữa kì 1 Hóa 10 Kết nối tri thức - Đề số 1Tải về Số electron lớp ngoài cùng có trong nguyên tử silicon (Z = 14) là Số elctron tối đa trong lớp M là Các nguyên tố thuộc cùng một nhóm A trong bảng tuần hoàn sẽ có cùng số Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Đề thi I. Trắc nghiệm (5 điểm) Câu 1: Số electron lớp ngoài cùng có trong nguyên tử silicon (Z = 14) là A. 5 B. 2 C. 1 D. 4 Câu 2: Số elctron tối đa trong lớp M là A. 2 B. 32 C. 8 D. 18 Câu 3: Một nguyên tử có cấu hình 1s22s22p3. Chọn phát biểu sai: A. Nguyên tử đó có 7 electron. B. Nguyên tử đó có 7 neutron. C. Không xác định được số neutron. D. Nguyên tử đó có 7 proton Câu 4. Phát biểu nào sau đây sai? A. Số proton trong hạt nhân bằng số electron ở lớp vỏ nguyên tử B. Chỉ có hạt nhân nguyên tử magnesium mới có 12 proton C. Khối lượng nguyên tử tập trung chủ yếu ở lớp vỏ nguyên tử D. Trong nguyên tử mức năng lượng 4s thấp hơn mức năng lượng 3d Câu 5: Nguyên tố có độ âm điện lớn nhất A. Fluorine B. Iodine C. Lithium D. Caesium Câu 6: Kí hiệu phân lớp nào sau đây là sai? A. 2p B. 3d C. 4f D. 2d Câu 7: Các nguyên tố thuộc cùng một nhóm A trong bảng tuần hoàn sẽ có cùng số A. electron lớp ngoài cùng. B. điện tích hạt nhân. C. lớp electron. D. electron s hay p. Câu 8: Số hạt proton trong nguyên tử \({}_{19}^{39}K\) là : A. 39 B. 19 C. 20 D. 58 Câu 9: Cho các nguyên tử Al, Na, K, Mg. Thứ tự tăng dần tính kim loại của các nguyên tử trên là A. Al < Mg < Na < K B. Al < Na < Mg < K C. K < Na < Mg < Al D. K < Mg < Na < Al Câu 10. Cấu hình e nào sau đây của nguyên tử thuộc nguyên tố kim loại? A. 1s22s22p6 B. 1s22s22p63s23p5 C. 1s22s22p63s23p3 D. 1s22s22p63s2 Câu 11: Hạt mang điện trong nhân nguyên tử là A. neutron. B. electron. C. proton. D. neutron và electron. Câu 12: Tổng số hạt p, n, e trong nguyên tử nguyên tố A là 21. Số hạt mang điện nhiều hơn số hạt không mang điện là 7. Vậy cấu hình electron của A là: A. 1s22s22p4 B. 1s22s22p2 C. 1s22s22p3 D. 1s22s22p5 Câu 13: Cho ba nguyên tử có kí hiệu là \({}_{12}^{24}Mg,{}_{12}^{25}Mg,{}_{12}^{26}Mg\). Phát biểu nào sau đây là sai? A. Nguyên tố Mg có 3 đồng vị. B. Số hạt electron của các nguyên tử lần lượt là: 12, 13, 14 C. Ba nguyên tử trên đều thuộc nguyên tố Mg. D. Hạt nhân của mỗi nguyên tử đều có 12 proton. Câu 14: Nguyên tử của nguyên tố X có 16 electron. Nguyên tố X là A. S. B. Cl. C. N. D. O. Câu 15: Nguyên tố hóa học là những nguyên tử có cùng A. số khối. B. số nơtron. C. điện tích hạt nhân. D. số nơtron và proton. II. Tự luận (5 điểm) Câu 1 (2,0 điểm) Nguyên tử của nguyên tố R có 19 proton, 20 nơtron và 19 electron. a. Viết kí hiệu nguyên tử (dạng \({}_Z^AR\)) của R. b. Viết cấu hình electron nguyên tử của R. Cho biết R là kim loại, phi kim hay khí hiếm. Vì sao? Câu 2 (2,0 điểm). Nguyên tử A có tổng số hạt là 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16. a. Tính số hạt từng loại. b. Viết cấu hình e nguyên tử của X và biểu diễn cấu hình theo orbital Câu 3 (1,0 điểm). Trong tự nhiên Cu có 2 đồng vị là là 63Cu chiếm 73% và 65Cu chiếm 27% về số nguyên tử. Tính thành phần phần trăm về khối lượng của là 63Cu trong CuCl2 (biết MCl = 35,5) -------- Hết -------- Đáp án I. Trắc nghiệm
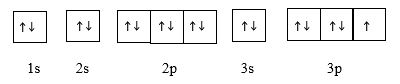
Chi tiết: Câu 1: Silicon có Z = 14 -> Cấu hình: 1s22s22p63s23p2 -> Số electron lớp ngoài cùng là 4 -> đáp án D Câu 2: Lớp M (n=3) -> có 3 lớp gồm các phân lớp 1s, 2s, 2p, 3s, 3p -> Số e tối đa trong lớp M là 18 -> đáp án D Câu 3. cấu hình 1s22s22p3 Từ cấu hình chỉ xác định được số electron và số proton -> đáp án C Câu 4: Đáp án C Sai vì khối lượng nguyên tử tập trung chủ yếu ở hạt nhân Câu 5: Đáp án A: Câu 6: Đáp án D Sai vì lớp n = 2 không có phân lớp d Câu 7: Đáp án A Câu 8: Đáp án B Từ kí hiệu nguyên tử \({}_{19}^{39}K\)-> Z = 19 -> Số hạt proton = Z = 19 Câu 9: Đáp án A Giải thích: - Các nguyên tố Al, Na, Mg thuộc cùng chu kì 2 -> Tính kim loại sẽ giảm dần theo chiều tăng của điện tích hạt nhân -> Na > Mg > Al (1) - Na và K là 2 nguyên tố thuộc cùng 1 nhóm IA trong bảng tuần hoàn -> Tính kim loại sẽ tăng dần theo chiều tăng của điện tích hạt nhân -> K > Na (2) Từ (1) và (2) => Thứ tự sắp xếp: Al < Mg < Na < K Câu 10: Đáp án D Giải thích: Các nguyên tố kim loại có 1, 2, 3 electron lớp ngoài cùng Đáp án D có 2 electron ngoài cùng Câu 11: Đáp án C Trong hạt nhân nguyên tử chứa proton mang điện tích dương và neutron không mang điện Câu 12 Đáp án C Giải thích: A có tổng số hạt là 21 => P + N + E = 21 Mà P = E -> 2P + N = 21 (1) Số hạt mang điện nhiều hơn số hạt không mang điện là 7 -> P + E – N = 7 -> 2P – N = 7 (2) Từ (1) và (2) => P = N = E = 7 Cấu hình của A là 1s22s22p3 Câu 13: Đáp án B Sai vì số electron = số proton = 12 Câu 14: Đáp án D Câu 15: Đáp án C Nguyên tố hóa học là những nguyên tử có cùng số điện tích hạt nhân II. Tự luận Câu 1: a) Số khối của R: A = P + N = 19 + 20 = 39 -> Kí hiệu của R: \({}_{19}^{39}R\) b) Cấu hình electron: 1s22s22p63s23p64s1 -> số electron lớp ngoài cùng là 1 -> R là nguyên tố kim loại Câu 2: A có tổng số hạt là 21 => P + N + E = 52 Mà P = E -> 2P + N = 52 (1) Số hạt mang điện nhiều hơn số hạt không mang điện là 7 -> P + E – N = 16 -> 2P – N = 16 (2) Từ (1) và (2) => P = E = 17; N =18 b) Cấu hình e nguyên tử: 1s22s22p63s23p5 - Biểu diễn cấu hình theo orbital Câu 3: \(\)\(\overline A = \frac{{a.A + b.B}}{{a + b}}\) Ta có nguyên tử khố trung bình của Cu là: \(\overline {{A_{Cu}}} = \frac{{63.73 + 65.27}}{{100}} = 63,54\) % \({}^{63}Cu\) trong CuCl2 là: \(\% {}^{63}Cu = \frac{{63.0,73}}{{63,54 + 35,5.2}}.100 = 34,18\% \)
|




















Danh sách bình luận