Đề thi giữa kì 2 Hóa 10 - Kết nối tri thức - Đề số 2Khi cho Cu vào dung dịch FeCl3; H2SĐề bài
Câu 1 :
Đốt cháy hoàn toàn 1 mol C2H4(g). Biết các sản phẩm thu được đều ở thể khí. Giá
Câu 2 :
Khi cho Cu vào dung dịch FeCl3; H2S vào dung dịch CuSO4, HI vào dung dịch FeCl3; dung dịch AgNO3 vào FeCl3; dung dịch NaHSO4 vào dung dịch Fe(NO3)2, O2 vào dung dịch KI, số cặp chất phản ứng được với nhau là
Câu 3 :
Cho biết các phản ứng xảy ra như sau: 2FeBr2 + Br2 2FeBr3 (1) 2NaBr + Cl2 2NaCl + Br2 (2) Phát biểu đúng là:
Câu 4 :
Cho phương trình phản ứng aFeSO4 + bK2Cr2O7 + cH2SO4 \( \to \) dFe2(SO4)3 + eK2SO4 + fCr2(SO4)3 + gH2O. Tỉ lệ a : b là
Câu 5 :
Cho 4,8 gam Mg tác dụng với lượng dư dung dịch HNO3 đặc, nóng thu được V lít khí NO2 (ở đkc, là sản phẩm khử duy nhất). Giá trị của V là
Câu 6 :
Số oxi hoá của S trong các chất: S ; H2SO4 ; Na2SO4 ; CaSO3 ;NaHS lần lượt bằng:
Câu 7 :
Cho phản ứng: Cl2 + 2NaOH \( \to \)NaCl + NaClO + H2O. Vai trò của Cl2
Câu 8 :
Cho các quá trình sau :
Câu 9 :
Phát biểu nào sau đây đúng?
Câu 10 :
Khái niệm nào sau đây về enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) là chính xác nhất ?
Câu 11 :
Mô tả nào sau đây là đúng theo phương trình nhiệt hóa học sau :
Câu 12 :
Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)? (1) 2C(than chì) + O2(g) \( \to \)2CO(g) (2) C (than chì) + 1/2 O2 (g) \( \to \)CO(g) (3) C (than chì) + CO2(g) \( \to \)2CO(g) (4) CO(g) \( \to \)C (than chì) + O(g)
Câu 13 :
Trong các chất sau, chất nào bền nhất về nhiệt ở điều kiện chuẩn ?
Câu 14 :
Định nghĩa nào sau đây về biến thiên enthalpy là chính xác nhất ?
Câu 15 :
Cho phương trình nhiệt hóa học của phản ứng tạo thành NO(g) trong không khí \({N_2}(g) + {O_2}(g) \to 2NO(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = 180kJ\) Phát biểu nào sau đây đúng?
Câu 16 :
Dựa vào phương trình nhiệt hóa học của phản ứng sau: \({N_2}(g) + 3{H_2}(g) \to 2N{H_3}(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 91,8kJ\) Giá trị \({\Delta _r}H_{298}^0\)của phản ứng: 2NH3(g) \( \to \)N2(g) + 3H2(g) là
Câu 17 :
Ở điều kiện chuẩn, cần phải cung cấp 26,48 kJ nhiệt lượng cho quá trình ½ mol H2 (thể khí) phản ứng với ½ mol I2 (thể rắn) để thu được 1 mol HI (thể khí). Ta nói enthalpy tạo thành của HI khí ở điều kiện chuẩn là 26,48 kJ mol-1. Phản ứng trên được biểu diễn như sau: \(\frac{1}{2}{H_2}(g) + \frac{1}{2}{I_2}(g) \to HI(g){\rm{ }}{\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{ = }}26,48kJ/mol\) ở cùng điều kiện phản ứng, nếu thu được 3 mol HI thì lượng nhiệt cần thu vào là bao nhiêu kJ?
Câu 18 :
Quá trình hòa tan calcium chloride trong nước: \(CaC{l_2}(s) \to C{a^{2 + }}(aq) + 2C{l^ - }(aq)\)
Biến thiên enthalpy của quá trình trên là:
Câu 19 :
Cho biết năng lượng liên kết trong phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng: \({N_2}(g) + {O_2}(g) \to 2NO(g)\)
Câu 20 :
Cho bảng năng lượng liên kết của các chất sau: Tính \({\Delta _r}H_{298}^0\)của phản ứng sau: \({F_2}(g) + {H_2}O(g) \to 2HF(g) + \frac{1}{2}{O_2}(g)\). Dự đoán các phản ứng trên là thuận lợi hay không thuận lợi.
Câu 21 :
Cho phương trình phản ứng sau: \(2{H_2}(g) + {O_2}(g) \to 2{H_2}O(l){\rm{ }}\Delta {\rm{H = - 572kJ}}\). Khi cho 2g khí H2 tác dụng hoàn toàn với 32g khí O2 thì phản ứng
Lời giải và đáp án
Câu 1 :
Đốt cháy hoàn toàn 1 mol C2H4(g). Biết các sản phẩm thu được đều ở thể khí. Giá
Đáp án : A Phương pháp giải :
Dựa vào nhiệt tạo thành của các chất Lời giải chi tiết :
C2H4 (g) + 3O2(g)\( \to \)2CO2(g) + 2H2O(g) \({\Delta _r}H_{298}^0\)= 2.\({\Delta _f}H_{298}^0(C{O_2}) + 2{\Delta _f}H_{298}^0({H_2}{\rm{O}}) - {\Delta _f}H_{298}^0({C_2}{H_4})\) = 2. -393,5 + 2.(-241,8) – 52,4 = -1323 KJ Đáp án A
Câu 2 :
Khi cho Cu vào dung dịch FeCl3; H2S vào dung dịch CuSO4, HI vào dung dịch FeCl3; dung dịch AgNO3 vào FeCl3; dung dịch NaHSO4 vào dung dịch Fe(NO3)2, O2 vào dung dịch KI, số cặp chất phản ứng được với nhau là
Đáp án : C Phương pháp giải :
Dựa vào khái niệm của phản ứng oxi hóa khử Lời giải chi tiết :
Cu + 2FeCl3 \( \to \)CuCl2 + 2FeCl2 2HI + 2FeCl3 \( \to \)2FeCl2 + 2HCl + I2 9Fe(NO3)2 + 12NaHSO4 → 2Fe2(SO4)3 + 5Fe(NO3)3 + 6Na2SO4 + 6H2O + 3NO ½ O2 + 2KI + H2O \( \to \) 2KOH + I2 Đáp án C
Câu 3 :
Cho biết các phản ứng xảy ra như sau: 2FeBr2 + Br2 2FeBr3 (1) 2NaBr + Cl2 2NaCl + Br2 (2) Phát biểu đúng là:
Đáp án : C Phương pháp giải :
Dựa vào kiến thức về phản ứng oxi hóa khử Lời giải chi tiết :
Tính oxi hóa của Cl2 mạnh hơn của Fe3+ Đáp án D
Câu 4 :
Cho phương trình phản ứng aFeSO4 + bK2Cr2O7 + cH2SO4 \( \to \) dFe2(SO4)3 + eK2SO4 + fCr2(SO4)3 + gH2O. Tỉ lệ a : b là
Đáp án : A Phương pháp giải :
Cân bằng phương trình theo phương pháp thăng bằng electron Lời giải chi tiết :
\(\begin{array}{l}F{e^{ + 2}} \to F{e^{ + 3}} + 1{\rm{e|x3e}}\\C{r^{ + 6}} + 3{\rm{e}} \to C{r^{ + 3}}|x1{\rm{e}}\end{array}\) 6FeSO4 + K2Cr2O7 + 10H2SO4 \( \to \) 3Fe2(SO4)3 + K2SO4 + Cr2(SO4)3 + 10H2O. Tỉ lệ a: b = 6 : 1 Đáp án A
Câu 5 :
Cho 4,8 gam Mg tác dụng với lượng dư dung dịch HNO3 đặc, nóng thu được V lít khí NO2 (ở đkc, là sản phẩm khử duy nhất). Giá trị của V là
Đáp án : A Phương pháp giải :
Dựa vào phương pháp bảo toàn electron Lời giải chi tiết :
n Mg = 4,8: 24 = 0,2 mol Mg + 4HNO3 \( \to \)Mg(NO3)2 + 2NO2 + 2H2O n NO2 = 0,2 . 2 = 0,4 mol V NO2 = 0,4 . 24,79 = 9,916 lít Đáp án A
Câu 6 :
Số oxi hoá của S trong các chất: S ; H2SO4 ; Na2SO4 ; CaSO3 ;NaHS lần lượt bằng:
Đáp án : C Phương pháp giải :
Dựa vào quy tắc xác định số oxi hóa Lời giải chi tiết :
\(\mathop S\limits^0 ,{H_2}\mathop S\limits^{ + 6} {O_4},N{a_2}\mathop S\limits^{ + 6} {O_4},Ca\mathop S\limits^{ + 4} {O_3},NaH\mathop S\limits^{ - 2} \) Đáp án C
Câu 7 :
Cho phản ứng: Cl2 + 2NaOH \( \to \)NaCl + NaClO + H2O. Vai trò của Cl2
Đáp án : D Phương pháp giải :
Dựa vào kiến thức về phản ứng oxi hóa khử Lời giải chi tiết :
Cl2 vừa bị oxi hóa, vừa bị khử Đáp án D
Câu 8 :
Cho các quá trình sau :
Đáp án : A Phương pháp giải :
Dựa vào dấu hiệu của phản ứng thu nhiệt và tỏa nhiệt Lời giải chi tiết :
Tỏa nhiệt : (1), (3), (4), (6) và thu nhiệt : (2), (5).
Câu 9 :
Phát biểu nào sau đây đúng?
Đáp án : A Phương pháp giải :
Dựa vào điều kiện chuẩn của phản ứng Lời giải chi tiết :
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K.
Câu 10 :
Khái niệm nào sau đây về enthalpy tạo thành chuẩn (nhiệt tạo thành chuẩn) là chính xác nhất ?
Đáp án : C Phương pháp giải :
Dựa vào khái niệm về enthalpy tạo thành chuẩn Lời giải chi tiết :
Enthalpy tạo thành chuẩn là nhiệt kèm theo (thu vào hoặc tỏa ra) của phản ứng tạo thành 1 mol chất đó từ các đơn chất bền nhất ở điều kiện chuẩn Đáp án C
Câu 11 :
Mô tả nào sau đây là đúng theo phương trình nhiệt hóa học sau :
Đáp án : D Phương pháp giải :
Dựa vào khái niệm của enthalpy tạo thành chuẩn của chất Lời giải chi tiết :
Ở điều kiện chuẩn, phản ứng của 1 mol Ca(thể rắn) với 2 mol C (thể rắn) thu được 1 mol CaC2 (thể rắn) và giải phóng (tỏa ra) một lượng nhiệt là 62,00 kJ, ta nói enthalpy tạo thành chuẩn của CaC2 (thể rắn) là –62 kJ/mol. Đáp án D
Câu 12 :
Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)? (1) 2C(than chì) + O2(g) \( \to \)2CO(g) (2) C (than chì) + 1/2 O2 (g) \( \to \)CO(g) (3) C (than chì) + CO2(g) \( \to \)2CO(g) (4) CO(g) \( \to \)C (than chì) + O(g)
Đáp án : C Phương pháp giải :
Dựa vào khái niệm enthalpy tạo thành chuẩn của chất Lời giải chi tiết :
C (than chì) + 1/2 O2 (g) \( \to \)CO(g) Đáp án C
Câu 13 :
Trong các chất sau, chất nào bền nhất về nhiệt ở điều kiện chuẩn ?
Đáp án : B Phương pháp giải :
Dựa vào năng lượng của các chất Lời giải chi tiết :
ở điều kiện thường, N2(g) bền về nhiệt vì trong phân tử N2 có liên kết ba bền vững đáp án B
Câu 14 :
Định nghĩa nào sau đây về biến thiên enthalpy là chính xác nhất ?
Đáp án : D Phương pháp giải :
Dựa vào khái niệm về biến thiên enthalpy của phản ứng Lời giải chi tiết :
Biến thiên enthalpy là nhiệt lượng tỏa ra hay thu vào của phản ứng được xác định ở điều kiện chuẩn Đáp án D
Câu 15 :
Cho phương trình nhiệt hóa học của phản ứng tạo thành NO(g) trong không khí \({N_2}(g) + {O_2}(g) \to 2NO(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = 180kJ\) Phát biểu nào sau đây đúng?
Đáp án : C Phương pháp giải :
Dựa vào biến thiên enthalpy của phản ứng Lời giải chi tiết :
Cho 1 mol N2 tác dụng với 1 mol O2 thu vào nhiệt lượng là 180 kJ Đáp án C
Câu 16 :
Dựa vào phương trình nhiệt hóa học của phản ứng sau: \({N_2}(g) + 3{H_2}(g) \to 2N{H_3}(g){\rm{ }}{\Delta _{\rm{r}}}{\rm{H}}_{298}^0 = - 91,8kJ\) Giá trị \({\Delta _r}H_{298}^0\)của phản ứng: 2NH3(g) \( \to \)N2(g) + 3H2(g) là
Đáp án : D Phương pháp giải :
Dựa vào enthalpy của phản ứng (1) Lời giải chi tiết :
Phản ứng (2) là phản ứng nghịch của phản ứng (1) => \({\Delta _r}H_{298}^0\)(2) = 91,8 kJ Đáp án D
Câu 17 :
Ở điều kiện chuẩn, cần phải cung cấp 26,48 kJ nhiệt lượng cho quá trình ½ mol H2 (thể khí) phản ứng với ½ mol I2 (thể rắn) để thu được 1 mol HI (thể khí). Ta nói enthalpy tạo thành của HI khí ở điều kiện chuẩn là 26,48 kJ mol-1. Phản ứng trên được biểu diễn như sau: \(\frac{1}{2}{H_2}(g) + \frac{1}{2}{I_2}(g) \to HI(g){\rm{ }}{\Delta _{\rm{f}}}{\rm{H}}_{298}^0{\rm{ = }}26,48kJ/mol\) ở cùng điều kiện phản ứng, nếu thu được 3 mol HI thì lượng nhiệt cần thu vào là bao nhiêu kJ?
Đáp án : C Phương pháp giải :
Dựa vào enthalpy tạo thành chuẩn của phản ứng tạo thành HI Lời giải chi tiết :
Nếu thu được 3 mol HI thì lượng nhiệt cần thu là 26,48 . 3 = 79,44 kJ Đáp án C
Câu 18 :
Quá trình hòa tan calcium chloride trong nước: \(CaC{l_2}(s) \to C{a^{2 + }}(aq) + 2C{l^ - }(aq)\)
Biến thiên enthalpy của quá trình trên là:
Đáp án : D Phương pháp giải :
Dựa vào enthalpy tạo thành chuẩn của các chất Lời giải chi tiết :
\({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0(C{a^{2 + }}) + 2.{\Delta _f}H_{298}^0(C{l^ - }) - {\Delta _f}H_{298}^0(CaC{l_2})\) = -542,83 + 2.-167,16 – (-795,0) = -82,15 KJ Đáp án D
Câu 19 :
Cho biết năng lượng liên kết trong phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Tính biến thiên enthalpy chuẩn của phản ứng: \({N_2}(g) + {O_2}(g) \to 2NO(g)\)
Đáp án : C Phương pháp giải :
Dựa vào năng lượng liên kết trong các phân tử Lời giải chi tiết :
\(\Delta rH_{298}^0 = {E_{N2}} + {E_{O2}} - 2{E_{NO}} = {E_{N \equiv N}} + {E_{O = O}} - 2.{E_{N - O}}\)= 945 + 494 – 2.607 = 225 kj Đáp án C
Câu 20 :
Cho bảng năng lượng liên kết của các chất sau: Tính \({\Delta _r}H_{298}^0\)của phản ứng sau: \({F_2}(g) + {H_2}O(g) \to 2HF(g) + \frac{1}{2}{O_2}(g)\). Dự đoán các phản ứng trên là thuận lợi hay không thuận lợi.
Đáp án : D Phương pháp giải :
Dựa vào enthalpy tạo thành của các chất Lời giải chi tiết :
\({\Delta _r}H_{298}^0\)= \(2.{E_{H - F}} + \frac{1}{2}{E_{O = O}} - {E_{F - F}} + 2{{\rm{E}}_{O - H}}\)= 2. 565 + ½ . 498 – 159 – 2.464 = 292 kJ Phản ứng thu nhiệt và không thuận lợi Đáp án D
Câu 21 :
Cho phương trình phản ứng sau: \(2{H_2}(g) + {O_2}(g) \to 2{H_2}O(l){\rm{ }}\Delta {\rm{H = - 572kJ}}\). Khi cho 2g khí H2 tác dụng hoàn toàn với 32g khí O2 thì phản ứng
Đáp án : A Phương pháp giải :
Dựa vào số mol của H2 và O2 Lời giải chi tiết :
n H2 = 2:2 = 1 mol n O2 = 32 : 32 = 1 mol Theo phương trình phản ứng: n H2 hết, n O2 dư Nhiệt lượng tỏa ra là: ½ . 572 = 286 kJ Đáp án A
|














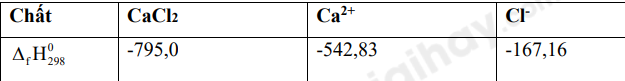









Danh sách bình luận