Lý thuyết Tính chất chung của kim loại - Khoa học tự nhiên 9 Chân trời sáng tạoKim loại có tính dẻo nên có thể rèn, kéo dài thành sợi hoặc dát mỏng. Quảng cáo
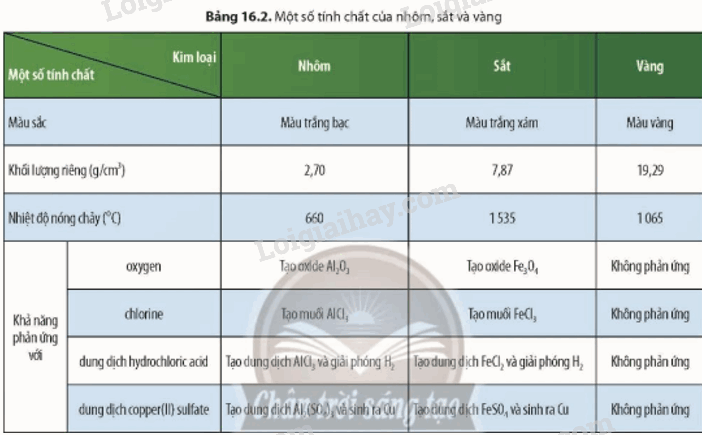
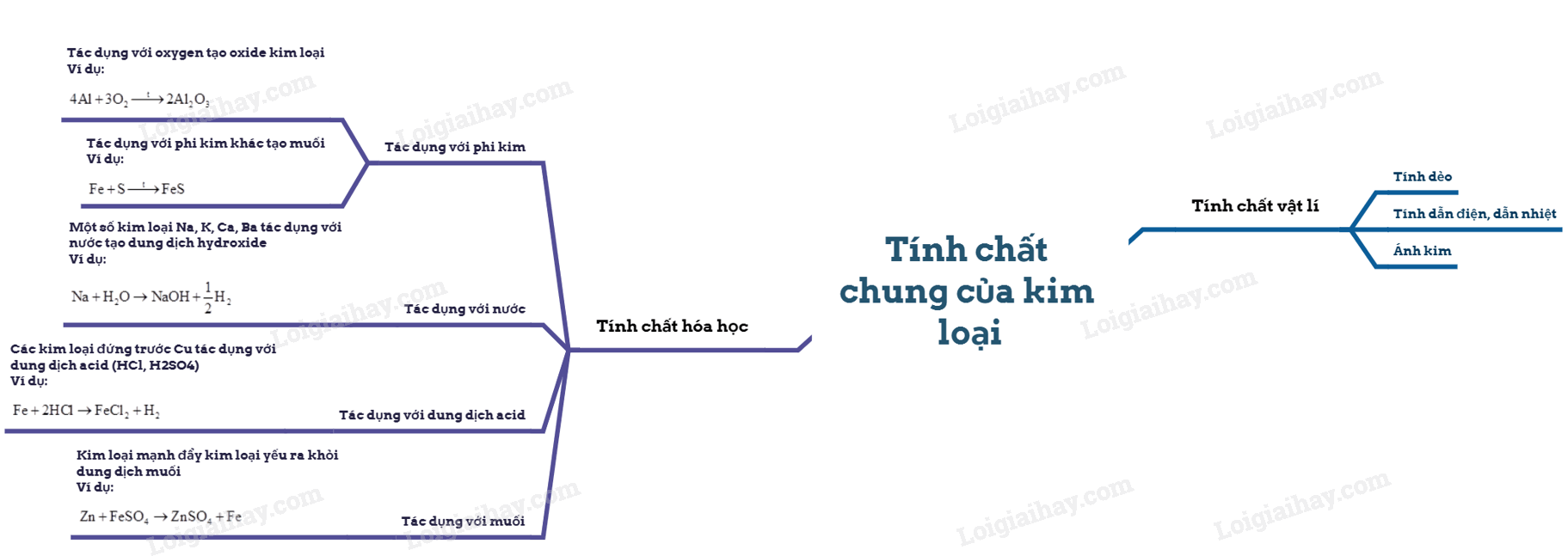
I. Tính chất vật lí của kim loại 1. Tính dẻo Kim loại có tính dẻo nên có thể rèn, kéo dài thành sợi hoặc dát mỏng. Những kim loại có tính dẻo cao là Au, Ag, Al, Cu, Fe. 2. Tính dẫn điện Các kim loại có khả năng dẫn điện khác nhau. Kim loại dẫn điện tốt nhất là Ag, Cu, Au, Al,… 3. Tính dẫn nhiệt Kim loại có tính dẫn nhiệt, các kim loại thường có khả năng dẫn nhiệt khác nhau. 4. Ánh kim Kim loại có tính ánh kim nên một số kim loại được dùng làm đồ trang sức và các vật dụng trang trí khác 5. Một số tính chất vật lí khác của kim loại Khối lượng riêng Nhiệt độ nóng chảy Tính cứng II. Tính chất hóa học 1. Phản ứng của kim loại với phi kim - Tác dụng với oxygen Nhiều kim loại khác như Ca, Fe, Cu,…có phản ứng với O2 tạo thành các oxide Ví dụ: - Tác dụng với phi kim khác Ở nhiệt độ cao, các kim loại Mg, Cu, Fe, Al,… có phản ứng với S, Cl2 cho sản phẩm là các muối sulfide, chlorua. Ví dụ: 2. Phản ứng của kim loại với dung dịch acid Nhiều kim loại phản ứng với các dung dịch acid (HCl, H2SO4 loãng,…) tạo thành muối và giải phóng khí H2 Ví dụ: 2Al + 6HCl \( \to \)2AlCl3 + 3H2 Một số kim loại như Cu, Ag, Au,… không tác dụng với dung dịch acid (HCl, H2SO4 loãng,…) 3. Phản ứng của kim loại với dung dịch muối Kim loại hoạt động hóa học mạnh (trừ các kim loại K, Na, Ca,…) có thể đẩy được kim loại có mức hoạt động hóa học yếu hơn ra khỏi dung dịch muối, tạo thành muối mới và kim loại mới Ví dụ: Fe + CuSO4 \( \to \) FeSO4 + Cu 4. Phản ứng với nước Một số kim loại như K, Na, Ca,… tác dụng được với nước ở nhiệt độ thường tạo thành hydroxide và khí H2 Ví dụ: 2Na + H2O \( \to \) 2NaOH + H2 III. Một số khác biệt về tính chất giữa các kim loại thông dụng Các kim loại khác nhau sẽ có một số tính chất riêng biệt. Bảng 16.2 dưới đây mô tả một vài sự khác biệt của ba kim loại thông dụng là nhôm, sắt và vàng. SƠ ĐỒ TƯ DUY |














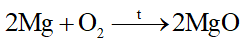
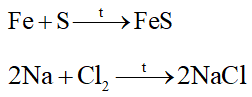






Danh sách bình luận