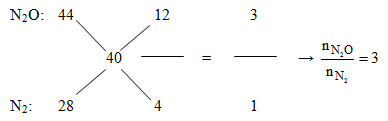Đề thi học kì 1 Hóa 11 - Đề số 2Đề bài
Câu 1 :
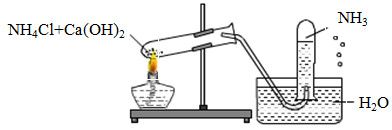
Một học sinh đã điều chế và thu khí NH3 theo sơ đồ sau đây, nhưng kết quả thí nghiệm không thành công. Lí do chính là:
Câu 2 :
Khí CO2 điều chế trong phòng TN thường lẫn khí HCl và hơi nước. Để loại bỏ HCl và hơi nước ra khỏi hỗn hợp, ta dùng
Câu 3 :
Photpho trắng được bảo quản bằng cách ngâm trong:
Câu 4 :
Các chất có cấu tạo và tính chất hóa học tương tự nhau, chúng chỉ hơn kém nhau một hay nhiều nhớm metylen (-CH2-) được gọi là
Câu 5 :
Nhóm nitơ gồm những nguyên tố nào ?
Câu 6 :
Trộn 20 ml dung dịch HCl 0,05M với 20 ml dung dịch H2SO4 0,075M. Nếu coi thể tích sau khi pha trộn bằng tổng thể tích của hai dung dịch đầu thì pH của dung dịch thu được là
Câu 7 :
Nước đóng vai trò gì trong quá trình điện li các chất tan trong nước?
Câu 8 :
Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong một dung dịch?
Câu 9 :
Hòa tan 14,2 gam Na2SO4 trong nước thu được dung dịch A chứa số mol ion \(SO_4^{2 - }\) là:
Câu 10 :
Trong phản ứng: $HSO_4^ - + {H_2}O \to SO_4^{2 - } + {H_3}{O^ + }$, H2O đóng vai trò là
Câu 11 :
Trong các loại phân bón hoá học sau loại nào là phân đạm ?
Câu 12 :
Trong các ion sau đây, ion nào tan trong nước cho môi trường trung tính?
Câu 13 :
HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường ngả sang màu vàng là do
Câu 14 :
Thành phần chính của khí than ướt là
Câu 15 :
Dãy sắp xếp các dung dịch loãng có nồng độ mol/l như nhau theo thứ tự pH tăng dần là
Câu 16 :
Kim cương, fuleren và than chì là các dạng:
Câu 17 :
Cho sơ đồ phản ứng : FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O Sau khi cân bằng, hệ số cân bằng của HNO3 trong phản ứng là :
Câu 18 :
Chất nào sau đây không dẫn điện được?
Câu 19 :
Cho 10 ml dung dịch hỗn hợp HCl 1M và H2SO4 0,5M. Thể tích dung dịch NaOH 1M cần để trung hòa dung dịch axit đã cho là
Câu 20 :
Hợp chất hữu cơ là hợp chất của nguyên tố
Câu 21 :
Phản ứng nào sau đây không phải là phản ứng trao đổi?
Câu 22 :
Dung dịch BaCl2 2M có nồng độ mol/l của anion là
Câu 23 :
Muốn pha chế 300 ml dung dịch NaOH có pH = 10 thì khối lượng NaOH cần dùng là
Câu 24 :
Sử dụng dung dịch Ba(OH)2 có thể phân biệt dãy dung dịch muối nào sau đây:
Câu 25 :
Cho sơ đồ phản ứng : Al + HNO3 → Al(NO3)3 + N2 + N2O + H2O Biết khi cân bằng tỉ lệ số mol giữa N2O và N2 là 3 : 2. Tỉ lệ mol nAl : nN2O : nN2 lần lượt là
Câu 26 :
Có 5 lọ mất nhãn đựng 5 chất bột màu trắng: NaCl, Na2CO3, Na2SO4, BaCO3, BaSO4. Chỉ dùng nước và khí CO2 thì có thể nhận được mấy chất
Câu 27 :
Đốt cháy hoàn toàn một hợp chất hữu cơ X cần 6,72 lít O2 (đktc). Sản phẩm cháy hấp thụ hết vào bình đựng dung dịch Ba(OH)2 thấy có 19,7 gam kết tủa xuất hiện và khối lượng dung dịch giảm 5,5 gam. Lọc bỏ kết tủa, đun nóng nước lọc lại thu được 9,85 gam kết tủa nữa. CTPT của X là:
Câu 28 :
Chất nào sau đây có đồng phân hình học?
Câu 29 :
Cho m gam hỗn hợp G gồm Mg và Al có tỉ lệ mol 4 : 5 vào dung dịch HNO3 20%. Sau khi các kim loại tan hết có 6,72 lít hỗn hợp X gồm NO, N2O, N2 bay ra (đktc) và được dung dịch T. Thêm một lượng O2 vừa đủ vào X, sau phản ứng được hỗn hợp khí Y. Dẫn Y từ từ qua dung dịch KOH dư, có 4,48 lít hỗn hợp khí Z đi ra (đktc). Tỉ khối của Z đối với H2 bằng 20. Nếu cho dung dịch NaOH vào dung dịch T thì lượng kết tủa lớn nhất thu được là (m + 39,1) gam. Biết HNO3 dùng dư 20% so với lượng cần thiết. Nồng độ phần trăm của Al(NO3)3 trong T gần nhất với
Câu 30 :
Trộn 3 dung dịch H2SO4 0,1M, HCl 0,2M; HNO3 0,3M với thể tích bằng nhau được dung dịch A. Cho 300 ml dung dịch A tác dụng với V ml dung dịch B chứa NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch C có pH = 1 và m gam kết tủa D. Giá trị của V và m là
Lời giải và đáp án
Câu 1 :
Một học sinh đã điều chế và thu khí NH3 theo sơ đồ sau đây, nhưng kết quả thí nghiệm không thành công. Lí do chính là:
Đáp án : B Phương pháp giải :
Dựa vào tính tan của NH3 Lời giải chi tiết :
NH3 tan nhiều trong nước nên ta không sử dụng phương pháp đẩy nước để thu khí.
Câu 2 :
Khí CO2 điều chế trong phòng TN thường lẫn khí HCl và hơi nước. Để loại bỏ HCl và hơi nước ra khỏi hỗn hợp, ta dùng
Đáp án : D Phương pháp giải :
Xem lại lí thuyết hợp chất cacbon Lời giải chi tiết :
A loại vì NaOH phản ứng với CO2 và HCl B loại vì Na2CO3 phản ứng với CO2 và HCl C loại vì H2SO4 đặc chỉ tách được nước, không tách được CO2và HCl. D đúng vì NaHCO3 chỉ phản ứng với HCl sinh ra khí CO2 và H2SO4 hút nước. NaHCO3 + HCl →NaCl + CO2 + H2O
Câu 3 :
Photpho trắng được bảo quản bằng cách ngâm trong:
Đáp án : D Lời giải chi tiết :
P trắng được bảo quản bằng cách ngâm trong nước
Câu 4 :
Các chất có cấu tạo và tính chất hóa học tương tự nhau, chúng chỉ hơn kém nhau một hay nhiều nhớm metylen (-CH2-) được gọi là
Đáp án : C Lời giải chi tiết :
Hiện tượng các chất có cấu tạo và tính chất hóa học tương tự nhau, chúng chỉ hơn kém nhau một hay nhiều nhóm (-CH2-) được gọi là hiện tượng đồng đẳng.
Câu 5 :
Nhóm nitơ gồm những nguyên tố nào ?
Đáp án : B Phương pháp giải :
Xem lại lí thuyết nitơ Lời giải chi tiết :
Nhóm nitơ gồm N, P, As, Sb, Bi.
Câu 6 :
Trộn 20 ml dung dịch HCl 0,05M với 20 ml dung dịch H2SO4 0,075M. Nếu coi thể tích sau khi pha trộn bằng tổng thể tích của hai dung dịch đầu thì pH của dung dịch thu được là
Đáp án : A Phương pháp giải :
Bước 1: Tính số mol H+ \({n_{{H^ + }}} = {n_{HCl}} + 2{n_{{H_2}S{O_4}}}\) Bước 2: Tính pH = -log(H+) \({\rm{[}}{H^ + }{\rm{]}} = \dfrac{{{n_{{H^ + }}}}}{{{V_{HCl}} + {V_{{H_2}S{O_4}}}}} \) Lời giải chi tiết :
\({n_{HCl}} = 0,02.0,05 = 0,001\,\,mol;{n_{{H_2}S{O_4}}} = 0,02.0,075 = 0,0015\,\,mol \to {n_{{H^ + }}} = {n_{HCl}} + 2{n_{{H_2}S{O_4}}} = 0,001 + 2.0,0015 = 0,004\,\,mol\) \( \to {\rm{[}}{H^ + }{\rm{]}} = \dfrac{{0,004}}{{0,02 + 0,02}} = 0,1\,\,M\) \( \to pH = - \log 0,1 = 1\)
Câu 7 :
Nước đóng vai trò gì trong quá trình điện li các chất tan trong nước?
Đáp án : C Lời giải chi tiết :
Trong phân tử H2O, liên kết O−H là liên kết cộng hóa trị có cực, cặp e chung lệch về phía oxi => oxi tích điện âm, ở H tích điện dương. Khi quá trình điện li xảy ra tương tác giữa các phân tử nước có cực và các ion chuyển động không ngừng làm cho các chất điện li dễ dàng tan trong nước => nước đóng vai trò dung môi phân cực.
Câu 8 :
Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong một dung dịch?
Đáp án : C Phương pháp giải :
Những chất không có phản ứng hóa học với nhau có thể cùng tồn tại trong một dung dịch. Lời giải chi tiết :
A loại vì có phản ứng 2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 + 3CO2↑ + 6NaCl B loại vì có phản ứng HNO3 + NaHCO3 → NaNO3 + H2O + CO2↑ C đúng D loại vì có phản ứng NaCl + AgNO3 → NaNO3 + AgCl↓
Câu 9 :
Hòa tan 14,2 gam Na2SO4 trong nước thu được dung dịch A chứa số mol ion \(SO_4^{2 - }\) là:
Đáp án : A Phương pháp giải :
Tính số mol Na2SO4 sau đó dựa vào phương trình điện ly tính được số mol \(SO_4^{2 - }\) Lời giải chi tiết :
\({n_{N{a_2}S{O_4}}} = \dfrac{{14,2}}{{142}} = 0,1\,\,mol\) \(N{a_2}S{O_4} \to 2N{a^ + } + SO_4^{2 - }\) Theo phương trình điện ly\( \to {n_{SO_4^{2 - }}} = {n_{N{a_2}S{O_4}}} = 0,1\,\,mol\)
Câu 10 :
Trong phản ứng: $HSO_4^ - + {H_2}O \to SO_4^{2 - } + {H_3}{O^ + }$, H2O đóng vai trò là
Đáp án : B Lời giải chi tiết :
H2O đóng vai trò là bazơ vì nhận proton của HSO4-
Câu 11 :
Trong các loại phân bón hoá học sau loại nào là phân đạm ?
Đáp án : D Lời giải chi tiết :
Phân đạm là phân chứa N => (NH2)2CO
Câu 12 :
Trong các ion sau đây, ion nào tan trong nước cho môi trường trung tính?
Đáp án : A Phương pháp giải :
Xem lại lí thuyết axit – bazơ – muối Lời giải chi tiết :
Ion tan trong nước cho môi trường trung tính là Na+
Câu 13 :
HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường ngả sang màu vàng là do
Đáp án : D Lời giải chi tiết :
HNO3 tinh khiết là chất lỏng không màu, nhưng dung dịch HNO3 để lâu thường ngả sang màu vàng là do dung dịch HNO3 bị phân hủy 1 phần tạo thành một lượng nhỏ NO2.
Câu 14 :
Thành phần chính của khí than ướt là
Đáp án : A Lời giải chi tiết :
Thành phần chính của khí than ướt là CO, CO2, H2, N2
Câu 15 :
Dãy sắp xếp các dung dịch loãng có nồng độ mol/l như nhau theo thứ tự pH tăng dần là
Đáp án : C Phương pháp giải :
pH tỉ lệ nghịch với nồng độ ion H+ và tỉ lệ thuận với nồng độ ion OH- => pH tăng dần khi tính axit giảm và tính bazơ tăng. Lời giải chi tiết :
pH tăng dần tức tính axit giảm dần và tính bazơ tăng dần +) Tính axit giảm dần khi nồng độ ion H+ trong dung dịch giảm dần => dd HF có tính axit yếu nhất và dd H2SO4 có tính axit mạnh nhất +) Dung dịch có pH cao nhất là dung dịch có tính bazơ => Na2CO3
Câu 16 :
Kim cương, fuleren và than chì là các dạng:
Đáp án : C Lời giải chi tiết :
Kim cương, fuleren và than chì là các dạng thù hình của cacbon
Câu 17 :
Cho sơ đồ phản ứng : FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O Sau khi cân bằng, hệ số cân bằng của HNO3 trong phản ứng là :
Đáp án : D Phương pháp giải :
+) Coi Fe và S trogn 1 chất có tổng số oxi hóa là 0 +) Xác định các nguyên tố có số oxi hóa thay đổi +) Viết quá trình cho - nhận e => xác định hệ số cân bằng Lời giải chi tiết :
Coi Fe và S ban đầu có trong chất có số oxi hóa là 0 $\begin{align}& {{\overset{0}{\mathop{FeS}}\,}_{2}}+\text{ }H\overset{+5}{\mathop{N}}\,{{O}_{3}}\xrightarrow{{}}\overset{+3}{\mathop{Fe}}\,{{\left( N{{O}_{3}} \right)}_{3}}+\text{ }{{H}_{2}}\overset{+6}{\mathop{S}}\,{{O}_{4}}+\text{ }\overset{+2}{\mathop{N}}\,O\text{ }+\text{ }{{H}_{2}}O \\ & \,\,1.|{{\overset{0}{\mathop{FeS}}\,}_{2}}\to \,\,\overset{+3}{\mathop{Fe}}\,\,\,+\,\,2\overset{+6}{\mathop{S}}\,\,\,+\,\,15e \\ & 5.|\overset{+5}{\mathop{N}}\,\,+\,\,3e\,\,\to \,\,\overset{+2}{\mathop{N}}\, \\ \end{align}$ => PTHH: FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O => hệ số của HNO3 là 8
Câu 18 :
Chất nào sau đây không dẫn điện được?
Đáp án : C Lời giải chi tiết :
Chất dẫn điện là các chất điện li được trong nước
Câu 19 :
Cho 10 ml dung dịch hỗn hợp HCl 1M và H2SO4 0,5M. Thể tích dung dịch NaOH 1M cần để trung hòa dung dịch axit đã cho là
Đáp án : C Phương pháp giải :
Tính \({n_{{H^ + }}} \to {n_{O{H^ - }}} \to {n_{NaOH}} \to V\) Lời giải chi tiết :
\({n_{HCl}} = 0,01.1 = 0,01\,\,mol;{n_{{H_2}S{O_4}}} = 0,01.0,5 = 0,005\,\,mol \to {n_{{H^ + }}} = {n_{HCl}} + 2{n_{{H_2}S{O_4}}} = 0,01 + 2.0,005 = 0,02\,\,mol\) PTHH: \({H^ + } + O{H^ - } \to {H_2}O\) Theo phương trình: \({n_{O{H^ - }}} = {n_{{H^ + }}} = 0,02\,\,mol\) \( \to {n_{NaOH}} = {n_{O{H^ - }}} = 0,02\,\,mol \to {V_{NaOH}} = \dfrac{{0,02}}{1} = 0,02\) lít = 20 ml
Câu 20 :
Hợp chất hữu cơ là hợp chất của nguyên tố
Đáp án : A Lời giải chi tiết :
Hợp chất hữu cơ là hợp chất của cacbon (trừ CO, CO2, HCN, muối cacbonat, muối xianua, muối cacbua…).
Câu 21 :
Phản ứng nào sau đây không phải là phản ứng trao đổi?
Đáp án : D Phương pháp giải :
Phản ứng trao đổi là phản ứng hóa học, trong đó các chất trao đổi cho nhau thành phần cấu tạo của nó mà không làm thay đổi số oxi hóa. Từ sự trao đổi này, tạo ra các sản phẩm mới. Lời giải chi tiết :
Phản ứng: 2FeCO3 + 4H2SO4 → Fe2(SO4)3 + SO2 + 2CO2+ 4H2O là phản ứng oxi hóa khử, không phải pư trao đổi, vì số oxi hóa của các nguyên tố trước và sau phản ứng thay đổi
Câu 22 :
Dung dịch BaCl2 2M có nồng độ mol/l của anion là
Đáp án : A Phương pháp giải :
Bảo toàn nguyên tố Lời giải chi tiết :
Theo định luật bảo toàn nguyên tố: \({n_{C{l^ - }}} = 2{n_{BaC{l_2}}}\) Mặt khác BaCl2 là chất điện li mạnh, phân li hoàn toàn thành các ion => [Cl-] = 2.CM dd BaCl2 = 4M
Câu 23 :
Muốn pha chế 300 ml dung dịch NaOH có pH = 10 thì khối lượng NaOH cần dùng là
Đáp án : A Phương pháp giải :
+) Từ pH => pOH = 14 - pH => [OH−] +) Tính số mol NaOH từ [OH−] Lời giải chi tiết :
pH=10 => pOH = 14 – pH => [OH−] = 10−4 M => nNaOH = 0,3. 10−4 = 3. 10−5 ( mol) => mNaOH = 3. 10−5 . 40 = 1,2.10−3 (g)
Câu 24 :
Sử dụng dung dịch Ba(OH)2 có thể phân biệt dãy dung dịch muối nào sau đây:
Đáp án : C Lời giải chi tiết :
Loại A vì không phân biệt được MgCl2 và Na2SO4 vì đều tạo kết tủa trắng Loại B vì không phân biệt được AlCl3 và ZnCl2 vì đều tạo kết tủa trắng rồi tan hết Loại D vì không phân biệt được NH4NO3 và NH4Cl vì đều tạo khí mùi khai
Câu 25 :
Cho sơ đồ phản ứng : Al + HNO3 → Al(NO3)3 + N2 + N2O + H2O Biết khi cân bằng tỉ lệ số mol giữa N2O và N2 là 3 : 2. Tỉ lệ mol nAl : nN2O : nN2 lần lượt là
Đáp án : D Phương pháp giải :
Xem lại lí thuyết cân bằng phản ứng Lời giải chi tiết :
$\begin{align}& \overset{0}{\mathop{Al\text{ }}}\,+\text{ }H\overset{+5}{\mathop{N}}\,{{O}_{3}}\xrightarrow{{}}\overset{+3}{\mathop{Al}}\,{{\left( N{{O}_{3}} \right)}_{3}}+\text{ }{{\overset{0}{\mathop{N}}\,}_{2}}+\text{ }{{\overset{+1}{\mathop{N}}\,}_{2}}O\text{ }+\text{ }{{H}_{2}}O \\ & 44.|\overset{0}{\mathop{Al}}\,\,\,\to \,\,\overset{+3}{\mathop{Al}}\,\,\,+\,3e \\ &3.|10\overset{+5}{\mathop{N}}\,\,\,+\,44e\,\,\to \,\,{{\overset{+1}{\mathop{3N}}\,}_{2}}O\,\,+\,\,2{{\overset{0}{\mathop{N}}\,}_{2}} \\ \end{align}$ => PTHH: 44Al + 162HNO3 → 44Al(NO3)3 + 6N2 + 9N2O + 81H2O
Câu 26 :
Có 5 lọ mất nhãn đựng 5 chất bột màu trắng: NaCl, Na2CO3, Na2SO4, BaCO3, BaSO4. Chỉ dùng nước và khí CO2 thì có thể nhận được mấy chất
Đáp án : D Lời giải chi tiết :
Vậy dùng nước và CO2 ta có thể nhận biết được cả 5 dung dịch
Câu 27 :
Đốt cháy hoàn toàn một hợp chất hữu cơ X cần 6,72 lít O2 (đktc). Sản phẩm cháy hấp thụ hết vào bình đựng dung dịch Ba(OH)2 thấy có 19,7 gam kết tủa xuất hiện và khối lượng dung dịch giảm 5,5 gam. Lọc bỏ kết tủa, đun nóng nước lọc lại thu được 9,85 gam kết tủa nữa. CTPT của X là:
Đáp án : B Phương pháp giải :
Bước 1: Tính số mol CO2 - Do đun nóng nước lọc lại thu được thêm kết tủa nên nước lọc có chứa Ba(HCO3)2. CO2 + Ba(OH)2 → BaCO3 + H2O (1) 2CO2 + Ba(OH)2 → Ba(HCO3)2 (2) Ba(HCO3)2 \(\xrightarrow{{{t^o}}}\) BaCO3 + CO2 + H2O (3) => nCO2 = nBaCO3(1) + 2nBa(HCO3)2 (2) = nBaCO3(1) + 2nBaCO3(3) Bước 2: Tính số mol H2O \({m_{dd\,giam}} = {m_{BaC{{\rm{O}}_3}(1)}} - ({m_{C{O_2}}} + {m_{{H_2}O}})\) Bước 3: Xác định CTĐGN của X - Từ số mol CO2 và H2O tính được số mol C và H trong X - Bảo toàn nguyên tố O tính được số mol O trong X (dùng bảo toàn O) - Lập tỉ lệ nC : nH : nO ⟹ CTĐGN của X. Bước 4: Biện luận tìm CTPT của X - Trong hợp chất hữu cơ chứa C, H, O ta luôn có: 0 < H ≤ 2C + 2 ⟹ Giá trị của n. - Kết luận CTPT của X. Lời giải chi tiết :
Bước 1: Tính số mol CO2 Do đun nóng nước lọc lại thu được thêm kết tủa nên nước lọc có chứa Ba(HCO3)2. CO2 + Ba(OH)2 → BaCO3 + H2O (1) 2CO2 + Ba(OH)2 → Ba(HCO3)2 (2) Ba(HCO3)2 \(\xrightarrow{{{t^o}}}\) BaCO3 + CO2 + H2O (3) - Ta có: \({n_{{O_2}}} = \dfrac{{6,72}}{{22,4}} = 0,3(mol)\); \({n_{BaC{{\rm{O}}_3}(1)}} = \dfrac{{19,7}}{{197}} = 0,1(mol)\); \({n_{BaC{{\rm{O}}_3}(3)}} = \dfrac{{9,85}}{{197}} = 0,05(mol)\) - Ta có nCO2 = nBaCO3(1) + 2nBa(HCO3)2 (2) = nBaCO3(1) + 2nBaCO3(3) = 0,2(mol) Bước 2: Tính số mol H2O \({m_{dd\,giam}} = {m_{BaC{{\rm{O}}_3}(1)}} - ({m_{C{O_2}}} + {m_{{H_2}O}})\) \( \Leftrightarrow 5,5 = 19,7 - (44.0,2 + {m_{{H_2}O}}) \Rightarrow {m_{{H_2}O}} = 5,4(g)\) \( \Rightarrow {n_{{H_2}O}} = \dfrac{{5,4}}{{18}} = 0,3(mol)\) Bước 3: Xác định CTĐGN của X - Bảo toàn nguyên tố C, H ta có: \({n_C} = {n_{C{O_2}}} = 0,2(mol)\) \({n_H} = 2{n_{{H_2}O}} = 2.0,3 = 0,6(mol)\) - Bảo toàn nguyên tố O ta có: \({n_{O(X)}} + 2{n_{{O_2}}} = 2{n_{C{O_2}}} + {n_{{H_2}O}}\) ⟹ nO(X) + 2.0,3 = 2.0,2 + 0,3 ⟹ nO(X) = 0,1 mol. - Gọi CTPT của X là CxHyOz ⟹ x : y : z = nC : nH : nO = 0,2 : 0,6 : 0,1 = 2 : 6 : 1 ⟹ CTĐGN là C2H6O Bước 4: Biện luận tìm CTPT của X CTPT của X có dạng (C2H6O)n hay C2nH6nOn Trong hợp chất hữu cơ chứa C, H, O ta luôn có: 0 < H ≤ 2C + 2 ⟹ 0 < 6n ≤ 2.2n + 2 ⟹ 0 < n ≤ 1 ⟹ n = 1 Vậy công thức phân tử của X là C2H6O.
Câu 28 :
Chất nào sau đây có đồng phân hình học?
Đáp án : B Lời giải chi tiết :
2-clopropen: CH2=CCl-CH3 => không có đồng phân hình học but-2-en: CH3-CH=CH-CH3 => có đồng phân hình học 1,2-đicloetan: CHCl2-CHCl2 => không có đồng phân hình học But-2-in: CH≡C-CH-CH3 => không có đphh
Câu 29 :
Cho m gam hỗn hợp G gồm Mg và Al có tỉ lệ mol 4 : 5 vào dung dịch HNO3 20%. Sau khi các kim loại tan hết có 6,72 lít hỗn hợp X gồm NO, N2O, N2 bay ra (đktc) và được dung dịch T. Thêm một lượng O2 vừa đủ vào X, sau phản ứng được hỗn hợp khí Y. Dẫn Y từ từ qua dung dịch KOH dư, có 4,48 lít hỗn hợp khí Z đi ra (đktc). Tỉ khối của Z đối với H2 bằng 20. Nếu cho dung dịch NaOH vào dung dịch T thì lượng kết tủa lớn nhất thu được là (m + 39,1) gam. Biết HNO3 dùng dư 20% so với lượng cần thiết. Nồng độ phần trăm của Al(NO3)3 trong T gần nhất với
Đáp án : D Lời giải chi tiết :
Khi thêm O2 vừa đủ vào Y thu được các khí NO2, N2O, N2. Dẫn qua dung dịch KOH dư thì NO2 bị hấp thụ khí còn lại là N2O và N2. => nNO = nNO2 = 0,3 – 0,2 = 0,1 mol Áp dụng đường chéo cho hỗn hợp Z:
Mà nN2O + nN2 = nZ = 0,2 mol => nN2O = 0,15 và nN2 = 0,05 Đặt: nMg = 4x và nAl = 5x (mol) => nMg(OH)2 = 4x và mAl(OH)3 = 5x m kết tủa max = mKL + mOH- => m + 39,1 = m + 17(4x.2 + 5x.3) => x = 0,1 => nMg = 0,4 mol và nAl = 0,5 mol Ta thấy: 2nMg + 3nAl > 3nNO + 8nN2O + 10nN2 => Có tạo muối NH4NO3 Bảo toàn e: 2nMg + 3nAl = 3nNO + 8nN2O + 10nN2 + 8nNH4NO3 => 2.0,4 + 3.0,5 = 3.0,1 + 8.0,15 + 10.0,05 + 8nNH4NO3 => nNH4NO3 = 0,0375 mol Công thức tính nhanh: nHNO3 pư = 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 = 2,875 mol => nHNO3 bđ = 2,875 + 2,875.(20/100) = 3,45 mol => m dd HNO3 = 3,45.63.(100/20) = 1086,75 gam m dd sau pư = mMg + mAl + m dd HNO3 – mNO – mN2O – mN2 = 0,4.24 + 0,5.27 + 1086,75 – 0,1.30 – 0,15.44 – 0,05.28 = 1098,85 gam Ta có: nAl(NO3)3 = nAl = 0,5 mol → %mAl = (0,5.213/1098,85).100% = 9,69% gần nhất với 9,7%
Câu 30 :
Trộn 3 dung dịch H2SO4 0,1M, HCl 0,2M; HNO3 0,3M với thể tích bằng nhau được dung dịch A. Cho 300 ml dung dịch A tác dụng với V ml dung dịch B chứa NaOH 0,2M và Ba(OH)2 0,1M thu được dung dịch C có pH = 1 và m gam kết tủa D. Giá trị của V và m là
Đáp án : B Phương pháp giải :
+) Vì trộn 3 dung dịch với thể tích bằng nhau => để thu được 300 ml dung dịch A thì mỗi dd axit cần lấy 100 ml +) Dung dịch C có pH = 1 => H+ dư sau phản ứng => [H+]dư +) nH+ - nOH- = nH+ dư +) Từ số mol Ba(OH)2 tính số mol BaSO4 Lời giải chi tiết :
Vì trộn 3 dung dịch với thể tích bằng nhau => để thu được 300 ml dung dịch A thì mỗi dd axit cần lấy 100 ml => nH+ trước phản ứng =2nH2SO4+ n HCl +nHNO3 =0,1.2.0,1 + 0,1.0,2 + 0,1.0,3 = 0,07 mol nOH- trước phản ứng =nNaOH +2.nBa(OH)2 =0,2V + 2.0,1V = 0,4V mol Dung dịch C có pH = 1 => H+ dư sau phản ứng => [H+]dư = 0,1 M H+ + OH- →H2O 0,4V $ \leftarrow $0,4V \( \to {{\text{[}}{H^ + }{\text{]}}_{du}} = \dfrac{{0,07 - 0,4V}}{{0,3 + V}} = 0,1 \to V = 0,08(lít) = 80ml\) => nBa(OH)2 = 0,1.0,08 = 0,008 mol nH2SO4 = 0,1.0,1 = 0,01 mol Ba(OH)2 + H2SO4 → BaSO4 + 2H2O 0,008 → 0,008 → 0,008 => mBaSO4 = 0,008.233 = 1,864 gam |