Đề số 10 - Đề kiểm tra học kì 1 - Hóa học 11Đáp án và lời giải chi tiết Đề số 10 - Đề kiểm tra học kì 1 (Đề thi học kì 1) - Hóa học 11 Quảng cáo
Đề bài Câu 1 (2 điểm): Hoàn thành sơ đồ chuỗi phản ứng sau (ghi rõ điều kiện phản ứng, nếu có)
Câu 2 (2 điểm): Bằng phương pháp hóa học hãy phân biệt các dung dịch đựng trong lọ mất nhãn sau. Na2SiO3, BaCl2, K3PO4, Na2CO3, NaNO3 Viết phương trình hóa học các phản ứng minh họa. Câu 3 (1 điểm): Viết phương trình hóa học các phản ứng: a. Chứng minh cacbon vừa có tính khử, vừa có tính oxi hóa. b. Chứng minh Al(OH)3 có tính lưỡng tính. Câu 4 (1 điểm): Nêu hiện tượng, viết phương trình phản ứng minh họa a. Cho từ từ dung dịch H2SO4 đến dư vào dung dịch Ba(HCO3)2. b. Cho dung dịch NaOH vào dung dịch Ca(HCO3)2. Câu 5 (2 điểm): Nicotin là một hợp chất hóa học có trong thuốc lá, đó là chất gây nghiện tương tự như heroin hay cocain. Đốt cháy hoàn toàn 8,1 gam nicotin bằng oxi (dư) thì thu được 11,2 lít CO2, 6,3 gam H2O và 1,12 lít N2. Các thể tích khí đo ở điều kiện tiêu chuẩn. a. Lập công thức đơn giản nhất của nicotin. b. Xác định công thức phân tử của nicotin. Tính khối lượng phân tử. Biết nicotin có công thức cấu tạo như hình bên cạnh. Câu 6 (2 điểm): Hòa tan hết 4,38 gam hỗn hợp X gồm Cu và Al trong dung dịch HNO3 loãng, dư thu được 1,344 lít khí NO (sản phẩm khử duy nhất, đktc). a. Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp ban đầu. b. Thay Cu (giữ nguyên lượng khối lượng hỗn hợp X) bằng Mg thì thu được hỗn hợp Y. Cho Y tác dụng hết với dung dịch HNO3 loãng, dư thì thu được dung dịch Z chứa m gam muối và 0,896 lít N2O (đktc). Tính m Lời giải chi tiết Câu 1:
Câu 2:
PTHH: Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓ keo Na2CO3 + 2HCl → 2NaCl + CO2 + H2O BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl↓ trắng K3PO4 + 3AgNO3 → 3KNO3 + Ag3PO4↓ vàng Câu 3: a. PTHH chứng minh C vừa có tính khử và tính oxi hóa: Tính khử: C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O Tính oxi hóa: 2C + Ca \(\xrightarrow{{{t^o}}}\) CaC2 b. PTHH chứng minh Al(OH)3 có tính lưỡng tính: Al(OH)3 + 3HCl → AlCl3 + 3H2O Al(OH)3 + NaOH → NaAlO2 + 2H2O Câu 4: a. Cho từ từ dung dịch H2SO4 đến dư vào dung dịch Ba(HCO3)2. - Hiện tượng: Xuất hiện kết tủa trắng không tan trong axit dư và có sủi bọt khí không màu. - PTHH: H2SO4 + Ba(HCO3)2 → BaSO4↓ + 2CO2↑ + 2H2O b. Cho dung dịch NaOH vào dung dịch Ca(HCO3)2. - Hiện tượng: Xuất hiện kết tủa trắng - PTHH: 2NaOH + Ca(HCO3)2 → CaCO3↓ + Na2CO3 + 2H2O Câu 5: a. Đốt cháy nicotin thu được CO2, H2O và N2 => Nicotin có chứa C, H, N và có thể có O. BTNT “C”: nC = nCO2 = 0,5 mol BTNT “H”: nH = 2nH2O = 0,7 mol BTNT “N”: nN = 2nN2 = 0,1 mol BTKL: mO = mHCHC – mC – mH – mN = 8,1 – 0,5.12 – 0,7.1 – 0,1.14 = 0 gam => Nicotin không chứa O Ta có: C : H : N = 0,5 : 0,7 : 0,1 = 5 : 7 : 1 Vậy công thức đơn giản nhất của nicotin là C5H7N b. Công thức phân tử của nicotin có dạng (C5H7N)n Từ công thức cấu tạo ta thấy phân tử nicotin chứa 2 nguyên tử N => n = 2 Vậy công thức phân tử của nicotin là C10H14N2 Phân tử khối của nicotin là: 12.10 + 14.1 + 14.2 = 162 đvC Câu 6: nNO = 1,344 : 22,4 = 0,06 mol a. Đặt số mol của Cu và Al lần lượt là x và y (mol) - Khối lượng hỗn hợp: 64x + 27y = 4,38 (1) - Áp dụng định luật bảo toàn e: 2nCu + 3nAl = 3nNO => 2x + 3y = 3.0,06 (2) Giải (1) và (2) thu được: x = 0,06 và y = 0,02 \( \to \left\{ \begin{gathered} b. Do giữ nguyên khối lượng của hỗn hợp và Al nên ta có: mMg = mCu = 3,84 gam => nMg = 3,84 : 24 = 0,16 mol Nhận thấy: 2nMg + 3nAl (= 0,38 mol) > 8nN2O (= 0,32 mol) Vậy sản phẩm khử còn có chứa NH4+ Áp dụng định luật bảo toàn e ta có: 2nMg + 3nAl = 8nN2O + 8nNH4+ => 0,16.2 + 0,02.3 = 0,04.8 + 8.nNH4+ => nNH4+ = 0,0075 mol Vậy dung dịch muối Z gồm có: Mg2+ (0,16 mol); Al3+ (0,02 mol); NH4+ (0,0075 mol) và NO3- Áp dụng định luật bảo toàn điện tích cho dung dịch Z: nNO3- = 2nMg2+ + 3nAl3+ + nNH4+ = 2.0,16 + 3.0,02 + 0,0075 = 0,3875 mol Khối lượng muối trong dung dịch Z là: m = mMg2+ + mAl3+ + mNH4+ + mNO3- = 0,16.24 + 0,02.27 + 0,0075.18 + 0,3875.62 = 28,54 gam Xem lời giải chi tiết đề thi học kì 1 tại Tuyensinh247.com Loigiaihay.com
|














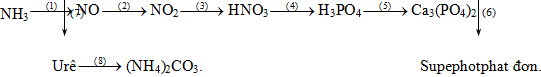







Danh sách bình luận