Đề số 12 - Đề kiểm tra học kì 1 - Hóa học 11Đáp án và lời giải chi tiết Đề số 12 - Đề kiểm tra học kì 1 (Đề thi học kì 1) - Hóa học 11 Quảng cáo
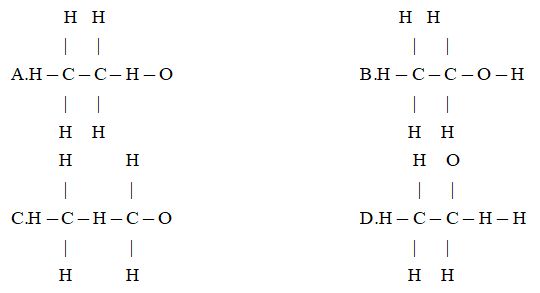
Đề bài I. PHẦN TRẮC NGHIỆM Câu 1. Trong ống nghiệm chứa 4 dung dịch trong suốt mỗi dung dịch chỉ chứa một loại cation và một anion. Các loại ion trong cả 4 dung dịch gồm: \(N{a^ + };B{a^{2 + }};P{b^{2 + }};SO_4^{2 - };C{l^ - };CO_3^{2 - };NO_3^ - .\) Bốn ống nghiệm đó đựng 4 dung dịch nào sau đây? \(\begin{array}{l}A.PbC{l_2};Ca{\left( {N{O_3}} \right)_2};BaC{O_3};N{a_2}S{O_4}\\B.N{a_2}C{O_3};CaS{O_4};Pb{\left( {N{O_3}} \right)_2};BaC{l_2}\\C.CaC{O_3};Pb{\left( {N{O_3}} \right)_2};NaCl;BaS{O_4}\\D.Pb{\left( {N{O_3}} \right)_2};CaC{l_2};BaS{O_4};N{a_2}C{O_3}\end{array}\) Câu 2. Dung dịch nước của chất nào sau đây có pH > 7? A.NH4Cl B.KNO3 C.K3PO4 D.(NH4)2SO4 Câu 3. Cho a mol CO2 vào dung dịch chứa 2a mol KOH thu được dung dịch (X). Cho (X) vào dung dịch Al(NO3)3 thì có hiện tượng nào sau đây? A.Chỉ có khí không màu bay ra. B.Vừa có khí không màu bay ra vừa có kết tủa trắng. C.Ban đầu có kết ít, sau đó kết tủa nhiều dần rồi tan ra. D.Lúc đầu khí bay ra ít, sau đó nhiều hơn, đồng thời kết tủa màu xanh xuất hiện rồi tan hết. Câu 4. Cho 19,2 gam một kim loại R tác dụng hết với dung dịch HNO3 thu được 4,48 lít NO (đktc). Tên kim loại đem dùng là: A.Đồng B.Sắt C.Kẽm D.Bari Câu 5. Cho 6 gam P2O5 vào 150ml dung dịch H3PO4 6% (D = 103 g/ml). Nồng độ phần trăm của dung dịch H3PO4 thu được là: A.\( \approx \) 40%. B. \( \approx \) 41% C. \( \approx \) 42% D.\( \approx \) 43% Câu 6. Nếu trộn 5 lít khí N2 với 4 lít khí H2 trong bình kín ở nhiệt độ cao \(\left( {450^\circ C.Fe} \right)\). Sau khi phản ứng kết thúc thu được 7,8 lít hỗn hợp, biết các khí đo ở cùng điều kiện. Thể tích khí NH3 tạo thành là: A.1,2 lít B.0,8 lít C.1,5 lít D.0,4 lít Câu 7. Thổi khí CO qua ống sứ đựng a gam hỗn hợp gồm Al2O3, MgO, Fe2O3, FeO và CuO nung nóng. Dẫn khí thoát ra vào nước vôi trong dư thu được 15 gam kết tủa và chất rắn sau phản ứng là 200 gam. Giá trị của a là: A.197,6 gam B.210,8 gam C.202,4 gam D.189,2 gam Câu 8. Hòa tan 28,1 gam hỗn hợp gồm MgCO3 và BaCO3 có thành phần phần trăm theo khối lượng thay đổi (trong đó chứa a% MgCO3) vào dung dịch HCl dư thu được khí (X). Dẫn hết khí (X) vào 100ml dung dịch Ca(OH)2 2M thu được kết tủa (Y). Giá trị của a là bao nhiêu để kết tủa (Y) đạt giá trị lớn nhất? A.30 B.45 C.50 D.100 Câu 9. Cho 7 gam hỗn hợp hai muối cacbonat của kim loại hóa trị II tác dụng với dung dịch HCl, thu được V lít khí CO2 (đktc) và dung dịch (X). Cô cạn dung dịch (X) thu được 9,2 gam muối khan. Giá trị của V là: A.2,24 lít B.3,36 lít C.4,48 lít D.6,72 lít Câu 10. Khối lượng riêng của một chất hữu cơ (X) ở thể khí (đktc) là 2,5 g/l. Phân tử khối của (X) là: A.30 u B.42 u C.56 u D.70 u Câu 11. Công thức cấu tạo nào sau đây ứng với công thức phân tử là C2H6O?
Câu 12. Để xác định phân tử khối của các chất khó bay hơi hoặc không bay hơi, người ta sử dụng phương pháp nào sau đây? A.Phương pháp nghiệm lạnh. B.Phương pháp nghiệm sôi. C.Dựa vào tỉ khối hơi của oxi và nitơ. D.Kết hợp cả A và B. II. PHẦN TỰ LUẬN Câu 13. Hãy xác định khối lượng anhiđrit axetic cần hòa tan trong 949 gam nước để điều chế được dung dịch axit axetic 6%. Câu 14. Cần bao nhiêu lít N2 và H2 (đktc) để điều chế được 102 gam NH3. Biết hiệu suất phản ứng là 20%. Câu 15. Một hiđrocacbon Y mạch hở, ở thể khí, khối lượng của V lít khí này bằng 2 lần khối lượng của V lít N2 đo ở cùng điều kiện nhiệt độ và áp suất. Xác định công thức phân tử của hiđrocacbon Y đem dùng. Câu 16. Cho 5,04 lít khí CO2 (đktc) hấp thụ hoàn toàn bởi 270ml dung dịch NaOH 1M. Dung dịch thu được chứa muối nào và bao nhiêu mol? Lời giải chi tiết I. PHẦN TRẮC NGHIỆM
II. PHẦN TỰ LUẬN Câu 13. Gọi x là khối lượng CH3COOH thu được sau phản ứng \(\begin{array}{l} \Rightarrow {n_{C{H_3}COOH}} = \dfrac{x}{{60}}\left( {mol} \right);\\{m_{{\rm{dd}}}} = \dfrac{{x \times 100}}{6} = 16,667x\left( {gam} \right)\\{\rm{ }}{\left( {C{H_3}CO} \right)_2}O + {H_2}O \to 2C{H_3}COOH{\rm{ }}\left( 1 \right)\\{\rm{ }}\dfrac{x}{{120}}{\rm{ \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, }} \leftarrow {\rm{ }}\dfrac{x}{{60}}{\rm{ }}\left( {mol} \right)\end{array}\) Mà \({m_{{\rm{dd}}}} = {m_{{{\left( {C{H_3}CO} \right)}_2}O}} + {m_{{H_2}O}}\) \(\begin{array}{l} \Leftrightarrow 16,667x = \dfrac{{102x}}{{120}} + 949\\ \Leftrightarrow 2000x = 102x + 113880 \Rightarrow x = 60\end{array}\) Từ (1) \( \Rightarrow {n_{{{\left( {C{H_3}CO} \right)}_2}O}} = \dfrac{x}{{120}} = \dfrac{{60}}{{120}} = 0,5\left( {mol} \right)\) \({m_{{{\left( {C{H_3}CO} \right)}_2}O}}\)đem dùng \( = 0,5 \times 102 = 51\left( {gam} \right)\) Câu 14. Cách 1. Ta có: \({n_{N{H_3}}} = \dfrac{{102}}{{17}} = 6\left( {mol} \right)\) Phản ứng: \(\begin{array}{l}{N_2} + 3{H_2} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2N{H_3}{\rm{ }}\left( 1 \right)\\{\rm{ 3 \,\,\,\,\,\,\,\,\,\,\,\, 9 }} \leftarrow {\rm{ \,\,\,\,\,\,\,\,\,\,\,\,\,\, 6 }}\left( {mol} \right)\end{array}\) Từ (1) \( \Rightarrow {n_{{N_2}}} = 3\left( {mol} \right)\) \(\Rightarrow {V_{{N_2}}} = 3 \times 22,4 = 67,2\) (lít) và \({n_{{H_2}}} = 9\left( {mol} \right)\) \(\Rightarrow {V_{{H_2}}} = 9 \times 22,4 = 201,6\) (lít) Vì hiệu suất H = 20% nên lượng N2 và H2 thực tế đem dùng là: \({V_{{N_2}}}\)cần dùng = \(67,2 \times \dfrac{{100}}{{20}} = 336\) (lít) \({V_{{H_2}}}\)cần dùng = \(201,6 \times \dfrac{{100}}{{20}} = 1008\) (lít). Cách 2.
Từ (1) suy ra thể tích H2 tham gia phản ứng là: \(x = \dfrac{{3 \times 22,4 \times 102}}{{2 \times 17}} = 201,6\) (lít) Và thể tích N2 phản ứng là: \(y = \dfrac{{22,4 \times 102}}{{34}} = 67,2\) (lít) Vì H = 20% nên: \({V_{{N_2}}}\)cần dùng = \(67,2 \times \dfrac{{100}}{{20}} = 336\) (lít) \({V_{{H_2}}}\)cần dùng = \(201,6 \times \dfrac{{100}}{{20}} = 1008\) (lít). Câu 15. Theo đề bài, ta có: \({M_Y} = 2{M_{{N_2}}} = 2 \times 28 = 56\left( u \right)\) Gọi công thức tổng quát của hiđrocacbon: CxHy \( \Rightarrow {M_Y} = 12x + y = 56\) \( \Rightarrow \) nghiệm hợp lí: \(\left\{ \begin{array}{l}x = 4\\y = 8\end{array} \right.\). Câu 16. Ta có: \({n_{C{O_2}}} = \dfrac{{5,04}}{{22,4}} = 0,225 = \left( {mol} \right)\) Và \({n_{NaOH}} = 0,27 \times 1 = 0,27\left( {mol} \right)\) Lập tỉ số: \(1 < \dfrac{{{n_{NaOH}}}}{{{n_{C{O_2}}}}} = \dfrac{{0,27}}{{0,225}} = 1,2 < 2\) \( \Rightarrow \) Tạo 2 muối: NaHCO3 và Na2CO3 \(\begin{array}{l}C{O_2} + 2NaOH \to N{a_2}C{O_3} + {H_2}O\\{\rm{ x }} \to {\rm{ \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, 2x \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, x }}\left( {mol} \right)\\C{O_2} + NaOH \to NaHC{O_3}\\{\rm{ y }} \to {\rm{ \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, y \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, y }}\left( {mol} \right)\end{array}\) Theo đề bài, ta có hệ phương trình: \(\left\{ \begin{array}{l}{n_{C{O_2}}} = x + y = 0,225\\{n_{NaOH}} = 2x + y = 0,27\end{array} \right. \) \(\Rightarrow \left\{ \begin{array}{l}x = 0,045\\y = 0,18\end{array} \right.\) Loigiaihay.com
|














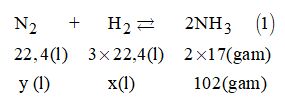






Danh sách bình luận