Đề số 5 - Đề kiểm tra học kì 1 - Hóa học 11Đáp án và lời giải chi tiết Đề số 5 - Đề kiểm tra học kì 1 (Đề thi học kì 1) - Hóa học 11 Quảng cáo
Đề bài I. PHẦN TRẮC NGHIỆM (2,0 điểm) Câu 1: Dung dịch nào sau đây không tác dụng với dung dịch HCl loãng? A. KNO3. B. AgNO3. C. NaOH. D. Na2CO3. Câu 2: Khí NH3 làm quì tím ẩm chuyển sang màu A. xanh. B. đỏ. C. hồng. D. tím. Câu 3: Cho hỗn hợp gồm 0,1 mol CuO và 0,1 mol Cu tác dụng với dung dịch HNO3 đặc nóng, dư thu được V lít khí NO2 (đktc). Giá trị của V là A. 3,36. B. 2,24. C. 4,48. D. 6,72. Câu 4: Trong các cặp chất cho dưới đây, cặp nào không xảy ra phản ứng với nhau? A. HCl, Fe(OH)3. B. KOH, CaCO3. C. CuCl2, AgNO3. D. K2SO4, Ba(NO3)2. Câu 5: Dung dịch nào sau đây có pH = 7? A. NaOH. B. H2SO4. C. NaCl. D. HCl. Câu 6: Chất nào sau đây lưỡng tính? A. Fe(OH)3. B. Mg(OH)2. C. NaCl. D. Al(OH)3. Câu 7: Để phân biệt dung dịch Na3PO4 và dung dịch NaNO3 nên dùng thuốc thử nào sau đây? A. Dung dịch HCl. B. Dung dịch KOH. C. Dung dịch AgNO3. D. Dung dịch H2SO4. Câu 8: Cho muối NH4Cl tác dụng vừa đủ với 100 ml dung dịch NaOH đun nóng thì thu được 5,6 lít (đktc) một chất khí. Nồng độ mol/l của dung dịch NaOH đã dùng là A. 3,0M. B. 1,0M. C. 2,0M. D. 2,5M. II. PHẦN TỰ LUẬN (8,0 điểm) Câu 9 (2,0 điểm): Cho 100 ml dung dịch HNO3 1,0 M (dung dịch A) vào 100 ml dung dịch KOH 1,0M (dung dịch B). a) Viết phương trình điện li của HNO3; KOH. b) Tính pH của dung dịch A và dung dịch B. c) Tính pH khi trộn lẫn dung dịch A và dung dịch B. Câu 10 (2,0 điểm): Thực hiện dãy chuyển hoá sau và ghi rõ điều kiện phản ứng nếu có.
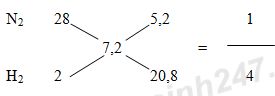
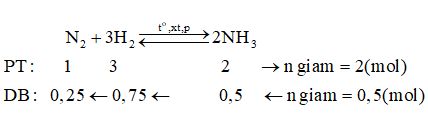
Câu 11 (2,0 điểm): a) Vào mùa lạnh người ta thường sử dụng than để sưởi ấm, tuy nhiên có nhiều trường hợp bị ngộ độc dẫn đến tử vong. Chất nào gây nên sự ngộ độc trên? Viết phương trình hóa học tạo thành chất đó trong quá trình sử dụng than để sưởi ấm. Nêu biện pháp tránh bị ngộ độc khi sử dụng than để sưởi ấm. b) Cho 0,56 lít CO2 (đktc) hấp thụ hoàn toàn vào 400 ml dung dịch Ca(OH)2 0,05M. Tính khối lượng kết tủa thu được. Câu 12 (2,0 điểm): Cho hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X môt thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là bao nhiêu? Lời giải chi tiết
Bài 9: a) Phương trình điện li của HNO3 và HCl: HNO3 → H+ + NO3- (1) KOH → K+ + OH- (2) b) Theo (1): nH+ = nHNO3 = 0,1.1 = 0,1 mol => pH = -log[H+] = -log(0,1) = 1 Theo (2): nOH- = nKOH = 0,1.1 = 0,1 mol => pOH = -log[OH-] = -log(0,1) = 1 => pH = 14 – pOH = 13 Vậy pH của dung dịch A là 1 và pH của dung dịch B là 13. c) Khi trộn dung dịch A và dung dịch B với nhau: H+ + OH- → H2O Ta thấy: nH+ = nOH- => Phản ứng vừa đủ => Dung dịch sau phản ứng có pH = 7 Bài 10: (1) NH3 + O2 \(\mathrel{\mathop{\kern0pt\longrightarrow}\limits_{xt}^{{t^o}}} \) NO + H2O (2) 2NO + O2 → 2NO2 (3) 4NO2 + O2 + 2H2O → 4HNO3 (4) HNO3 + NH3 → NH4NO3 Bài 11: a) Khi đốt than ở trong phòng kín, than cháy trong môi trường thiếu oxi sinh ra khí CO theo phương trình hóa học: 2C + O2 \(\buildrel {{t^o}} \over\longrightarrow \) 2CO. Khi đó, CO kết hợp với hemoglobin trong hồng cầu máu người tạo thành hợp chất bền vững, khiến cho hemoglobin không thể kết hợp với oxi dẫn đến tình trạng thiếu oxi trầm trọng và gây tử vong. Biện pháp: Cung cấp đầy đủ khí O2 cho quá trình đốt than bằng cách đốt than ở nơi thoáng khí, tránh đốt trong các không gian chật hẹp và kín. b) nCO2 = 0,56 : 22,4 = 0,025 mol; nOH- = 2nCa(OH)2 = 2.0,4.0,05 = 0,04 mol; nCa2+ = nCa(OH)2 = 0,02 mol Ta có: \(1 < \dfrac{{{n_{O{H^ - }}}}}{{{n_{C{O_2}}}}} = \dfrac{{0,04}}{{0,025}} = 1,6 < 2\) => Tạo muối CO32- và HCO3- Đặt \(n_{CO_3^{2-}}\) = x (mol) và \(n_{HCO_3^-}\) = y (mol) CO2 + 2OH- → CO32- + H2O x 2x x CO2 + OH- → HCO3- y y y + nCO2 = x + y = 0,025 (1) + nOH- = 2x + y = 0,04 (2) Giải hệ (1) và (2) thu được x = 0,015 và y = 0,01 Ca2+ + CO32- → CaCO3↓ BĐ: 0,02 0,015 (mol) PƯ: 0,015←0,015 → 0,015 (mol) Khối lượng kết tủa thu được là: mCaCO3 = 0,015.100 = 1,5 gam Bài 12: Áp dụng phương pháp đường chéo cho hỗn hợp khí X:
Giả sử hỗn hợp khí X gồm 1 mol N2 và 4 mol H2. Theo định luật bảo toàn khối lượng ta có: mX = mY => nX.MX = nY.MY \( \Rightarrow {n_Y} = {n_X}\dfrac{{{M_X}}}{{{M_Y}}} = (1 + 4).\dfrac{{1,8}}{2} = 4,5(mol)\) => n giảm = nX – nY = 5 – 4,5 = 0,5 mol
Hiệu suất của phản ứng (tính theo N2) là: \(H\% = \dfrac{{0,25}}{1}.100\% = 25\% \) Xem lời giải chi tiết đề thi học kì 1 tại Tuyensinh247.com Loigiaihay.com
|
||||||||||||||||||||














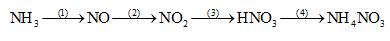






Danh sách bình luận