Đề kiểm tra 1 tiết (45 phút) - Đề số 5 - Chương II - Hóa học 11Đáp án và lời giải chi tiết Đề kiểm tra 1 tiết (45 phút) - Đề số 5 - Chương II - Hóa học 11. Quảng cáo
Đề bài I. PHẦN TRẮC NGHIỆM Câu 1. Nitơ mang số oxi hóa âm trong chất nào sau đây? A.NH4NO3 B.N2 C.N2O C.KNO3 Câu 2. Dẫn 2,24 lít khí NH3 (đktc) đi qua ống đựng 32 gam CuO nung nóng thu được chất rắn X và khí Y. Thể tích Y (đktc) thu được là: A.3,36 lít B.5,40 lít C.6,72 lít D.1,12 lít Câu 3. Một hỗn hợp khí gồm N2 và H2 có tỉ khối hơi so với không khí là 0,293. Phần trăm theo thể tích của mỗi khí trong hỗn hợp ban đầu lần lượt là: A. 30% và 70% B. 40% và 60% C. 33,33% và 66,67% D. 25% và 75% Câu 4. Một hỗn hợp X chứa 100 mol gồm N2 và H2 lấy theo tỉ lệ 1 : 3. Áp suất ban đầu là 300atm. Sau phản ứng tạo amoniac, áp suất giảm còn 285atm. Nếu nhiệt độ giữ không đổi thì hiệu suất phản ứng là: A.12% B.13% C.11% D.10% Câu 5. Cho phản ứng: Hệ số của các chất sau khi phản ứng trên được cân bằng lần lượt là: \(\begin{array}{l}A.3;2;1;2;1;3\\B.3;2;2;1;1;3\\C.3;2;3;1;1;3\\D.2;3;2;2;3;4\end{array}\) Câu 6. Để điều chế axit HNO3 trong phòng thí nghiệm, người ta có thể dùng những hóa chất nào sau đây? A. Dung dịch KNO3 và dung dịch H2SO4 loãng. B. Tinh thể NaNO3 và HCl đặc. C. Tinh thể KNO3 hoặc tinh thể NaNO3 và H2SO4 đặc, nóng. D. Dung dịch NaNO3 và axit H2SO4 đặc. Câu 7. Cho phản ứng: \(M + HN{O_3} \to M{\left( {N{O_3}} \right)_2} + N{H_4}N{O_3} + {H_2}O\) Hệ số của các chất sau khi phản ứng trên được cân bằng lần lượt là: A. 4,10,4,1,3 B. 4,4,10,4,1,3 C. 10,4,4,3,1,3 D. 2,6,2,1,3 Câu 8. Hợp chất nào sau đây của nitơ không được tạo thành khi cho HNO3 tác dụng với kim loại? A.NO B.N2O5 C.NH4NO3 D.NO2 II. PHẦN TỰ LUẬN Câu 9. Hòa tan 24 gam oxit của một kim loại có hóa trị cao nhất là III vào dung dịch HNO3 dư. Cô cạn dung dịch sau phản ứng, thu được 72,6 gam muối khan. Xác định công thức phân tử của oxit đem dùng. Câu 10. Có một hỗn hợp X gồm N2 và H2 có tỉ khối hơi so với H2 là 3,6. Sau khi nung nóng để phản ứng xảy ra, thu được hỗn hợp sản phẩm khí Y có tỉ khối hơi so với H2 bằng 4,5. Tính phần trăm theo thể tích của hỗn hợp khí trước và sau phản ứng. Câu 11. Cho dung dịch chứa 11,76 gam H3PO4 vào dung dịch chứa 16,8 gam KOH. Xác định muối tạo thành trong dung dịch sau phản ứng. Lời giải chi tiết I. PHẦN TRẮC NGHIỆM
Câu 1: Ta có: \(\mathop N\limits^{ - 3} {H_4}\mathop N\limits^{ + 5} {O_3};{\mathop N\limits^0 _2};{\mathop N\limits^{ + 1} _2}O;K\mathop N\limits^{ + 5} {O_3}\) Đáp án A Câu 2: 2NH3 + 3CuO → 3Cu + N2 + 3H2O n NH3 = 2,24 : 22,4 = 0,1 mol n CuO = 32 : 80 = 0,4 mol Ta có : 0,1 : 2 < 0,4 :3 => Sau phản ứng NH3 hết, CuO dư n N2 = ½ n NH3 = 0,05 mol => V N2 = 0,05 . 22,4 = 1,12 lít Đáp án D Câu 3: Khối lượng mol trung bình của hỗn hợp khí trên là: 0,293 . 29 = 8,497 (gam/mol) Đặt thể tích của N2; H2 lần lượt là x, y => Ta có phương trình: (28x + 2y) : (x + y) = 8,497 => x : y = 1 : 3 % V N2 = 1 : (1 + 3) . 100% = 25% % V H2 = 75% Đáp án D Câu 4: N2 + 3H2 ó 2NH3 Ban đầu 25 75 Phản ứng x 3x 2x Sau pu 25-x 75-3x 2x => Sau phản ứng, tổng số mol khí còn lại là: 100 – 2x (mol) Vì thể tích và áp suất là 2 đại lượng tỉ lệ nghịch => \(\frac{{100 - 2x}}{{100}} = \frac{{285}}{{300}}\) => x = 2,5 mol => H% = 2,5 : 25 . 100% = 10% Đáp án D Câu 5: \(3K\mathop {Cl}\limits^{ + 5} {O_3} + \mathop {2N}\limits^{ - 3} {H_3} \to 2K\mathop N\limits^{ + 5} {O_3} + K\mathop {Cl}\limits^{ - 1} + \mathop {C{l_2}}\limits^0 + 3{H_2}O\) Đáp án B Câu 6: Đáp án C Câu 7: \(4M + 10HN{O_3} \to 4M{\left( {N{O_3}} \right)_2} + N{H_4}N{O_3} + 3{H_2}O\) Đáp án A Câu 8: Đáp án B II. PHẦN TỰ LUẬN Câu 9. Gọi công thức oxit kim loại hóa trị III là: R2O3
Vậy công thức oxit sắt: Fe2O3 Câu 10. +) Trước phản ứng: \({d_{hh\left( X \right)/{H_2}}} = \dfrac{{\overline M }}{{{M_{{H_2}}}}} = 3,6 \) \(\Rightarrow \overline M = 7,2{\rm{ }}\left( 1 \right)\) Gọi \(\alpha \) là phần trăm theo thể tích của N2 \( \Rightarrow \left( {1 - \alpha } \right)\) là phần trăm theo thể tích của H2 Từ (1) \( \Leftrightarrow 7,2 = 28\alpha + 2\left( {1 - \alpha } \right)\) \(\Rightarrow \alpha = 0,2\) Vậy: \(\% {V_{{N_2}}} = 20\% ;{\rm{ \% }}{{\rm{V}}_{{H_2}}} = 80\% \) +) Sau phản ứng:
Xét hỗn hợp ban đầu có 1 mol \( \Rightarrow {n_{{H_2}}} = 0,8\left( {mol} \right);{n_{{N_2}}} = 0,2\left( {mol} \right)\) Gọi x là số mol của N2 tham gia phản ứng. Hỗn hợp sau phản ứng gồm: NH3 = 2x (mol); N2 dư = (0,2 – x) mol; H2 dư = (0,8 – 3x) mol \({d_{hh\left( Y \right)/{H_2}}} = \dfrac{{\overline {{M_Y}} }}{2} = 4,5 \Rightarrow {\overline M _Y} = 9\) \(\begin{array}{l} \Leftrightarrow \dfrac{{28\left( {0,2 - x} \right) + 2\left( {0,8 - 3x} \right) + 17.2x}}{{1 - 2x}} = 9\\ \Leftrightarrow 5,6 - 28x + 1,6 - 6x + 34x = 9 - 18x\\ \Leftrightarrow 18x = 1,8 \Rightarrow x = 0,1\left( {mol} \right)\end{array}\) Vì là chất khí nên %V = %n Vậy: \(\begin{array}{l}\% {V_{{N_2}}} = \% {n_{{N_2}}} = \dfrac{{0,2 - 0,1}}{{0,8}} \times 100\% = 12,5\% \\\% {V_{{H_2}}} = \% {n_{{H_2}}} = \dfrac{{0,8 - 0,3}}{{0,8}} \times 100\% = 62,5\% \\\% {V_{N{H_3}}} = \% {n_{N{H_3}}} = 100\% - \left( {12,5\% + 62,5\% } \right) = 25\% \end{array}\) Câu 11. Ta có: \({n_{{H_3}P{O_4}}} = \dfrac{{11,76}}{{98}}0,12\left( {ml} \right);\) \({n_{KOH}} = \dfrac{{16,8}}{{56}} = 0,3\left( {mol} \right)\) Lập tỉ số: \(\dfrac{{{n_{KOH}}}}{{{n_{{H_3}P{O_4}}}}} = 2,5\) \( \Rightarrow \) tạo hai muối: K2HPO4 và K3PO4 Phản ứng: \(\begin{array}{l}2KOH + {H_3}P{O_4} \to {K_2}HP{O_4} + 2{H_2}O\\3KOH + {H_3}P{O_4} \to {K_3}P{O_4} + 3{H_2}O\end{array}\) Loigiaihay.com
|














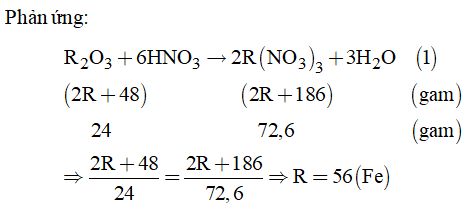







Danh sách bình luận