Giải đề thi học kì 1 hoá lớp 11 năm 2019 - 2020 trường THPT Lê Hồng Phong – Tây NinhGiải chi tiết đề thi học kì 1 môn hoá lớp 11 năm 2019 - 2020 trường THPT Lê Hồng Phong - Tây Ninh với cách giải nhanh và chú ý quan trọng Quảng cáo
PHẦN I: TRẮC NGHIỆM (6 điểm) Câu 1. Tìm phát biểu chưa đúng A. Các muối amoni đều dễ tan trong nước. B. Các muối amoni khi tan đều điện li hoàn toàn thành ion. C. Các muối amoni khi đun nóng đều bị phân hủy thành amoniac và axit. D. Có thể dùng muối amoni để điều chế NH3 trong phòng thí nghiệm. Câu 2. Để loại bỏ SO2 trong CO2 có thể dùng hóa chất nào sau đây? A. Dung dịch Ca(OH)2. B. CuO. C. Dung dịch NaOH. D. Dung dịch Br2. Câu 3. Để nhận biết \(PO_4^{3 - }\)người ta sử dụng thuốc thử là A. Quỳ tím. B. AgNO3. C. NaOH. D. KOH. Câu 4. Số oxi hóa của photpho trong các ion và hợp chất P2O3, \(PO_4^{3 - }\), K2HPO4, PH3 lần lượt là: A. -3, -5, -5, +3. B. -3, +5, +5, +3. C. +3, +5, +5, -3. D. +3, +5, +5, -3. Câu 5. Chọn biểu thức sai A. pH = -lg [H+] B. [H+] = 10a thì pH = a. C. pH + pOH = 14 D. [H+].[OH-] = 10-14 Câu 6. Đốt cháy hoàn toàn 5,80 gam chất X thu được 2,65 gam Na2CO3, 2,26 gam H2O và 12,1 gam CO2. Công thức phân tử của X là (Biết NTK: O = 16; C = 12, H = 1, Na = 23) A. C6H5ONa. B. C7H7O2Na. C. C6H5O2Na. D. C7H7ONa. Câu 7. Cặp công thức của Litinitrua và nhôm nitrua là: A. Li3N và AlN. B. Li2N3 và Al2N3. C. Li3N2 và Al3N2. D. LiN3 và Al3N. Câu 8. Một dung dịch (A) chứa 0,02 mol Cu2+; 0,03 mol K+; x mol Cl- và y mol \(SO_4^{2 - }\). Tổng khối lượng các muối tan có trong dung dịch là 5,435 gam. Giá trị của x và y lần lượt là: (biết Cu = 64; K = 39; Cl = 35,5; S = 32; O = 16) A. 0,03 và 0,02. B. 0,01 và 0,03. C. 0,05 và 0,01. D. 0,02 và 0,05. Câu 9: Cho các chất sau: HCl, H2CO3, HNO3, H3PO4, CH3COOH. Số chất axit nhiều nấc là A. 1. B. 3. C. 4. D. 2. Câu 10. Đặc điểm chung của các phân tử hợp chất hữu cơ (1) Thành phần nguyên tố chủ yếu là C và H. (2) Có thể chứa nguyên tố khác như Cl, N, P, O. (3) Liên kết hóa học chủ yếu là liên kết cộng hóa trị. (4) Liên kết hóa học chủ yếu là liên kết ion. (5) Dễ bay hơi, khó cháy. (6) Phản ứng hóa học xảy ra nhanh. Nhóm các ý đúng là: A. 4, 5, 6. B. 2, 4, 6. C. 1, 3, 5. D. 1, 2, 3. Câu 11: Chất điện li mạnh là chất khi tan trong nước các phân tử hòa tan A. Phân li một phần ra ion. B. Tạo dung dịch dẫn diện tốt. C. Phân li ra ion. D. Phân li hoàn toàn thành ion. Câu 12. Cho 100 ml dung dịch H3PO4 1,5M tác dụng với 100 ml dung dịch NaOH 2,5M. Khối lượng muối tạo thành và nồng độ mol/l của dung dịch tạo thành là (Biết Na=23; P=31; H=1; O=16) A. 6 gam; 12,4 gam; 0,52M; 0,5M. B. 9 gam; 12,4 gam; 0,25M; 0,05M. C. 7 gam; 14,2 gam; 0,55M; 0,05M. D. 6 gam; 14,2 gam; 0,25M; 0,5M. Câu 13. Tính chất nào sau đây không thuộc Axit photphoric? A. Axit photphoric và Axit trung bình, phân li theo 3 nấc. B. Không thể nhận biết H3PO4 bằng dung dịch AgNO3. C. Axit photphoric tan trong nước theo bất kì tỉ lệ nào. D. Ở điều kiện thường Axit photphoric là chất lỏng, trong suốt, không màu. Câu 14. Sản phẩm lần lượt tạo thành khi sục từ từ CO2 đến dư vào nước vôi trong là A. Ca(HCO3)2, CaCO3. B. Ca(HCO3)2. C. CaCO3, Ca(HCO3)2. D. CaCO3. Câu 15. Dung dịch X có chứa a mol Na+, b mol Al3+, c mol Cl- và d mol \(SO_4^{2 - }\). Biểu thức nào đúng? A. a - 3b = c - 2d. B. a + b = c + d. C. a + 3b = c + 2d. D. a + 3b + c + 2d = 0. Câu 16. Kim loại bị thụ động trong HNO3 đặc nguội là A. Au, Ag. B. Pb, Ag. C. Al, Fe. D. Ag, Fe. Câu 17. Các kim loại đều tác dụng được với dd HCl nhưng không tác dụng với dd HNO3 đặc, nguội A. Cu, Fe, Al. B. Fe, Mg, Al. C. Cu, Pb, Ag. D. Fe, Al, Cr. Câu 18. Cho các muối sau: NH4Cl, NaHSO4, KHCO3, Na2SO4, Fe(NO3)2. Số muối thuộc loại muối axit là A. 4. B. 2. C. 3. D. 1. Câu 19. Dung dịch NaCl dẫn được điện là vì A. các nguyên tử Na, Cl di chuyển tự do. B. phân tử NaCl dẫn được điện. C. các ion Na+, Cl- di chuyển tự do. D. phân tử NaCl di chuyển tự do. Câu 20. Dung dịch chất nào sau đây không làm đổi màu quỳ tím? A. Na2SO4. B. Ba(OH)2. C. HClO4. D. HCl. Câu 21. Hấp thụ 2,24 lít khí CO2 (ở đktc) vào dung dịch chứa 8 gam NaOH, thu được dung dịch X. Khối lượng muối tan trong X là (biết NTK: O = 16, C = 12, Na = 23, H = 1) A. 21,2 gam. B. 15,9 gam. C. 5,3 gam. D. 10,6 gam. Câu 22. Hợp chất nào của nitơ không được tạo ra khi cho HNO3 tác dụng với kim loại? A. NO2. B. NH4NO3. C. NO. D. N2O5. Câu 23. Để đề phòng bị nhiễm độc CO, người ta sử dụng mặt nạ với chất hấp phụ nào sau đây? A. CuO và Fe2O3. B. CuO và MgO. C. Than hoạt tính. D. CuO và MnO2. Câu 24. Hòa tan một axit vào nước ở 250C, kết quả là A. [H+] = [OH-] B. [H+].[OH+] > 1.0.10-14 C. [H+] < [OH-] D. [H+] > [OH-]. Câu 25. Dung dịch chất nào sau đây là chất điện li? A. Nước nguyên chất. B. Glucozơ. C. Axit sunfuric. D. Rượu etylic. Câu 26. Sục V (lít) khí CO2 (đktc) vào 150 ml dung dịch Ba(OH)2 1M, sau phản ứng thu được 19,7 gam kết tủa. Giá trị của V là (biết NTK: O = 16, C = 12, H = 1, Ba = 137, H = 1) A. 3,36 lít; 4,48 lít. B. 2,24 lít; 6,72 lít. C. 2,24 lít; 4,48 lít. D. 2,24 lít; 3,36 lít. Câu 27. Axit nitric đặc, nóng phản ứng được với tất cả các chất trong nhóm nào sau đây? A. Mg(OH)2, NH3, CO2, Au. B. Mg(OH)2, CuO, NH3, Pt. C. CaO, NH3, Au, FeCl2. D. Mg(OH)2, CuO, NH3, Ag. Câu 28. Điều chế NH3 từ hỗn hợp gồm N2 và H2 (tỉ lệ mol 1:3). Tỉ khối hỗn hợp trước so với hỗn hợp sau phản ứng là 0,6. Hiệu suất phản ứng là (biết H = 1, N = 14) A. 75%. B. 80%. C. 70%. D. 60%. Câu 29. Nguồn chứa nhiều photpho trong tự nhiên là A. Cơ thể người và động vật. B. Quặng xiđerít. C. Protein thực vật. D. Quặng apatit. Câu 30. Phản ứng hóa học của các hợp chất hữu cơ có đặc điểm là A. thường xảy ra rất nhanh, không hoàn toàn, không theo một hướng nhất định. B. thường xảy ra chậm, không hoàn toàn, không theo một hướng nhất định. C. thường xảy ra rất chậm, nhưng hoàn toàn, không theo một hướng nhất định. D. thường xảy ra rất nhanh và cho một sản phẩm duy nhất. PHẦN II: TỰ LUẬN (4,0 điểm). Câu 31. (1 điểm) Viết phương trình phân tử, phương trình ion đẩy đủ, phương trình ion thu gọn và rút ra bản chất của phản ứng giữa NaOH và H2SO4. Câu 32. (1 điểm) Hoàn thành sơ đồ phản ứng sau (ghi rõ điều kiện nếu có) Câu 33. (1 điểm) Dẫn 2,24 lít khí CO2 (đktc) vào lượng dư dung dịch Ca(OH)2 thu được kết tủa trắng. Tính khối lượng kết tủa thu được (biết NTK: H = 1; O = 16; C = 12; Ca = 40) Câu 34. (1 điểm) Chỉ dùng quỳ tím, hãy phân biệt các dung dịch mất nhãn sau: (NH4)2SO4, NaOH, Na2CO3, Ba(OH)2. HƯỚNG DẪN GIẢI CHI TIẾT Thực hiện: Ban chuyên môn Loigiaihay.com PHẦN I: TRẮC NGHIỆM 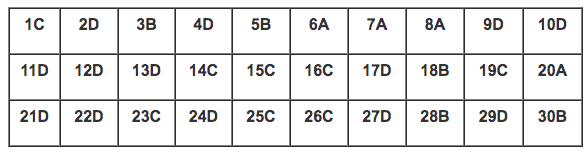 Câu 1 (TH): Phương pháp: Xem lại lý thuyết về muối amoni Cách giải: A. Đ B. Đ C. sai. Muối amoni chứa gốc axit có tính oxi hóa mạnh khi nhiệt phân không tạo amoniac D. Đ Chọn C. Câu 2 (TH): Phương pháp: Sử dụng hóa chất chỉ phản ứng với SO2 mà không phản ứng với CO2. Cách giải: Dẫn khí CO2 có lẫn SO2 qua bình đựng dung dịch Br2, SO2 phản ứng được với dung dịch brom nên bị giữ lại, như vậy ta loại được khí SO2 ra khỏi CO2 \(S{O_2} + B{{\rm{r}}_2} + 2{H_2}O \to {H_2}S{O_4} + 2HB{\rm{r}}\) Chọn D. Câu 3 (NB): Phương pháp: Muối photphat tạo kết tủa vàng với thuốc thử AgNO3 \(3{\rm{A}}{g^ + } + PO_4^{3 - } \to A{g_3}P{O_4}\) Cách giải: Để nhận biết ion \(PO_4^{3 - }\)người ta sử dụng thuốc thử là AgNO3 \(3{\rm{A}}{g^ + } + PO_4^{3 - } \to A{g_3}P{O_4}\) Chọn B. Câu 4 (TH): Phương pháp: - Số oxi hóa của nguyên tố trong các đơn chất bằng không. - Trong một phân tử, tổng số oxi hóa của các nguyên tố bằng 0. - Số oxi hóa của các ion đơn nguyên tử bằng điện tích của ion đó. - Trong hầu hết hợp chất, số oxi hóa của H là +1, trừ một số trường hợp như hiđrua kim loại (NaH, CaH2,…). Số oxi hóa của O bằng -2 trừ trường hợp OF2 và peoxit (H2O2, Na2O2,…) Cách giải: + Gọi số oxi hóa của P trong P2O3 là x \( \to 2.x + 3.( - 2) = 0 \to x = + 3\) + Gọi số oxi hóa của P trong \(PO_4^{3 - }\)là x \( \to x + 4.( - 2) = - 3 \to x = + 5\) + Gọi số oxi hóa của P trong K2HPO4 là x \( \to 2.( + 1) + 1.( + 1) + x + 4.( - 2) = 0 \to x = + 5\) + Gọi số oxi hóa của P trong PH3 là x \( \to x + 3.( + 1) = 0 \to x = - 3\) Chọn D. Câu 4 (TH): Phương pháp: Các công thức cần nhớ: + pH = -log[H+] + pH + pOH = 14 + [H+] = 10-a thì pH = a + [H+].[OH-] = 10-14 Cách giải: Ta có công thức [H+] = 10-a thì pH = a \( \to \)ý B sai. Chọn B. Câu 6 (VD): Phương pháp: - Tính số mol của Na2CO3, CO2, H2O, suy ra số mol và khối lượng của C, H, Na - Tính tổng khối lượng C, H, Na và so sánh với khối lượng của X để kết luận X có chứa Oxi hay không - Gọi công thức phân tử của X là CxHyOzNat \(x:y:z:t = {n_C}:{n_H}:{n_O}:{n_{Na}}\) - Kết luận Cách giải: \({n_{N{a_2}C{O_3}}} = \dfrac{{2,65}}{{106}} = 0,025\,\,mol \to {n_{Na}} = 2{n_{N{a_2}C{O_3}}} = 2.0,025 = 0,05\,\,mol \to {m_{Na}} = 0,05.23 = 1,15\,\,gam\) \({n_{C{O_2}}} = \dfrac{{12,1}}{{44}} = 0,275\,\,mol \to {n_C} = {n_{C{O_2}}} + {n_{N{a_2}C{O_3}}} = 0,275 + 0,025 = 0,3\,\,mol \to {m_C} = 0,3.12 = 3,6\,\,gam\) \({n_{{H_2}O}} = \dfrac{{2,26}}{{18}} = 0,125\,\,mol \to {n_H} = 2{n_{{H_2}O}} = 2.0,125 = 0,25\,\,mol \to {m_H} = 1.0,25 = 0,25\,\,gam\) Ta có: mC + mH + mNa = 3,6 + 1,15 + 0,25 = 5 gam < mX \( \to \)trong X chứa O, mO = mX – (mC + mH + mNa) = 0,8 gam \({n_O} = \dfrac{{0,8}}{{16}} = 0,05\,\,mol\) Gọi công thức phân tử của X là CxHyOzNat \(x:y:z:t = 0,3:0,25:0,05:0,05 = 6:5:1:1\) Vậy công thức phân tử của X là C6H5ONa Chọn A. Câu 7 (TH): Phương pháp: Trong hợp chất với kim loại, N thể hiện số oxi hóa -3 Cách giải: Công thức của litinitrua là Li3N Công thức của nhôm nitrua là AlN Chọn A. Câu 8 (VD): Phương pháp: - Áp dụng bảo toàn điện tích (1) - Áp dụng bảo toàn khối lượng (2) - Từ (1) và (2) giải hệ phương trình tìm được x, y. Cách giải: Áp dụng bảo toàn điện tích: \(2{n_{C{u^{2 + }}}} + {n_{{K^ + }}} = {n_{C{l^ - }}} + 2{n_{SO_4^{2 - }}}\) => 2.0,02 + 0,03 = x + 2y => x + 2y = 0,07 (1) Áp dụng bảo toàn khối lượng: \({m_{muoi}} = {m_{C{u^{2 + }}}} + {m_{{K^ + }}} + {m_{C{l^ - }}} + {m_{SO_4^{2 - }}}\) => 5,435 = 0,02.64 + 0,03.39 + 35,5.x + 96.y => 35,5x + 96y = 2,985 (2) Từ (1) và (2) => x = 0,03 và y = 0,02 Chọn A. Câu 9 (TH): Phương pháp: Axit nhiều nấc là axit trong phân tử có nhiều nguyên tử hiđro có khả năng phân ly ra H+ Cách giải: Các axit nhiều nấc là H2CO3, H3PO4. Chọn D. Câu 10 (TH): Phương pháp: - Đặc điểm cấu tạo: thành phần hợp chất hữu cơ bắt buộc phải chứa C. Các nguyên tử C liên kết với nhau và liên kết với H, O, N… Liên kết hóa học chủ yếu là liên kết cộng hóa trị - Tính chất vật lý + Nhiệt độ nóng chảy, nhiệt độ sôi thấp + Phần lớn không tan trong nước, nhưng tan nhiều trong các dung môi hữu cơ - Tính chất hóa học + Kém bền với nhiệt, dễ cháy + Phản ứng hóa học của các hợp chất hữu cơ thường xảy ra chậm và theo nhiều hướng khác nhau, tạo ra hỗn hợp nhiều sản phẩm. Cách giải: Các ý đúng là 1, 2, 3. Chọn D. Câu 11 (NB): Phương pháp: Chất điện ly mạnh là các chất khi tan trong nước phân li hoàn toàn ra ion. Cách giải: Chất điện ly mạnh là chất khi tan trong nước các phân tử hòa tan phân ly hoàn toàn thành ion. Chọn D. Câu 12 (VD): Phương pháp: - Tính tỷ lệ \(\dfrac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}}\), kết luận muối được sinh ra - Từ số mol H3PO4 và NaOH, lập hệ phương trình tính số mol các muối - Tính khối lượng và nồng độ của các muối thu được. Cách giải: \({n_{{H_3}P{O_4}}} = 0,1.1,5 = 0,15\,\,mol;{n_{NaOH}} = 0,1.2,5 = 0,25\,\,mol\) Vì \(1 < \dfrac{{{n_{NaOH}}}}{{{n_{{H_3}P{O_4}}}}} = \dfrac{{0,25}}{{0,15}} = 1,67 < 2 \to \)phản ứng tạo 2 muối NaH2PO4 (x mol) và Na2HPO4 (y mol) \({H_3}P{O_4} + NaOH \to Na{H_2}P{O_4} + {H_2}O\) x x x \({H_3}P{O_4} + 2NaOH \to N{a_2}HP{O_4} + 2{H_2}O\) y 2y y \({n_{{H_3}P{O_4}}} = x + y = 0,15\)(1) \({n_{NaOH}} = x + 2y = 0,25\) (2) Từ (1) và (2) => x = 0,05 và y = 0,1 Khối lượng của muối NaH2PO4 là \({m_{Na{H_2}P{O_4}}} = 0,05.120 = 6\,\,gam\) Khối lượng của muối Na2HPO4 là: \({m_{N{a_2}HP{O_4}}} = 0,1.142 = 14,2\,\,gam\) Nồng độ mol của muối NaH2PO4 là: \({C_{M(Na{H_2}P{O_4})}} = \dfrac{{0,05}}{{0,1 + 0,1}} = 0,25M\) Nồng độ mol của muối Na2HPO4 là: \({C_{M(N{a_2}HP{O_4})}} = \dfrac{{0,1}}{{0,1 + 0,1}} = 0,5M\) Chọn D. Câu 13 (TH): Phương pháp: Xem lại lý thuyết về axit photphoric và muối photphat Cách giải: Axit photphoric là chất rắn ở dạng tinh thể trong suốt, không màu, dễ chảy rữa và tan vô hạn trong nước. Chọn D. Câu 14 (TH): Phương pháp: Viết phương trình hóa học của phản ứng và kết luận Cách giải: Sục từ từ khí CO2 đến dư vào nước vôi trong, phản ứng lần lượt \(C{O_2} + Ca{(OH)_2} \to CaC{{\rm{O}}_3} + {H_2}O\) \(C{O_2} + {H_2}O + CaC{{\rm{O}}_3} \to Ca{(HC{O_3})_2}\) Chọn C. Câu 15 (TH): Phương pháp: Áp dụng phương pháp bảo toàn điện tích. Cách giải: Áp dụng bảo toàn điện tích: \({n_{N{a^ + }}} + 3{n_{A{l^{3 + }}}} = {n_{C{l^ - }}} + 2{n_{SO_4^{2 - }}}\) => a + 3b = c + 2d Chọn C. Câu 16 (NB): Phương pháp: Al, Fe và Cr bị thụ động hóa trong HNO3 đặc nguội và H2SO4 đặc nguội Cách giải: Al và Fe bị thụ động hóa trong HNO3 đặc nguội Chọn C. Câu 17 (TH): Phương pháp: Kim loại phản ứng được với dung dịch HCl là những kim loại đứng trước H trong dãy hoạt động hóa học Al, Fe và Cr bị thụ động hóa trong axit HNO3 Cách giải: Đáp án A. Cu không phản ứng được với HCl Đáp án B. Mg phản ứng được với HNO3 đặc, nguội Đáp án C. Cu, Ag không phản ứng với HCl Chọn D. Câu 18 (TH): Phương pháp: Muối axit là muối mà trong phân tử còn nguyên tử Hiđro có khả năng phân ly thành ion Cách giải: NaHSO4 và KHCO3 là các muối axit. Chọn B. Câu 19 (TH): Phương pháp: Một dung dịch dẫn được điện do trong dung dịch chứa các phần tử mang điện tích Cách giải: Dung dịch NaCl dẫn điện được vì NaCl phân ly thành các ion Na+ và Cl- di chuyển tự do. Chọn C. Câu 20 (TH): Phương pháp: - Dung dịch có môi trường trung tính không làm đổi màu quỳ tím - Dung dịch có môi trường axit làm quỳ tím chuyển sang màu đỏ - Dung dịch có môi trường bazơ làm quỳ tím chuyển sang màu xanh Cách giải: + Na2SO4 không làm đổi màu quỳ tím + Ba(OH)2 làm quỳ tím chuyển sang màu xanh + HClO4 và HCl làm quỳ tím chuyển sang màu đỏ Chọn A. Câu 21 (VD): Phương pháp: - Xét tỷ lệ \(\dfrac{{{n_{NaOH}}}}{{{n_{C{O_2}}}}}\)để kết luận muối thu được - Viết phương trình, suy ra số mol muối - Tính khối lượng muối thu được. Cách giải: \({n_{C{O_2}}} = \dfrac{{2,24}}{{22,4}} = 0,1\,\,mol;{n_{NaOH}} = \dfrac{8}{{40}} = 0,2\,\,mol\) Vì \(\dfrac{{{n_{NaOH}}}}{{{n_{C{O_2}}}}} = \dfrac{{0,2}}{{0,1}} = 2 \to \)phản ứng sinh ra muối Na2CO3 \(C{O_2} + 2NaOH \to N{a_2}C{O_3} + {H_2}O\) 0,1 0,2 0,1 Vậy \({m_{N{a_2}C{O_3}}} = 0,1.106 = 10,6\,\,gam\) Chọn D. Câu 22 (NB): Phương pháp: Sản phẩm khử của HNO3 có thể là NH4NO3, N2O, NO, N2O3, NO2. Cách giải: N2O5 không được tạo ra khi cho HNO3 tác dụng với kim loại. Chọn D. Câu 23 (TH): Phương pháp: Than hoạt tính có khả năng hấp phụ các chất khí và các chất trong dung dịch nên được ứng dụng làm mặt nạ phòng độc, lõi lọc nước,… Cách giải: Để đề phòng bị nhiễm độc CO, người ta sử dụng mặt nạ phòng độc với chất hấp phụ là than hoạt tính. Chọn C. Câu 24 (TH): Phương pháp: - Môi trường axit có [H+] > [OH-] - Môi trường trung tính có [H+] = [OH-] - Môi trường bazơ có [H+] < [OH-] Cách giải: Khi hòa tan axit vào nước, dung dịch thu được có môi trường axit nên [H+] > [OH-] Chọn D. Câu 25 (TH): Phương pháp: Chất điện ly bao gồm axit, bazơ và muối. Cách giải: Axit sunfuric là axit nên là chất điện ly. Chọn C. Câu 26 (VD): Phương pháp: Vì số mol kết tủa nhỏ hơn số mol Ba(OH)2 nên xét hai trường hợp - Trường hợp 1: Ba(OH)2 dư, CO2 phản ứng hết + Số mol CO2 tính theo số mol kết tủa + Tính V - Trường hợp 2: Phản ứng tạo 2 muối + Từ số mol kết tủa, tính được số mol bazơ phản ứng tạo kết tủa + Tính được số mol Ba(OH)2 phản ứng tạo muối hiđrocacbonat + Theo 2 phương trình suy ra số mol CO2 + Tính V. Cách giải: \({n_{Ba{{(OH)}_2}}} = 0,15.1 = 0,15\,\,mol;{n_{BaC{{\rm{O}}_3}}} = \frac{{19,7}}{{197}} = 0,1\,\,mol\) Vì \({n_{BaC{O_3}}} < {n_{Ba{{(OH)}_2}}} \to \)xét 2 trường hợp Trường hợp 1: Ba(OH)2 dư, CO2 hết, phản ứng chỉ tạo muối cacbonat \(C{O_2} + Ba{(OH)_2} \to BaC{{\rm{O}}_3} + {H_2}O\) 0,1 0,1 Vậy V = \({V_{C{O_2}}} = 0,1.22,4 = 2,24\)lít Trường hợp 2: Phản ứng sinh ra 2 muối cacbonat và hiđrocacbonat \(C{O_2} + Ba{(OH)_2} \to BaC{{\rm{O}}_3} + {H_2}O\) (1) 0,1 0,1 0,1 \(2C{O_2} + Ba{(OH)_2} \to Ba{(HC{O_3})_2}\) (2) 0,1 0,05 Theo phương trình (1): \({n_{Ba{{(OH)}_2}(1)}} = {n_{BaC{{\rm{O}}_3}}} = 0,1\,\,mol\) Mà \({n_{Ba{{(OH)}_2}}} = 0,15\,\,mol \to {n_{Ba{{(OH)}_2}(2)}} = 0,15 - 0,1 = 0,05\,\,mol\) Theo (1) và (2): \({n_{C{O_2}}} = {n_{BaC{{\rm{O}}_3}}} + 2{n_{Ba{{(OH)}_2}(2)}} = 0,1 + 2.0,05 = 0,2\,\,mol\) Vậy \(V = {V_{C{O_2}}} = 0,2.22,4 = 4,48\) lít Chọn C. Câu 27 (TH): Phương pháp: - HNO3 là một axit mạnh: làm quỳ tím chuyển đỏ, tác dụng với oxit bazơ, tác dụng với bazơ, tác dụng với muối - HNO3 là chất oxi hóa mạnh: tác dụng với hầu hết các kim loại (trừ Au và Pt), tác dụng với phi kim, tác dụng với các hợp chất có tính khử. Cách giải: Đáp án A. HNO3 không phản ứng với CO2 và Au Đáp án B. HNO3 không phản ứng với Pt Đáp án C. HNO3 không phản ứng với Au Chọn D. Câu 28 (VD): Phương pháp: - Giả sử hỗn hợp ban đầu có 1 mol N2 và 3 mol H2, tính được Mt - Sử dụng phương pháp ba dòng, tính số mol các chất sau phản ứng, từ đó lập biểu thức Ms - Vì Mt : Ms = 0,6, suy ra giá trị của các chất phản ứng - Tìm hiệu suất. Cách giải: Giả sử ban đầu có 1 mol N2 và 3 mol H2 \( \to {M_t} = \dfrac{{1.28 + 3.2}}{{1 + 3}} = 8,5\) PTHH: \({N_2} + 3{H_2} \to 2N{H_3}\) Ban đầu: 1 3 Phản ứng: x 3x 2x Sau phản ứng:1-x 3 – 3x 2x \({M_s} = \dfrac{{28(1 - x) + 2(3 - 3{\rm{x}}) + 17.2{\rm{x}}}}{{1 - x + 3 - 3{\rm{x}} + 2{\rm{x}}}} = \dfrac{{34}}{{4 - 2{\rm{x}}}}\) Vì \(\dfrac{{{M_t}}}{{{M_s}}} = 0,6 \to \dfrac{{8,5}}{{\frac{{34}}{{4 - 2{\rm{x}}}}}} = 0,6 \to x = 0,8\) \(H = \dfrac{{0,8}}{1}.100\% = 80\% s\) Chọn B. Câu 29 (NB): Phương pháp: Trong tự nhiên, photpho chỉ tồn tại ở dạng hợp chất. Hai khoáng vật chính là apatit 3Ca3(PO4)2.CaF2 và photphorit Ca3(PO4)2. Cách giải: Nguồn chứa nhiều photpho trong tự nhiên là quặng apatit Chọn D. Câu 30 (NB): Phương pháp: + Các hợp chất hữu cơ kém bền với nhiệt, dễ cháy + Phản ứng hóa học của các hợp chất hữu cơ thường xảy ra chậm và theo nhiều hướng khác nhau, tạo ra hỗn hợp nhiều sản phẩm. Cách giải: Phản ứng hóa học của các hợp chất hữu cơ thường xảy ra chậm, không hoàn toàn, không theo một hướng nhất định. Chọn B. PHẦN II: TỰ LUẬN Câu 31 (TH): Phương pháp: Viết phương trình phân tử, phương trình ion đầy đủ và phương trình ion thu gọn sau đó rút ra kết luận. Cách giải: - Phương trình phân tử: \(2NaOH + {H_2}S{O_4} \to N{a_2}S{O_4} + 2{H_2}O\) - Phương trình ion đầy đủ: \(2N{a^ + } + 2{\rm{O}}{H^ - } + 2{H^ + } + SO_4^{2 - } \to 2N{a^ + } + SO_4^{2 - } + 2{H_2}O\) - Phương trình ion thu gọn: \(O{H^ - } + {H^ + } \to {H_2}O\) => Bản chất của phản ứng là ion OH- phản ứng với ion H+ tạo ra H2O. Câu 32 (TH): Phương pháp: Dựa vào tính chất của P và hợp chất của P để viết các phương trình phản ứng thích hợp Cách giải: (1) (2) \({P_2}{O_5} + 3{H_2}O \to 2{H_3}P{O_4}\) (3) \({H_3}P{O_4} + 3NaOH \to N{a_3}P{O_4} + 3{H_2}O\) (4) \(N{a_3}P{O_4} + 3AgN{O_3} \to A{g_3}P{O_4} + 3NaN{{\rm{O}}_3}\) Câu 33 (VD): Phương pháp: - Viết PTHH, tính số mol kết tủa theo số mol của CO2 - Tính khối lượng kết tủa Cách giải: \({n_{C{O_2}}} = \ddfrac{{2,24}}{{22,4}} = 0,1\,\,mol\) PTHH: \(C{O_2} + Ca{(OH)_2} \to CaC{{\rm{O}}_3} + {H_2}O\) 0,1 0,1 \({m_{CaC{{\rm{O}}_3}}} = 0,1.100 = 10\,\,gam\) Câu 34 (TH): Phương pháp: - Quỳ tím giúp nhận biết được (NH4)2SO4 - Dùng (NH4)2SO4 nhận biết các dung dịch còn lại Cách giải: - Trích một lượng nhỏ vừa đủ các mẫu nhận biết ra ống nghiệm để làm thí nghiệm - Nhúng giấy quỳ tím vào các ống nghiệm đựng mẫu nhận biết + Quỳ tím chuyển sang màu đỏ là (NH4)2SO4 + Quỳ tím chuyển xanh: NaOH, Na2CO3, Ba(OH)2 - Nhỏ dung dịch (NH4)2SO4 vào các ống nghiệm đựng dung dịch làm xanh giấy quỳ tím + Xuất hiện khí không màu, mùi khai: NaOH + Không có hiện tượng: Na2CO3 + Xuất hiện khí không màu, mùi khai và kết tủa trắng: Ba(OH)2. - PTHH: \({(N{H_4})_2}S{O_4} + 2NaOH \to N{a_2}S{O_4} + 2N{H_3} + 2{H_2}O\) \({(N{H_4})_2}S{O_4} + Ba{(OH)_2} \to BaS{O_4} + 2N{H_3} + {H_2}O\) Loigiaihay.com
|




















Danh sách bình luận