Đề kiểm tra 1 tiết (45 phút) - Đề số 3 - Chương III - Hóa học 11Đáp án và lời giải chi tiết Đề kiểm tra 1 tiết (45 phút) - Đề số 3 - Chương III - Hóa học 11 Quảng cáo
Đề bài I. PHẦN TRẮC NGHIỆM Câu 1. Để khử hoàn toàn 17,6 gam hỗn hợp rắn gồm: Fe, FeO, Fe3O4 và Fe2O3 cần vừa đủ 2,24 lít CO (đktc). Khối lượng Fe thu được là: A.14 gam B.15 gam C.16 gam D.18 gam Câu 2. Cho V lít CO2 (đktc) vào dung dịch chứa 0,2 mol Ca(OH)2 thu được 10 gam kết tủa. Giá trị của V là: A.1,12 lít B.2,24 lít C.6,72 lít D.Cả B và C đều đúng. Câu 3. Thổi một luồng khí CO dư qua ống sứ đựng a gam hỗn hợp Fe3O4 và CuO nung nóng đến khi phản ứng xảy ra hoàn toàn, thu được 2,32 gam hỗn hợp kim loại. Dẫn khí thoát ra vào dung dịch nước vôi trong dư thu được 5 gam kết tủa. Giá trị của a là: A.3,12 gam B.2,22 gam C.3,32 gam D.1,54 gam Câu 4. Trong một bình kín thể tích không đổi chứa bột S và C (thể tích không đáng kể). Bơm không khí vào bình đến áp suất 2atm ở \(15^\circ C\). Bật tia lửa điện để S và C cháy thành SO2 và CO2, sau đó đưa bình về \(25^\circ C\). Áp suất trong bình lúc đó là: A.1,5atm B.2,0atm C.2,5atm D.1,0atm Câu 5. Hai dạng tồn tại khác nhau của cùng một đơn chất được gọi là: A. công thức phân tử. B. thù hình C. đơn chất D. đồng vị. Câu 6. Cấu hình electron nào sau đây là của cacbon? A. 1s22s22p2 B. 1s22s22p3 C. 1s22s22p1 D. 1s22s13d2 Câu 7. Dãy chất nào sau đây phản ứng được với cacbon? A.CuO, ZnO, CO2, H2, HNO3 đặc, H2SO4 đặc B. Al2O3, K2O, Ca, HNO3, H2SO4 đặc C. CuO, Na2O, CO2, HNO3 đặc, H2SO4 đặc. D.Ag2O, BaO, Al, HNO3 đặc, H2SO4 đặc, CO2 Câu 8. Dãy nguyên tố nào sau đây được sắp xếp theo chiều giảm dần của tính kim loại? \(\begin{array}{l}A.C,Si,Pb,S,Ge\\B.C,Pb,Sn,Ge,Si\end{array}\) \(\begin{array}{l}C.Pb,Sn,Ge,Si,C\\D.Pb,Sn,Si,Ge,C\end{array}\) II. PHẦN TỰ LUẬN Câu 9. Để đốt cháy 68 gam hỗn hợp hiđro và cacbon mono oxit cần 89,6 lít oxi (đktc). Xác định thành phần phần trăm theo thể tích của mỗi khí trong hỗn hợp ban đầu. Câu 10. Cho 32 gam oxit sắt tác dụng hoàn toàn với khí cacbon mono oxit thì thu được 22,4 gam sắt . Hỏi công thức phân tử của oxit sắt đem dùng là gì? Câu 11. Khi phân hủy 4,84 gam hỗn hợp NaHCO3 và KHCO3 thì thu được 0,56 lít khí CO2 (đktc). Xác định thành phần phần trăm mỗi muối trong hỗn hợp đầu và khối lượng hỗn hợp muối thu được sau phản ứng.
Lời giải chi tiết I. PHẦN TRẮC NGHIỆM
Câu 1: Ta có sơ đồ khảo sát như sau: \(\mathop {\left\{ \begin{array}{l}Fe\\FeO,F{e_3}{O_4}\\F{e_2}{O_3}\end{array} \right.}\limits_{17,6g} + \mathop {CO}\limits_{0,1mol} \to Fe + C{O_2}\) Ta có : n CO2 = n CO = 0,1 mol Áp dụng định luật bảo toàn khối lượng ta có: m Oxit + m CO = m Fe + m CO2 => 17,6 + 0,1 . 28 = m Fe + 0,1 . 44 => m Fe = 16 gam Đáp án C Câu 2: n CaCO3 = 0,1 mol TH1: Ca(OH)2 dư, CO2 phản ứng hết => Ca(OH)2 + CO2 → CaCO3 + H2O n CO2 = n CaCO3 = 0,1 mol => V CO2 = 2,24 lít TH2: CaCO3 tạo thành bị tan một phần Ta có phương trình phản ứng: Ca(OH)2 + CO2 → CaCO3 + H2O (1) Ca(OH)2 + 2 CO2 + H2O → Ca(HCO3)2 (2) (1) n Ca(OH)2 = n CaCO3 = 0,1 mol => (2) n Ca(OH)2 = n Ca(HCO3)2 = 0,1 mol (1), (2) => n CO2 = 0,1 + 0,1 . 2 = 0,3 mol => V CO2 = 0,3 . 22,4 = 6,72 lit Đáp án D Câu 3: n CaCO3 = n CO2 = 5 : 100 = 0,05 mol Ta có sơ đồ như sau: \(\left\{ \begin{array}{l}F{e_3}{O_4}\\CuO\end{array} \right. + CO \to \mathop {\left\{ \begin{array}{l}Fe\\Cu\end{array} \right.}\limits_{2,32gam} + \mathop {C{O_2}}\limits_{0,05mol} \)(1) (1) n CO2 = n CO = 0,05 mol Áp dụng định luật bảo toàn khối lượng ta có: a + m CO = 2,32 + m CO2 => a + 0,05 . 28 = 2,32 + 0,05 . 44 => a = 3,12 Đáp án A Câu 4: Ta có phương trình phản ứng: C+ O2 → CO2 S + O2 → SO2 => Sau phản ứng lượng khí có trong bình không đổi => Áp suất có trong bình cũng không thay đổi Đáp án B Câu 5: Hai dạng tồn tại khác nhau của cùng 1 đơn chất là 2 dạng thù hình Đáp án B Câu 6: Đáp án A Câu 7: Đáp án A Câu 8: Trong cùng một nhóm, xét theo chiều điện tích hạt nhân tăng dần, tính kim loại tăng dần Đáp án C II. PHẦN TỰ LUẬN Câu 9. Ta có: \({n_{{O_2}}} = \dfrac{{89,6}}{{22,4}} = 4\left( {mol} \right)\) Phản ứng: \(\begin{array}{l}2CO + {O_2} \to 2C{O_2}{\rm{ }}\left( 1 \right)\\2{H_2} + {O_2} \to 2{H_2}O{\rm{ }}\left( 2 \right)\end{array}\) Gọi x là số mol của O2 tham gia phản ứng (1) Suy ra, số mol O2 tham gia phản ứng (2) là (4 – x) mol Từ (1) và (2) \( \Rightarrow {n_{CO}} = 2x\left( {mol} \right);\)\(\,{n_{{H_2}}} = 2\left( {4 - x} \right)mol\) Mà: mhỗn hợp khí \( = {m_{{H_2}}} + {m_{CO}}\) \(\begin{array}{l} \Leftrightarrow 68 = 2 \times 2\left( {4 - x} \right) + 28 \times 2x\\ \Leftrightarrow 68 = 16 - 4x + 56x \Rightarrow x = 1\end{array}\) Vì là chất khí nên %V = %n Vậy: \(\% {V_{{H_2}}} = \% {n_{{H_2}}} = \dfrac{9}{8} \times 100\% = 75\% \) \(\% {V_{CO}} = \% {n_{CO}} = 100\% - 75\% = 25\% .\) Câu 10. Ta có: \({n_{Fe}} = \dfrac{{22,4}}{{56}} = 0,4\left( {mol} \right)\) \(\begin{array}{l}F{e_x}{O_y} + yCO \to xFe + yC{O_2}\\\left( {56x + 16y} \right)gam{\rm{ \;\;\;\;\;\;\;\;\;\;\;\;\;\; x mol}}\\{\rm{32 gam \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\; 0,4 mol}}\end{array}\) \( \Rightarrow \dfrac{{56x + 16y}}{{32}} = \dfrac{x}{{0,4}} \Rightarrow \dfrac{x}{y} = \dfrac{2}{3}\) Suy ra công thức oxit sắt là: Fe2O3. Câu 11. Ta có: \({n_{C{O_2}}} = \dfrac{{0,56}}{{22,4}} = 0,025\left( {mol} \right)\) Gọi a là số mol của NaHCO3 và b là số mol của KHCO3 Phản ứng:
Theo đề bài, ta có hệ phương trình: \(\left\{ \begin{array}{l}\dfrac{a}{2} + \dfrac{b}{2} = 0,025\\84a + 100b = 4,84\end{array} \right.\) Giải hệ phương trình, ta được: \(\left\{ \begin{array}{l}a = 0,01\\b = 0,04\end{array} \right.\) Vậy: \(\% {m_{NaHC{O_3}}} = \dfrac{{0,01 \times 84}}{{4,84}} \times 100\% \)\(\, = 17,36\% \) \(\% {m_{KHC{O_3}}} = \dfrac{{0,04 \times 100}}{{4,84}} \times 100\% \)\(\, = 82,64\% \) \( \Rightarrow \) mmuối \( = {m_{N{a_2}C{O_3}}} + {m_{{K_2}C{O_3}}} \)\(\,= \dfrac{a}{2}.106 + \dfrac{b}{2}.138 = 3,29\left( {gam} \right)\). Loigiaihay.com
|














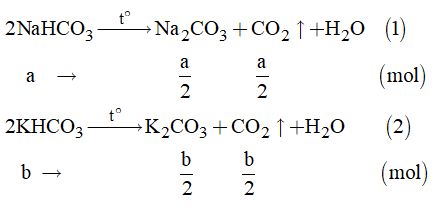






Danh sách bình luận