Đề kiểm tra 1 tiết (45 phút) - Đề số 3 - Chương VI - Hóa học 11Đáp án và lời giải chi tiết Đề kiểm tra 1 tiết (45 phút) - Đề số 3 - Chương VI - Hóa học 11 Quảng cáo
Đề bài I. PHẦN TRẮC NGHIỆM Câu 1. Khi oxi hóa một chất (X) bằng KMnO4/H2SO4 đun nóng thì sản phẩm thu được chỉ chứa các axit CH3COOH và HOOC-CH2CH2CH2COOH. Hỏi (X) là chất nào sau đây? \(\begin{array}{l}A.C{H_3} - {\left( {C{H_2}} \right)_2} - C \equiv CH\\B.C{H_3} - C \equiv C - C{H_2} - C{H_2} - C{H_2} - C \equiv C - C{H_3}\\C.C{H_3} - C \equiv C - C{H_2} - C{H_2} - C{H_2} - C \equiv CH\\D.HC \equiv C - C{H_2} - C{H_2} - C{H_2} - C \equiv CH\end{array}\)
Hỏi (X), (Y), (Z), (T) và (Q) lần lượt là dãy chất nào sau đây?
Câu 3. Dãy chất nào sau đây có thể điều chế buta-1,3-đien (đivinyl) bằng phản ứng trực tiếp? A.Ancol etylic; metan; butan B.Ancol etylic; butan; vinylaxetilen C.Butan; etin; isobutan D.Ancol etylic; isobutan; butan Câu 4. Dẫn 120ml hơi ancol etylic \(96^\circ \)(Dancol nguyên chất = 0,8 g/mol) qua chất xúc tác (ZnO + Al2O3) ở \(450 - 500^\circ C\) (biêts hiệu suất H = 90%) thì thu được a gam buta-1,3-đien.Giá trị của a là: A.60,0 gam B.54,0 gam C.48,6 gam D.5,4 gam Câu 5. Khi đốt cháy một anken thì số mol CO2 và nước có quan hệ như thế nào? A.\({n_{C{O_2}}} = {n_{{H_2}O}}\) B.\({n_{C{O_2}}} < {n_{{H_2}O}}\) C.\({n_{C{O_2}}} > {n_{{H_2}O}}\) D.\({n_{C{O_2}}} = 2{n_{{H_2}O}}\) Câu 6. Khí etilen cho phản ứng cộng với H2, Cl2, HCl,... là do nguyên nhân nào sau đây? A.Do phân tử etilen chứa hai nguyên tử C. B.Do trong cấu tạo phân tử etilen có một liên kết \(\pi \) kém bền C.Do phân tử etilen có cấu trúc phẳng. D.Do etilen là chất khí. Câu 7. Đốt cháy hoàn toàn 0,1 mol hiđrocacbon (Y) thu được 4,48 lít CO2 (đktc) và 3,6 gam H2O. Vậy (Y) có công thức phân tử là: A.C2H6 B.C2H4 C.C3H6 D.C4H8 Câu 8. Cho propen phản ứng cộng với HCl. Sản phẩm chính của phản ứng trên là chất nào sau đây? \(\begin{array}{l}A.C{H_2} - C{H_2} - C{H_2}Cl\\B.ClC{H_2} - C{H_2} - C{H_3}\\C.C{H_3} - CHCl - C{H_3}\\D.C{H_3} - C{H_2}Cl;C{H_3}Cl\end{array}\) II. PHẦN TỰ LUẬN Câu 9. Cho 2,24 lít (đktc) hỗn hợp hai anken là đồng đẳng kế tiếp nhau qua dung dịch nước brom, thấy khối lượng bình đựng brom tăng 5 gam. Xác định công thức phân tử của hai anken đem dùng. Câu 10. Một hỗn hợp A gồm 2 olefin khí là đồng đẳng kế tiếp nhau. Nếu người ta thấy khối lượng của bình tăng thêm 7 gam. a)Xác định công thức phân tử của các olefin. b)Tính thành phần phần trăm thể tích của hỗn hợp A. Lời giải chi tiết I. PHẦN TRẮC NGHIỆM
II. PHẦN TỰ LUẬN Câu 9. Ta có: \({n_{anken}} = \dfrac{{2,24}}{{22,4}} = 0,1\left( {mol} \right)\) Khối lượng bình đựng brom tăng chính là khối lượng của hỗn hợp anken\( \Rightarrow {C_{\overline n }}{H_{2\overline n }} = 5gam\) Và \({M_{{C_{\overline n }}{H_{2\overline n }}}} = 14\overline n = \dfrac{5}{{0,1}} = 50\) \(\Rightarrow \overline n = 3,57.\) Vậy CTHH là: C3H6 và C4H8. Câu 10. a) Xác định công thức của hai olefin: Ta có: \({n_A} = \dfrac{{PV}}{{RT}} = \dfrac{{2,5 \times 1,792}}{{\dfrac{{22,4}}{{273}} \times 273}} = 0,2\left( {mol} \right)\) Gọi công thức chung của 2 olefin là: \({C_{\overline n }}{H_{2\overline n }}:n < \overline n < n + 1\) Khối lượng bình đựng brom tăng chính là khối lượng của olefin mhỗn hợp olefin = 7 gam. Phân tử khối trung bình của hỗn hợp là: \(\overline M = \dfrac{7}{{0,2}} = 35\left( u \right)\) Mà: \(14\overline n = 35 \Rightarrow \overline n = 2,5\)\(\, \Rightarrow 1,5 < n < 2,5\) Vì n nguyên dương nên duy nhất \(n = 2 \Rightarrow \) hai anken là: C2H4 và C3H6 b) Tính thành phần phần trăm theo thể tích của mỗi khí trong A: \(\begin{array}{l}{C_2}{H_4} + B{r_2} \to {C_2}{H_4}B{r_2}{\rm{ }}\left( 3 \right)\\{\rm{ a }} \to a{\rm{ }}\left( {mol} \right)\\{C_3}{H_6} + B{r_2} \to {C_3}{H_6}B{r_2}{\rm{ }}\left( 4 \right)\\{\rm{ b }} \to {\rm{ b }}\left( {mol} \right)\end{array}\) Gọi a là số mol của C2H4 và b là số mol của C3H6 Theo đề bài, ta có hệ phương trình: \(\left\{ \begin{array}{l}a + b = 0,2\\28a + 42b = 7\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}a = 0,1\\b = 0,1\end{array} \right.\) Vì là chất khí nên %V = %n Vậy \(\% {V_{{C_2}{H_4}}} = \% {V_{{C_3}{H_6}}} = \dfrac{{0,1}}{{0,2}} \times 100\% = 50\% \) c) Xác định muối tạo thành và khối lượng tương ứng:
Ta có: \({n_{NaOH}} = 0,5 \times 1,8 = 0,9\left( {mol} \right)\) Từ (1) và (2) \( \Rightarrow \sum {{n_{C{O_2}}}} = 0,2 + 0,3 = 0,5\left( {mol} \right)\) Lập tỉ lệ: \(1 < \dfrac{{{n_{NaOH}}}}{{{n_{C{O_2}}}}} = \dfrac{{0,9}}{{0,5}} = 1,8 < 2\) Vậy khi dẫn khí CO2 vào dung dịch NaOH thu được hai muối là NaHCO3 và Na2CO3.
Gọi x, y là số mol CO2 tham gia phảm ứng (5) và (6) Giải hệ phương trình được: \(\left\{ \begin{array}{l}x = 0,4\\y = 0,1\end{array} \right.\) Vậy: \({m_{N{a_2}C{O_3}}} = 0,4 \times 106 = 42,4\left( {gam} \right)\) \({m_{NaHC{O_3}}} = 0,1 \times 84 = 8,4\left( {gam} \right).\) Loigiaihay.com
|














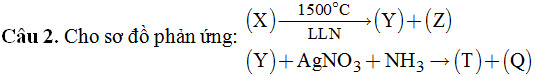






Danh sách bình luận