Đề thi giữa kì 1 Hóa 11 - Đề số 5Đề bài
Câu 1 :
Tính chất hóa học của NH3 là
Câu 2 :
Dãy gồm các ion không thể cùng tồn tại trong một dung dịch là
Câu 3 :
Nước cường toan là hỗn hợp của HNO3 đặc và HCl đặc có tỉ lệ thể tích lần lượt là :
Câu 4 :
Chất nào trong các chất sau đây không phải là chất lưỡng tính
Câu 5 :
Ở điều kiện thường, nitơ khá trơ về mặt hóa học là do
Câu 6 :
Thuốc thử để nhận biết các dung dịch : HCl, NaCl, Na3PO4, H3PO4 là
Câu 7 :
Khoáng vật chính của P trong tự nhiên là
Câu 8 :
Thêm 25 ml dung dịch NaOH 2M vào 100 ml dung dịch H2SO4. Đem dung dịch thu được cho tác dụng với dung dịch NaHCO3 dư thu được 5,6 lít CO2 (đktc). Nồng độ mol/lít của dung dịch H2SO4 ban đầu là:
Câu 9 :
Khi so sánh NH3 với NH4+, phát biểu đúng là
Câu 10 :
Trong phân bón hóa học, hàm lượng đạm, lân, kali được tính theo N, P2O5, K2O. Tính khối lượng N có trong 1 kg NH4NO3 ; K2O có trong 1 kg K2SO4 ; P2O5 có trong 1 kg Ca(H2PO4)2.
Câu 11 :
Cho NH3 dư vào 100ml dung dịch gồm CuSO4 1M ; ZnCl2 0,5M, AgNO3 1M và AlCl3 1M. Khối lượng kết tủa sau phản ứng là
Câu 12 :
Trong phòng thí nghiệm, người ta thu khí nitơ bằng phương pháp dời nước vì
Câu 13 :
Một dung dịch X chứa 0,01 mol Ba2+, 0,01 mol NO3-, a mol OH-, b mol Na+. Để trung hòa lượng dung dịch X này cần dùng 400 ml dung dịch HCl có pH = 1. Khối lượng chất rắn thu được sau khi cô cạn dung dịch X là:
Câu 14 :
Dung dịch có pH > 7 là
Câu 15 :
Để giảm độ chua của đất, bên cạnh việc sử dụng vôi, người ta có thể sử dụng một loại phân bón. Phân bón nào sau đây có khả năng làm giảm độ chua của đất?
Câu 16 :
Các loại phân lân đều cung cấp cho cây trồng nguyên tố
Câu 17 :
Trong dung dịch axit axetic (CH3COOH) có những phần tử nào sau đây:
Câu 18 :
Tính pH của dung dịch HCl 0,01M
Câu 19 :
Chất nào sau đây dẫn được điện?
Câu 20 :
Để nhận biết có ion NO3- trong dung dịch ta tiến hành bằng cách lấy dung dịch cho vào ống nghiệm tiếp theo:
Câu 21 :
Cho m gam hỗn hợp X (gồm Mg, Al, Zn và Cu) tác dụng hết với dung dịch HNO3 thu được dung dịch Y (không có muối amoni) và 11,2 lít (đktc) hỗn hợp khí Z (gồm N2, NO, N2O và NO2, trong đó N2 và NO2 có phần trăm thể tích bằng nhau) có tỉ khối đối với heli bằng 8,9. Số mol HNO3 phản ứng là
Câu 22 :
Chọn câu đúng khi nói về axit theo thuyết Arrehnius
Câu 23 :
Cho phản ứng Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O Để được 1 mol NO cần bao nhiêu mol HNO3 tham gia theo phản ứng trên?
Câu 24 :
Dung dịch X gồm 0,25 mol Ba2+; 1,3 mol Na+; a mol OH- và b mol Cl-. Cho 400 ml dung dịch Y gồm H2SO4 0,25M; HCl 0,25M và ZnSO4 1M vào dung dịch X. Sau khi các phản ứng kết thúc, thu được kết tủa G. Nung toàn bộ G đến khối lượng không đổi thu được 69,59 gam chất rắn H. Giá trị của b là:
Câu 25 :
Trộn lẫn hỗn hợp các ion sau: (I) K+, CO32-, S2- với H+, Cl-, NO3- (II) Na+, Ba2+, OH- với H+, Cl-, SO42- (III) NH4+, H+, SO42- với Na+, Ba2+, OH- (IV) H+, Fe2+, SO42- với Ba2+, K+, OH- (V) K+, Na+, HSO3- với Ba2+, Ca2+, OH- (VI) Cu2+, Zn2+, Cl- với K+, Na+, OH- Trường hợp có thể xảy ra 3 phản ứng là :
Câu 26 :
Dẫn khí CO qua ống sứ đựng 32 gam Fe2O3 nung nóng, sau một thời gian thu được 25,6 gam chất rắn. Thể tích khí CO (đktc) đã tham gia phản ứng là
Câu 27 :
Sục khí NH3 đến dư vào dung dịch nào dưới đây để thu được kết tủa?
Câu 28 :
Hòa tan 6g NaOH vào 44g nước được dd A có khối lượng riêng bằng 1,12g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
Câu 29 :
A là dung dịch HCl nồng độ 0,01M. Nồng độ của các ion trong dung dịch khi pha loãng A 100 lần là:
Câu 30 :
Đốt cháy 3,1 gam P bằng lượng dư O2, cho sản phẩm thu được vào nước, được 200 ml dung dịch X. Nồng độ mol/l của dung dịch X là
Lời giải và đáp án
Câu 1 :
Tính chất hóa học của NH3 là
Đáp án : C Lời giải chi tiết :
Tính chất hóa học của NH3 là vừa có tính khử, vừa có tính bazơ
Câu 2 :
Dãy gồm các ion không thể cùng tồn tại trong một dung dịch là
Đáp án : B Phương pháp giải :
Xem lại lí thuyết phản ứng trao đổi ion trong dung dịch chất điện li Lời giải chi tiết :
Dãy gồm các ion không thể cùng tồn tại trong một dung dịch là $N{a^ + },\,\,{K^ + },\,\,HSO_4^ - ,\,\,O{H^ - }$ Vì: HSO4- + OH- → SO42- + H2O
Câu 3 :
Nước cường toan là hỗn hợp của HNO3 đặc và HCl đặc có tỉ lệ thể tích lần lượt là :
Đáp án : D Phương pháp giải :
Xem lại lí thuyết axit nitric và muối nitrat Lời giải chi tiết :
Nước cường toan là hỗn hợp của HNO3 đặc và HCl đặc có tỉ lệ thể tích 1 : 3
Câu 4 :
Chất nào trong các chất sau đây không phải là chất lưỡng tính
Đáp án : D Lời giải chi tiết :
Chất không phải là chất có tính lưỡng tính là Al vì Al tác dụng với NaOH và HCl thay đổi số oxi hóa nên không coi là phản ứng axit – bazơ.
Câu 5 :
Ở điều kiện thường, nitơ khá trơ về mặt hóa học là do
Đáp án : C Lời giải chi tiết :
Ở điều kiện thường, nitơ khá trơ về mặt hóa học là do phân tử nitơ có liên kết ba khá bền.
Câu 6 :
Thuốc thử để nhận biết các dung dịch : HCl, NaCl, Na3PO4, H3PO4 là
Đáp án : B Phương pháp giải :
Xem lại lí thuyết axit photphoric và muối photphat Lời giải chi tiết :
Dùng dung dịch AgNO3 và quỳ tím
Câu 7 :
Khoáng vật chính của P trong tự nhiên là
Đáp án : D Lời giải chi tiết :
Khoáng vật chính của P trong tự nhiên là apatit 3Ca3(PO4)2.CaF2 và photphorit Ca3(PO4)2
Câu 8 :
Thêm 25 ml dung dịch NaOH 2M vào 100 ml dung dịch H2SO4. Đem dung dịch thu được cho tác dụng với dung dịch NaHCO3 dư thu được 5,6 lít CO2 (đktc). Nồng độ mol/lít của dung dịch H2SO4 ban đầu là:
Đáp án : A Phương pháp giải :
+) Dung dịch thu được tác dụng với NaHCO3 sinh khí CO2 => H+ dư sau phản ứng +) nH2SO4 ban đầu = nH2SO4 phản ứng với NaOH + nH2SO4 dư Lời giải chi tiết :
nNaOH = 0,05 mol Dung dịch thu được tác dụng với NaHCO3 sinh khí CO2 => H+ dư sau phản ứng 2NaHCO3 + H2SO4 → Na2SO4 + 2H2O + 2CO2 0,125 ← 0,25 2NaOH + H2SO4 → Na2SO4 + 2H2O 0,05 → 0,025 => nH2SO4 ban đầu = nH2SO4 phản ứng với NaOH + nH2SO4 dư = 0,025 + 0,125 = 0,15 mol => CM = 0,15 / 0,1 = 1,5M
Câu 9 :
Khi so sánh NH3 với NH4+, phát biểu đúng là
Đáp án : B Lời giải chi tiết :
Phát biểu đúng là: Trong NH3 và NH4+ đều có số oxi hóa – 3.
Câu 10 :
Trong phân bón hóa học, hàm lượng đạm, lân, kali được tính theo N, P2O5, K2O. Tính khối lượng N có trong 1 kg NH4NO3 ; K2O có trong 1 kg K2SO4 ; P2O5 có trong 1 kg Ca(H2PO4)2.
Đáp án : C Phương pháp giải :
+) Tính số mol theo sơ đồ sau: NH4NO3 → 2N K2SO4 → K2O Ca(H2PO4)2 → P2O5 Lời giải chi tiết :
Câu 11 :
Cho NH3 dư vào 100ml dung dịch gồm CuSO4 1M ; ZnCl2 0,5M, AgNO3 1M và AlCl3 1M. Khối lượng kết tủa sau phản ứng là
Đáp án : C Phương pháp giải :
Vì các ion Cu2+, Zn2+, Ag+ tạo kết tủa với NH3, sau đó kết tủa tan trong NH3 dư tạo phức => kết tủa thu được chỉ gồm Al(OH)3 +) nAl(OH)3 = nAlCl3 Lời giải chi tiết :
Vì các ion Cu2+, Zn2+, Ag+ tạo kết tủa với NH3, sau đó kết tủa tan trong NH3 dư tạo phức => kết tủa thu được chỉ gồm Al(OH)3 nAl(OH)3 = nAlCl3 = 0,1 mol => m = 7,8 gam
Câu 12 :
Trong phòng thí nghiệm, người ta thu khí nitơ bằng phương pháp dời nước vì
Đáp án : B Lời giải chi tiết :
Trong phòng thí nghiệm, người ta thu khí nitơ bằng phương pháp dời nước vì N2 rất ít tan trong nước.
Câu 13 :
Một dung dịch X chứa 0,01 mol Ba2+, 0,01 mol NO3-, a mol OH-, b mol Na+. Để trung hòa lượng dung dịch X này cần dùng 400 ml dung dịch HCl có pH = 1. Khối lượng chất rắn thu được sau khi cô cạn dung dịch X là:
Đáp án : A Phương pháp giải :
+) $a={{n}_{O{{H}^{-}}}}={{n}_{{{H}^{+}}}}$ BTĐT: $2{{n}_{B{{a}^{2+}}}}+{{n}_{N{{a}^{+}}}}={{n}_{NO_{3}^{-}}}+{{n}_{O{{H}^{-}}}}$ => b Lời giải chi tiết :
$a={{n}_{O{{H}^{-}}}}={{n}_{{{H}^{+}}}}=0,1.0,4=0,04\text{ }mol$ BTĐT: $2{{n}_{B{{a}^{2+}}}}+{{n}_{N{{a}^{+}}}}={{n}_{NO_{3}^{-}}}+{{n}_{O{{H}^{-}}}}~\Rightarrow 2.0,01+b=0,01+0,04$ => b = 0,03 m chất rắn = 0,01.137 + 0,01.62 + 0,04.17 + 0,03.23 = 3,36 gam
Câu 14 :
Dung dịch có pH > 7 là
Đáp án : D Phương pháp giải :
pH > 7 => chọn dung dịch có môi trường bazo Lời giải chi tiết :
pH > 7 => dung dịch có môi trường bazo => đó là dd NH3
Câu 15 :
Để giảm độ chua của đất, bên cạnh việc sử dụng vôi, người ta có thể sử dụng một loại phân bón. Phân bón nào sau đây có khả năng làm giảm độ chua của đất?
Đáp án : B Phương pháp giải :
Đất nhiễm chua tức là dư môi trường axit (dư H+) do vậy ta có thể chọn phânđể trung hòa bớt lượng axit dư Lời giải chi tiết :
Đất nhiễm chua tức là dư môi trường axit (dư H+) do vậy ta có thể bón Ca3(PO4)2 để trung hòa bớt lượng axit dư trong đất từ đó giảm được độ chua của đất
Câu 16 :
Các loại phân lân đều cung cấp cho cây trồng nguyên tố
Đáp án : B Phương pháp giải :
Ghi nhớ các loại phân bón hóa học Phân lân: cung cấp P Phân đạm: cung cấp N Phân kali: cung cấp K Lời giải chi tiết :
Phân lân cung cấp cho cây trồng nguyên tố photpho
Câu 17 :
Trong dung dịch axit axetic (CH3COOH) có những phần tử nào sau đây:
Đáp án : B Phương pháp giải :
Viết phương trình điện ly và từ phương trình điện ly để rút ra kết luận. Lời giải chi tiết :
Phương trình điện ly: CH3COOH \( \rightleftharpoons \)CH3COO- + H+ \( \to \) Trong dung dịch axit axetic (CH3COOH) có chứa : CH3COOH, H+, CH3COO-, H2O. Chú ý
trong dung dịch có thêm H2O
Câu 18 :
Tính pH của dung dịch HCl 0,01M
Đáp án : C Phương pháp giải :
pH = -log[H+] Lời giải chi tiết :
Sự phân li của nước là không đáng kể [H+] = Ca = 0,01 => pH = - lg[H+] = 2
Câu 19 :
Chất nào sau đây dẫn được điện?
Đáp án : A Lời giải chi tiết :
Dung dịch NaCl có các ion Na+ và Cl- chuyển động tự do nên có khả năng dẫn điện. Chú ý
Những chất ở trạng thái rắn, khan không dẫn điện được.
Câu 20 :
Để nhận biết có ion NO3- trong dung dịch ta tiến hành bằng cách lấy dung dịch cho vào ống nghiệm tiếp theo:
Đáp án : D Lời giải chi tiết :
A loại vì H2SO4 đặc không phản ứng với NO3- B loại vì không phản ứng C loại vì phản ứng có thể tạo NH4NO3 ta không quan sát được hiện tượng D đúng vì tạo dung dịch màu xanh và khí không màu hóa nâu trong không khí PTHH: 3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
Câu 21 :
Cho m gam hỗn hợp X (gồm Mg, Al, Zn và Cu) tác dụng hết với dung dịch HNO3 thu được dung dịch Y (không có muối amoni) và 11,2 lít (đktc) hỗn hợp khí Z (gồm N2, NO, N2O và NO2, trong đó N2 và NO2 có phần trăm thể tích bằng nhau) có tỉ khối đối với heli bằng 8,9. Số mol HNO3 phản ứng là
Đáp án : C Phương pháp giải :
HS ghi nhớ công thức tính nhanh số mol HNO3 đã phản ứng: nHNO3 = 12nN2 + 2nNO2 + 4nNO + 10nN2O = 12x + 2x + 4y + 10z = 14x + 4y +10z (*) Lời giải chi tiết :
nHNO3 = 12nN2 + 2nNO2 + 4nNO + 10nN2O = 12x + 2x + 4y + 10z = 14x + 4y +10z (*) *nZ = 2x + y + z = 0,5 mol (1) *mZ = nZ.MZ => 28x + 44x + 30y + 44z = 0,5.8,9.4 => 74x + 30y + 44z = 17,8 (2) \(\xrightarrow{{\dfrac{3}{7}(2) - \dfrac{{62}}{7}(1)}}14x + 4y + 10z = 3,2\)(**) (*) và (**) => nHNO3 = 3,2 mol
Câu 22 :
Chọn câu đúng khi nói về axit theo thuyết Arrehnius
Đáp án : C Lời giải chi tiết :
Theo thuyết Arrehnius, axit là chất khi tan trong nước phân ly ra cation H+
Câu 23 :
Cho phản ứng Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O Để được 1 mol NO cần bao nhiêu mol HNO3 tham gia theo phản ứng trên?
Đáp án : A Lời giải chi tiết :
→ 3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO + 14H2O
Câu 24 :
Dung dịch X gồm 0,25 mol Ba2+; 1,3 mol Na+; a mol OH- và b mol Cl-. Cho 400 ml dung dịch Y gồm H2SO4 0,25M; HCl 0,25M và ZnSO4 1M vào dung dịch X. Sau khi các phản ứng kết thúc, thu được kết tủa G. Nung toàn bộ G đến khối lượng không đổi thu được 69,59 gam chất rắn H. Giá trị của b là:
Đáp án : D Phương pháp giải :
Áp dụng định luật bảo toàn điện tích dung dịch X. Xét Y: \({{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{4}}}^{{\rm{2 - }}}}}{\rm{ = 0,5 mol}};{\rm{ }}{{\rm{n}}_{{H^{\rm{ + }}}}}{\rm{ = 0,3 mol; }}{{\rm{n}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}}}{\rm{ = 0,4 mol;}}\) Khi cho X + Y => \({{\rm{n}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}}{\rm{ = }}{{\rm{n}}_{B{a^{{\rm{2 + }}}}}}{\rm{ = 0,25 mol}}\) Sau khi nung thu được H. ta có: \({{\rm{m}}_{\rm{H}}}{\rm{ = }}{{\rm{m}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}}{\rm{ + }}{{\rm{m}}_{{\rm{ZnO}}}} \Rightarrow {{\rm{n}}_{{\rm{ZnO}}}} = {{\rm{n}}_{{\rm{Zn(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 0,14 mol}}\) Xét 2 trường hợp : Trường hợp 1: Tạo kết tủa và kết tủa không tan Trường hợp 2: Kết tủa tan một phần Lời giải chi tiết :
Xét X: Theo ĐLBTĐT ta có: 0,25.2 + 1,3 = a + b = 1,8 mol Xét Y: \({{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{4}}}^{{\rm{2 - }}}}}{\rm{ = 0,5 mol}};{\rm{ }}{{\rm{n}}_{{H^{\rm{ + }}}}}{\rm{ = 0,3 mol; }}{{\rm{n}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}}}{\rm{ = 0,4 mol;}}\) Khi cho X + Y => \({{\rm{n}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}}{\rm{ = }}{{\rm{n}}_{B{a^{{\rm{2 + }}}}}}{\rm{ = 0,25 mol}}\) Sau khi nung thu được H. ta có: \({{\rm{m}}_{\rm{H}}}{\rm{ = }}{{\rm{m}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}}{\rm{ + }}{{\rm{m}}_{{\rm{ZnO}}}} \Rightarrow {{\rm{n}}_{{\rm{ZnO}}}} = {{\rm{n}}_{{\rm{Zn(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 0,14 mol}}\) Trường hợp 1: Tạo kết tủa và kết tủa không tan => OH- hết \( \Rightarrow a = {{\rm{n}}_{{H^ + }}}{\rm{ + 2}}{{\rm{n}}_{{\rm{Zn(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 0,58 mol; b = 1,22 mol}}\) Trường hợp 2: Kết tủa tan một phần \( \Rightarrow a = {{\rm{n}}_{{H^ + }}}{\rm{ + 4}}{{\rm{n}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}}} - {\rm{2}}{{\rm{n}}_{{\rm{Zn(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 1,62 mol; b = 0,18 mol}}\)
Câu 25 :
Trộn lẫn hỗn hợp các ion sau: (I) K+, CO32-, S2- với H+, Cl-, NO3- (II) Na+, Ba2+, OH- với H+, Cl-, SO42- (III) NH4+, H+, SO42- với Na+, Ba2+, OH- (IV) H+, Fe2+, SO42- với Ba2+, K+, OH- (V) K+, Na+, HSO3- với Ba2+, Ca2+, OH- (VI) Cu2+, Zn2+, Cl- với K+, Na+, OH- Trường hợp có thể xảy ra 3 phản ứng là :
Đáp án : B Phương pháp giải :
Dựa vào điều kiện phản ứng xảy ra trong dung dịch để tìm các trường hợp xảy ra phản ứng, chú ý một số hiđroxit lưỡng tính. Lời giải chi tiết :
(III) NH4+, H+, SO42- với Na+, Ba2+, OH- H+ + OH- → H2O Ba2+ + SO42- → BaSO4 NH4+ + OH- → NH3 + H2O (IV) H+, Fe2+, SO42- với Ba2+, K+, OH- H+ + OH- → H2O Ba2+ + SO42- → BaSO4 Fe2+ + 2OH- → Fe(OH)2 (V) K+, Na+, HSO3- với Ba2+, Ca2+, OH- HSO3- + OH- → SO32- + H2O Ba2+ + SO32- → BaSO3 Ca2+ + SO32- → CaSO3 (VI) Cu2+, Zn2+, Cl- với K+, Na+, OH- Cu2+ + 2OH- → Cu(OH)2 Zn2+ + 2OH- → Zn(OH)2 Zn(OH)2 + 2OH- → ZnO22- + 2H2O
Câu 26 :
Dẫn khí CO qua ống sứ đựng 32 gam Fe2O3 nung nóng, sau một thời gian thu được 25,6 gam chất rắn. Thể tích khí CO (đktc) đã tham gia phản ứng là
Đáp án : D Phương pháp giải :
- Khối lượng chất rắn giảm là khối lượng O bị lấy đi → mO phản ứng - Phản ứng khử oxit bằng CO viết gọn là: CO + O → CO2 → nCO phản ứng = nO phản ứng Lời giải chi tiết :
Khối lượng chất rắn giảm là khối lượng O bị lấy đi → \({m_{O(pu)}} = 32 - 25,6 = 6,4(g)\) Phản ứng khử oxit bằng CO viết gọn là: CO + O → CO2 \( \to {n_{CO(pu)}} = {n_{O(pu)}} = \frac{{6,4}}{{16}} = 0,4(mol) \to {V_{CO}} = 0,4.22,4 = 8,96(l)\)
Câu 27 :
Sục khí NH3 đến dư vào dung dịch nào dưới đây để thu được kết tủa?
Đáp án : D Lời giải chi tiết :
AlCl3 + 3NH3 + 3H2O → Al(OH)3 ↓ + 3NH4Cl CuCl2 + 2NH3 + 2H2O → Cu(OH)2 ↓ + 2NH4Cl Cu(OH)2 + 4NH3 -> [Cu(NH3)4](OH)2 (tan)
Câu 28 :
Hòa tan 6g NaOH vào 44g nước được dd A có khối lượng riêng bằng 1,12g/ml. Cần lấy bao nhiêu ml A để có số mol ion OH– bằng 2.10–3 mol
Đáp án : C Lời giải chi tiết :
\({m_{{\rm{dd}}}} = {m_{NaOH}} + {m_{{H_2}O}} = 6 + 44 = 50(g)\) \( \to {V_{dd}} = m:d = 50:1,12 = \frac{{625}}{{14}}ml\) \({n_{NaOH}} = \frac{6}{{40}} = 0,15(mol)\) \( \to {C_{MNaOH}} = n:{V_{dd}} = \frac{{0,15}}{{\frac{{625}}{{14}}{{.10}^{ - 3}}}} = 3,36(M)\) NaOH → Na+ + OH− Theo pt: nNaOH = nOH- = 2.10-3 (mol) ⟹ Thể tích dd A cần lấy là: V = n : CM = 2.10-3 : 3,36 = 6.10-4 (l) = 0,6 (ml)
Câu 29 :
A là dung dịch HCl nồng độ 0,01M. Nồng độ của các ion trong dung dịch khi pha loãng A 100 lần là:
Đáp án : B Lời giải chi tiết :
Khi pha loãng dung dịch 100 lần thì nồng độ các ion trong dung dịch cũng giảm 100 lần HCl→H+ + Cl− Trước khi pha loãng: $${\rm{[}}{{\rm{H}}^ + }{\rm{]}} = {\rm{[C}}{{\rm{l}}^ - }{\rm{]}} = 0,01M$$ Sau khi pha loãng: $${\rm{[}}{{\rm{H}}^ + }{\rm{]}} = {\rm{[C}}{{\rm{l}}^ - }{\rm{]}} = 1,{0.10^{ - 4}}M$$
Câu 30 :
Đốt cháy 3,1 gam P bằng lượng dư O2, cho sản phẩm thu được vào nước, được 200 ml dung dịch X. Nồng độ mol/l của dung dịch X là
Đáp án : D Phương pháp giải :
Viết PTHH và tính toán theo PTHH Lời giải chi tiết :
nP = 3,1/31 = 0,1 mol. 4P + 5O2 → 2P2O5 P2O5 + 3H2O → 2H3PO4 Theo PTHH ⟹ \({n_{{H_3}P{O_4}}} = {n_P} = 0,1\) mol ⟹ CM(H3PO4) = n/V = 0,5M |














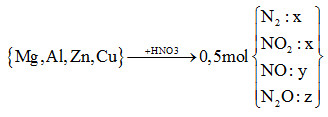





Danh sách bình luận