Lý thuyết Tính chất hóa học của axit.Axit làm đổi màu chất chỉ thị Quảng cáo
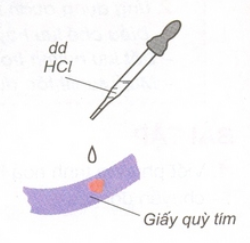
I. Tính chất hóa học của axit: 1. Axit làm đổi màu chất chỉ thị: Dung dịch axit làm đổi màu quỳ tím thành đỏ.
2. Axit tác dụng với kim loại - Dung dịch axit tác dụng được với một số kim loại tạo thành muối và giải phóng khí hiđro - Dãy hoạt động hóa học $K$, $Na$, $Ba$, $Ca$, $Mg$, $Al$, $Zn$, $Fe$, $Ni$, $Sn$, $H$, $Cu$, $Hg$, $Ag$, $Pt$, $Au$. - Điều kiện: kim loại đứng trước $H$ trong dãy hoạt động hóa học của kim loại thì tác dụng với axit. Thí dụ: 3H2SO4 (dd loãng) + 2Al → Al2(SO4)3 + 3H2 2HCl + Fe → FeCl2 + H2 Chú ý: Axit HNO3 và H2SO4 đặc tác dụng được với nhiều kim loại nhưng không giải phóng hiđro. 3. Axit tác dụng với bazơ tạo thành muối và nước Thí dụ: H2SO4 + Cu(OH)2 → CuSO4 + 2H2O - Phản ứng của axit với bazơ được gọi là phản ứng trung hòa. 4. Axit tác dụng với oxit bazơ tạo thành muối và nước. Thí dụ: Fe2O3 + 6HCl → FeCl3 + 3H2O Ngoài ra, axit còn tác dụng với muối Thí dụ: MgCO3 + 2HCl → MgCl2 + CO2 ↑ + H2O Na2SO3 + 2HCl → 2NaCl + SO2 ↑ + H2O II. Axit mạnh và axit yếu Dựa vào khả năng phản ứng, axit được chia làm 2 loại: + Axit mạnh như HCl, H2SO4, HNO3,… + Axit yếu như H2S, H2CO3,… Sơ đồ tư duy: Tính chất hóa học của axit.
+ Axit yếu: H2CO3, H2SO3, H3PO4, H2S
|





















Danh sách bình luận