Giải đề thi hết học kì II năm học 2017 - 2018 phòng GD-DT thành phố HuếĐề thi hết học kì II năm học 2017 - 2018 phòng GD-DT thành phố Huế có đáp án và lời giải chi tiết Quảng cáo
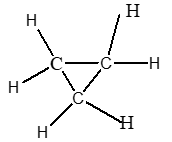
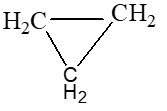
Đề bài Câu 1 : 1. Bằng phương pháp hóa học hãy loại bỏ khí axetilen có lẫn trong metan để thu được khí metan tinh khiết. Viết phương trình hóa học xảy ra. 2. Viết công thức cấu tạo (đầy đủ và thu gọn) của các chất có công thức phân tử sau: C3H8, C3H6 (mạch vòng). Câu 2 : Có các chất sau: C2H5OH, CH3COOH, C6H6, (C15H31COO)3C3H5. a) Chất nào tan được trong nước? Chất nào làm đổi màu quỳ tím hóa đỏ? b) Chất nào tác dụng được với nhau khi đun nóng và có axit sunfuric đặc xúc tác? c) Chất nào làm mất màu brom lỏng nguyên chất? d) Chất nào có phản ứng thủy phân trong dung dịch axit? Viết các phương trình hóa học xảy ra, ghi rõ điều kiện nếu có. Câu 3 : Nêu hiện tượng và viết phương trình hóa học xảy ra khi: 1. Dẫn khí etilen qua dung dịch brom. 2. Cho mẩu canxi cacbua vào nước. Câu 4 : Cho 240 gam dung dịch axit axetic tác dụng với lượng dư canxi cacbonat. Sau phản ứng thu được 5,6 lít khí cacbonic ở đktc. a) Viết phương trình phản ứng xảy ra. b) Tính nồng độ % dung dịch axit axetic đã dùng. c) Tính thể tích rượu etylic 400 cần dùng để điều chế lượng axit axetic trên biết khối lượng riêng của rượu D = 0,8 g/ml. Cho biết: C = 12; H = 1; O = 16; Ca = 40. ------HẾT------ Lời giải chi tiết Câu 1: Phương pháp: 1. Dựa vào tính chất hóa học khác nhau của axetilen và metan, đưa ra được chất mà khi cho vào hh khí chỉ có axetilen phản ứng, còn metan không phản ứng, từ đó ta sẽ thu được metan tinh khiết. 2. Dựa vào kiến thức học về cách viết công thức hóa học hữu cơ. Đảm bảo cacbon hóa trị IV, hidro hóa trị I Hướng dẫn giải: 1. Dẫn hỗn hợp khí axetilen và metan qua dung dịch nước Br2 dư, khi đó khí axetilen sẽ bị giữ lại, còn khí metan không có phản ứng với dd Br2 sẽ thoát ra ngoài, từ đó ta thu được khí metan tinh khiết PTHH: C2H2 + 2Br2 → C2H2Br4 2.
Câu 2: Phương pháp: Dựa vào tính chất vật lí và tính chất hóa học đã được học về các chất trên. Hướng dẫn giải: a) Các chất tan được trong nước là: C2H5OH, CH3COOH Chất làm quỳ tím chuyển sang màu đỏ là: CH3COOH b) Các chất tác dụng được với nhau khi đun nóng và có axit sunfuric đặc xúc tác là C2H5OH và CH3COOH CH3COOH + C2H5OH \(\underset{{}}{\overset{{{H}_{2}}S{{O}_{4}}dac,{{t}^{0}}}{\longleftrightarrow}}\) CH3COOC2H5 + H2O c) C6H6 tác dụng với Br2 lỏng nguyên chất khi có mặt xúc tác C6H6 + Br2 \(\xrightarrow{bot\,Fe}\) C6H5Br + HBr d) chất có phản ứng thủy phân trong môi trường axit là: (C15H31COO)3C3H5. (C15H31COO)3C3H5 + 3H2O \(\xrightarrow{axit}\) 3C15H31COOH + C3H5(OH)3 Câu 3: Phương pháp: Hiện tượng quan sát được là những gì có thể thấy rõ được bằng mắt thường như sự thay đổi về màu sắc, chất rắn tan hay không tan, có xuất hiện kết tủa hay không; có khí thoát ra hay không .... Hướng dẫn giải: 1. Hiện tượng: dung dịch brom nhạt màu dần đến mất màu nâu, do axetilen phản ứng với dung dịch brom theo: PTHH: C2H2 + 2Br2 → C2H2Br4 (màu nâu đỏ) (không màu) 2. Hiện tượng: canxicacbua tan, đồng thời xuất hiện nhiều bọt khí không màu thoát ra ngoài, phản ứng có tỏa nhiệt PTHH: CaC2 + 2H2O → Ca(OH)2 + C2H2↑ Câu 4: Phương pháp: a) Viết PTHH xảy ra: axit + muối → muối mới + axit mới (đk: tạo ra chất kết tủa hoặc bay hơi) b) Dựa vào PTHH viết ở phần a, tính được mol axit axetic pư theo số mol CO2, từ đó tính được khối lượng của axit axetic. áp dụng công thức: \(C\% C{H_3}COOH = \frac{{{m_{C{H_3}COOH}}}}{{{m_{dd\,C{H_3}COOH}}}}.100\% \) ta sẽ tìm ra được nồng độ của axit c) Viết PTHH của rượu etylic phản ứng lên men giấm để tạo ra axit axetic. Từ PTHH tính được mol rượu pư => khối lượng rượu áp dụng công thức: mC2H5OH = VC2H5OH. DC2H5OH → VC2H5OH =? Có độ rượu = 400 →\({V_{dd{C_2}{H_5}OH}} = \frac{{{V_{{C_2}{H_5}OH}}}}{{{{40}^0}}}{.100^0} = ?\) Hướng dẫn giải: Số mol của khí cacbonic sinh ra là: \({n_{C{O_2}(dktc)}} = \frac{{{V_{CO2}}}}{{22,4}} = \frac{{5,6}}{{22,4}} = 0,25\,\,(mol)\) a) PTHH: 2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2↑ + H2O b) Theo PTHH: nCH3COOH pư = nCO2 = 0,25 (mol) → Khối lượng của CH3COOH là: 0,25 × 60 = 15 (g) → Nồng độ phần trăm của dung dịch đã dùng là: \(C\% C{H_3}COOH = \frac{{{m_{C{H_3}COOH}}}}{{{m_{dd\,C{H_3}COOH}}}}.100\% = \frac{{15}}{{240}}.100\% = 6,25\% \) c) PTHH: C2H5OH + O2 \(\xrightarrow{men\,giam}\) CH3COOH + H2O Theo PTHH: nC2H5OH = nCH3COOH = 0,25 (mol) → Khối lượng của C2H5OH là: mC2H5OH = 0,25× 46 = 11,5 (g) → Khối lượng nguyên chất của rượu là: VC2H5OH = mC2H5OH: DC2H5OH = 11,5 : 0,8 = 14,375 (ml) → Thể tích dung dịch rượu 400 cần lấy để điều chế lượng axit trên là: \({V_{dd{C_2}{H_5}OH}} = \frac{{{V_{{C_2}{H_5}OH}}}}{{{{40}^0}}}{.100^0} = \frac{{14,375}}{{{{40}^0}}}{.100^0} = 35,9375\,(ml)\) Loigiaihay.com |




















Danh sách bình luận