Đề thi học kì 1 Hóa 11 - Đề số 5Đề bài
Câu 1 :
Nhóm nitơ gồm những nguyên tố nào ?
Câu 2 :
Kết luận nào sau đây là đúng ?
Câu 3 :
Khử hoàn toàn 17,6 gam hỗn hợp gồm Fe, FeO, Fe2O3 cần 4,48 lít H2 (đktc). khối lượng sắt thu được là
Câu 4 :
So với photpho đỏ thì photpho trắng có hoạt tính hoá học
Câu 5 :
Phần trăm về khối lượng của nguyên tố N trong (NH2)2CO là :
Câu 6 :
Thêm từ từ từng giọt của 100 ml dung dịch chứa Na2CO3 1,2M và NaHCO3 0,6M vào 200 ml dung dịch HCl 1M, sau phản ứng hoàn toàn thu được dung dịch X. Cho dung dịch nước vôi trong dư vào dung dịch X thì thu được bao nhiêu gam kết tủa ?
Câu 7 :
Phản ứng dùng để khắc hình, khắc chữ lên thủy tinh là phản ứng giữa SiO2 với:
Câu 8 :
Cho dung dịch NH3 dư vào dung dịch chứa FeCl3, CuCl2, AlCl3, ZnSO4, MgCl2 thu được kết tủa Y. Thành phần của Y gồm
Câu 9 :
Ở các vùng đất phèn người ta bón vôi để làm
Câu 10 :
Hoà tan hết hỗn hợp X gồm Zn và ZnO trong dung dịch HNO3 loãng dư thấy không có khí bay ra và trong dung dịch chứa 113,4 gam Zn(NO3)2 và 8 gam NH4NO3. Phần trăm khối lượng Zn trong X là
Câu 11 :
Chất nào sau đây có đồng phân hình học?
Câu 12 :
Dung dịch nào sau đây có môi trường kiềm
Câu 13 :
Hỗn hợp X gồm N2 và H2 có ${{\overline{M}}_{X}}=12,4.$ Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết rằng hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. ${{\overline{M}}_{Y}}$ có giá trị là
Câu 14 :
Một dung dịch có chứa các ion sau: Ba2+, Ca2+, Mg2+, Na+, H+, Cl-. Để tách được nhiều cation ra khỏi dung dịch mà không đưa thêm ion mới vào thì ta có thể cho dung dịch tác dụng với dung dịch nào sau đây?
Câu 15 :
Hòa tan hoàn toàn 1,28 g Cu vào 12,6 gam dd HNO3 60% thu được dung dịch X. Cho X tác dụng hoàn toàn với 105ml dung dịch KOH 1M, sau đó lọc bỏ kết tủa thu được dung dịch Y. Cô cạn Y được chất rắn Z. Nung Z đến khối lượng không đổi, thu được 8,78 gam chất rắn. Nồng độ phần trăm của Cu(NO3)2 trong X là:
Câu 16 :
Cho các phản ứng hóa học sau: (1) (NH4)2SO4 + BaCl2 (2) CuSO4 + Ba(NO3)2 (3) Na2SO4 + BaCl2 (4) H2SO4 + BaSO3 (5) (NH4)2SO4 + Ba(OH)2 (6) Fe2(SO4)3 + Ba(NO3)2 Các phản ứng đều có cùng một phương trình ion thu gọn là
Câu 17 :
Nung nóng hoàn toàn 27,3 gam hổn hợp NaNO3, Cu(NO3)2. Hỗn hợp khí thoát ra được dẫn vào nước dư thấy có 1,12 lít khí (ở đktc) không bị hấp thụ, khối lượng Cu(NO3)2 trong hỗn hợp ban đầu là
Câu 18 :
Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là
Câu 19 :
Khi sục từ từ đến dư khí CO2 vào dung dịch hỗn hợp chứa a mol Ca(OH)2 và b mol NaOH. Kết quả thí nghiệm được biểu diễn trên đồ thị sau: 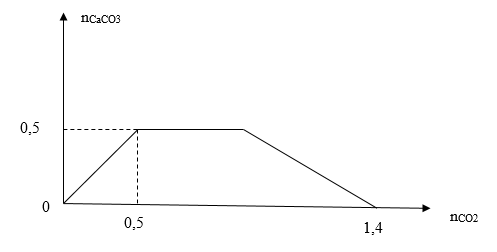 Tỉ lệ a: b là
Câu 20 :
Câu nào sau đây đúng khi nói về sự điện li?
Câu 21 :
Tính pH của dung dịch gồmNaOH 10-3M và NH3 10-2M (NH3 có Kb = 1,8.10-5 )
Câu 22 :
Khi đốt cháy chất hữu cơ X bằng oxi tinh khiết thu được hỗn hợp khí và hơi gồm CO2, H2O, N2. Điều đó chứng tỏ phân tử chất X
Câu 23 :
Dung dịch nào sau đây không tác dụng với dung dịch HCl loãng?
Câu 24 :
Một chất Y có tính chất sau: - Không màu, rất độc. - Cháy trong không khí với ngọn lửa màu xanh và sinh ra chất khí làm đục nước vôi trong. Y là:
Câu 25 :
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng (a) bông khô (b) bông có tẩm nước (c) bông có tẩm nước vôi trong (d) bông có tẩm giấm ăn Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là:
Câu 26 :
Trong phòng thí nghiệm, khí CO được điều chế bằng phản ứng
Câu 27 :
Một chất có CTĐGN là CH3. CTPT chất đó là
Câu 28 :
Hợp chất hữu cơ là hợp chất của nguyên tố
Câu 29 :
Để thu được muối trung hòa, cần bao nhiêu ml dung dịch NaOH 1M cho tác dụng với 50 ml dung dịch H3PO4 0,5M
Câu 30 :
Cho 20 gam NaOH vào dung dịch chứa 39,2 gam H3PO4. Hỏi muối nào được tạo thành? Khối lượng là bao nhiêu ?
Câu 31 :
Phải thêm bao nhiêu ml dung dịch HCl 1M vào 90 ml nước để được dung dịch có pH = 1?
Câu 32 :
Một dung dịch chứa 0,02 mol Cu2+, 0,03 mol K+, x mol Cl– và y mol SO42–. Tổng khối lượng các muối tan có trong dung dịch là 5,435 gam. Giá trị của x và y lần lượt là ?
Câu 33 :
Axit nitric đặc , nóng phản ứng được với tất cả các chất trong nhóm nào sau đây?
Câu 34 :
Đốt cháy 200 ml hơi một hợp chất hữu cơ X chứa C, H, O trong 900 ml O2, thể tích hỗn hợp khí thu được là 1,3 lít. Sau khi ngưng tụ hơi nước chỉ còn 700 ml. Tiếp theo cho qua dung dịch KOH dư chỉ còn 100 ml khí bay ra. Các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất. Công thức phân tử của Y là
Câu 35 :
Trộn 100 ml dung dịch natri nitrit 3M với 300 ml dung dịch amoni clorua 1,6M đun nóng đến phản ứng hoàn toàn. Thể tích khí N2 sinh ra và nồng độ mol các muối trong dung dịch sau phản ứng là:
Câu 36 :
Ứng dụng phổ biến nhất của amoni nitrat là làm phân bón, thuốc nổ quân sự. Amoni nitrat có công thức hóa học là
Câu 37 :
Cho các chất: O2 (1),CO2 (2), H2 (3), Fe2O3 (4), SiO2 (5), HCl (6), CaO (7), H2SO4 đặc (8), HNO3 (9), H2O (10), KMnO4 (11). Cacbon phản ứng trực tiếp được với bao nhiêu chất?
Câu 38 :
Dung dịch chất nào sau đây làm quỳ tím hóa xanh?
Câu 39 :
Chọn phát biểu đúng trong số các phát biểu sau đây ?
Câu 40 :
Cho m gam P2O5 tác dụng với 500 ml dung dịch KOH 1M. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X (không chứa H3PO4), cô cạn dung dịch X thu được 193m/71 gam chất rắn khan. Nếu cho X tác dụng với dung dịch BaCl2 dư thì thu được bao nhiêu gam kết tủa?
Lời giải và đáp án
Câu 1 :
Nhóm nitơ gồm những nguyên tố nào ?
Đáp án : B Phương pháp giải :
Xem lại lí thuyết nitơ Lời giải chi tiết :
Nhóm nitơ gồm N, P, As, Sb, Bi.
Câu 2 :
Kết luận nào sau đây là đúng ?
Đáp án : D Lời giải chi tiết :
Câu đúng là: Các chất khác nhau có cùng công thức phân tử được gọi là các chất đồng phân của nhau.
Câu 3 :
Khử hoàn toàn 17,6 gam hỗn hợp gồm Fe, FeO, Fe2O3 cần 4,48 lít H2 (đktc). khối lượng sắt thu được là
Đáp án : B Phương pháp giải :
+) nO (trong oxit) = nH2 +) mFe = moxit - mO Lời giải chi tiết :
nO (trong oxit) = nH2 = 0,2 mol => mO = 16.0,2 = 3,2 gam mFe = 17,6 - 3,2 = 14,4 gam
Câu 4 :
So với photpho đỏ thì photpho trắng có hoạt tính hoá học
Đáp án : C Lời giải chi tiết :
So với photpho đỏ thì photpho trắng có hoạt tính hoá học mạnh hơn
Câu 5 :
Phần trăm về khối lượng của nguyên tố N trong (NH2)2CO là :
Đáp án : C Phương pháp giải :
%mN = 14.2 / M(NH2)2CO .100% Lời giải chi tiết :
$\% {m_N} = \frac{{14.2}}{{60}}.100\% = 46,67\% $
Câu 6 :
Thêm từ từ từng giọt của 100 ml dung dịch chứa Na2CO3 1,2M và NaHCO3 0,6M vào 200 ml dung dịch HCl 1M, sau phản ứng hoàn toàn thu được dung dịch X. Cho dung dịch nước vôi trong dư vào dung dịch X thì thu được bao nhiêu gam kết tủa ?
Đáp án : D Phương pháp giải :
- Tính số mol Na2CO3 và NaHCO3 có trong X Tính số mol Na2CO3 và NaHCO3 => tỉ lệ phản ứng khi phản ứng với HCl Đặt nNaHCO3 phản ứng = x mol => nNa2CO3 phản ứng = 2x mol Các phản ứng: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O NaHCO3 + HCl → NaCl + CO2 + H2O ${{n}_{HCl}}=\text{ }2.{{n}_{N{{a}_{2}}C{{O}_{3}}}}+\text{ }{{n}_{NaHC{{O}_{3}}}}$ => số mol Na2CO3 và NaHCO3 - Tính khối lượng kết tủa ${{n}_{CaC{{O}_{3}}}}=\text{ }{{n}_{CO_{3}^{2-}}}+\text{ }{{n}_{HCO_{3}^{-}}}$ Lời giải chi tiết :
- Ta có \(\begin{gathered} - Khi cho từ từ 100 ml dung dịch vào HCl thì cả 2 chất đều phản ứng đồng thời theo tỉ lệ mol Na2CO3 : NaHCO3 = 1,2 : 0,6 = 2 : 1 - Đặt x là số mol NaHCO3 phản ứng => nNa2CO3 = 2x mol Các phản ứng: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O NaHCO3 + HCl → NaCl + CO2 + H2O => nHCl = 0,2 = 2.2x + x => x = 0,04 mol \(\begin{array}{*{20}{l}} Khi cho nước vôi trong vào X thì tạo kết tủa CaCO3 có ${{n}_{CaC{{O}_{3}}}}=\text{ }{{n}_{CO_{3}^{2-}}}+\text{ }{{n}_{HCO_{3}^{-}}}$ = 0,06 mol => m kết tủa = 6 gam
Câu 7 :
Phản ứng dùng để khắc hình, khắc chữ lên thủy tinh là phản ứng giữa SiO2 với:
Đáp án : D Lời giải chi tiết :
Phản ứng dùng để khắc hình, khắc chữ lên thủy tinh là phản ứng giữa SiO2 với HF SiO2 + HF → SiF4 + 2H2O
Câu 8 :
Cho dung dịch NH3 dư vào dung dịch chứa FeCl3, CuCl2, AlCl3, ZnSO4, MgCl2 thu được kết tủa Y. Thành phần của Y gồm
Đáp án : B Lời giải chi tiết :
NH3 dư có Cu(OH)2 và Zn(OH)2 tạo phức tan => kết tủa thu được gồm Fe(OH)3, Al(OH)3, Mg(OH)2.
Câu 9 :
Ở các vùng đất phèn người ta bón vôi để làm
Đáp án : A Phương pháp giải :
Cần nhớ vôi có tính kiềm => tác dụng được với axit Lời giải chi tiết :
Đất bị nhiễm phèn là đất chua chứa nhiều ion H+, do vậy người ta phải bón vôi để trung hòa bớt ion H+ giúp tăng pH của đất lên từ 7 - 9 => môi trường đất ổn định
Câu 10 :
Hoà tan hết hỗn hợp X gồm Zn và ZnO trong dung dịch HNO3 loãng dư thấy không có khí bay ra và trong dung dịch chứa 113,4 gam Zn(NO3)2 và 8 gam NH4NO3. Phần trăm khối lượng Zn trong X là
Đáp án : C Phương pháp giải :
ZnO tác dụng với HNO3 không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa +) Bảo toàn e: 2.nZn = 8.nNH4NO3 +) Bảo toàn nguyên tố Zn: nZn(NO3)2 = nZn + nZnO Lời giải chi tiết :
nZn(NO3)2 = 0,6 mol; nNH4NO3 = 0,1 mol ZnO tác dụng với HNO3 không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa Bảo toàn e: 2.nZn = 8.nNH4NO3 => nZn = 4.0,1 = 0,4 mol Bảo toàn nguyên tố Zn: nZn(NO3)2 = nZn + nZnO => nZnO = 0,6 – 0,4 = 0,2 mol \( = > \,\,\% {m_{Zn}} = \frac{{0,4.65}}{{0,4.65 + 0,2.81}}.100\% = 61,61\% \)
Câu 11 :
Chất nào sau đây có đồng phân hình học?
Đáp án : B Lời giải chi tiết :
2-clopropen: CH2=CCl-CH3 => không có đồng phân hình học but-2-en: CH3-CH=CH-CH3 => có đồng phân hình học 1,2-đicloetan: CHCl2-CHCl2 => không có đồng phân hình học But-2-in: CH≡C-CH-CH3 => không có đphh
Câu 12 :
Dung dịch nào sau đây có môi trường kiềm
Đáp án : A Lời giải chi tiết :
Dung dịch nào sau đây có môi trường kiềm là Na2CO3
Câu 13 :
Hỗn hợp X gồm N2 và H2 có ${{\overline{M}}_{X}}=12,4.$ Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết rằng hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. ${{\overline{M}}_{Y}}$ có giá trị là
Đáp án : C Phương pháp giải :
+) Áp dụng sơ đồ đường ché => tỉ lệ N2 : H2 => hiệu suất phản ứng tính theo chất thiếu +) Chọn số mol N2 và H2 => nH2 phản ứng => nN2 phản ứng và nNH3 sinh ra +) Tính nkhí giảm => nY = nX – ngiảm +) Theo định luật bảo toàn khối lượng ta có : \({m_Y} = {m_X} = {m_{{N_2}}} + {m_{{H_2}}}\)=> \({\overline M _Y} = \frac{{{m_Y}}}{{{n_Y}}}\) Lời giải chi tiết :
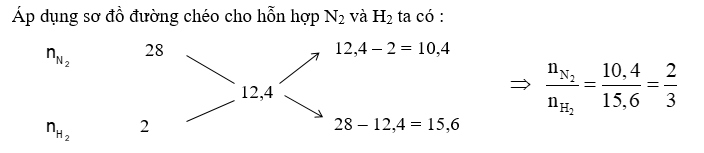 Với tỉ lệ trên suy ra H2 thiếu, hiệu suất phản ứng tính theo H2. Trong hỗn hợp X ta chọn nN2 = 2 mol và nH2 = 3 mol => nH2 phản ứng = 3.40% = 1,2 mol => nN2 phản ứng = 0,4 mol, nNH3 sinh ra = 0,8 mol nkhí giảm = (1,2 + 0,4) – 0,8 = 0,8 mol => \({n_Y} = {n_X} - 0,8 = 2 + 3 - 0,8 = 4,2\,\,mol\) Theo định luật bảo toàn khối lượng ta có : \({m_Y} = {m_X} = {m_{{N_2}}} + {m_{{H_2}}} = 2.28 + 3.2 = 62\,\,gam\) Vậy \({\overline M _Y} = \frac{{{m_Y}}}{{{n_Y}}} = \frac{{62}}{{4,2}} = 14,76\)
Câu 14 :
Một dung dịch có chứa các ion sau: Ba2+, Ca2+, Mg2+, Na+, H+, Cl-. Để tách được nhiều cation ra khỏi dung dịch mà không đưa thêm ion mới vào thì ta có thể cho dung dịch tác dụng với dung dịch nào sau đây?
Đáp án : B Lời giải chi tiết :
Ta thêm vào dung dịch Na2SO4 vào sẽ loại bỏ được 1 cation Ba2+ + SO42- → BaSO4 ↓ Ta thêm vào dung dịch Na2CO3 sẽ loại bỏ được 4 cation Ba2+ + CO32- → BaCO3 ↓ Ca2+ + CO32- → CaCO3 ↓ Mg2+ + CO32- → MgCO3 ↓ 2H+ + CO32- → CO2 ↑ + H2O Loại C vì dùng K2CO3 thêm ion mới là K+ Ta thêm vào dung dịch NaOH vào sẽ loại bỏ được 2 cation: Mg2+ + SO42- → MgSO4 ↓. H+ + OH- → H2O Vậy thêm Na2CO3 sẽ loại bỏ được nhiều ion nhất
Câu 15 :
Hòa tan hoàn toàn 1,28 g Cu vào 12,6 gam dd HNO3 60% thu được dung dịch X. Cho X tác dụng hoàn toàn với 105ml dung dịch KOH 1M, sau đó lọc bỏ kết tủa thu được dung dịch Y. Cô cạn Y được chất rắn Z. Nung Z đến khối lượng không đổi, thu được 8,78 gam chất rắn. Nồng độ phần trăm của Cu(NO3)2 trong X là:
Đáp án : A Phương pháp giải :
∑nKOH = a + b = 0,105 (1) ∑ mrắn = 85a + 56b = 8,78 (2) Từ (1) và (2) => a = ? ; b =? Bảo toàn electron => kết luận được N+5 bị khử thành NO và NO2 => tìm số mol mỗi khí => mdd X = mCu + mdd HNO3 – m khí => C% Cu(NO3)2 = ? Lời giải chi tiết :
∑nKOH = a + b = 0,105 (1) ∑ mrắn = 85a + 56b = 8,78 (2) Từ (1) và (2) => a = 0,1 (mol) ; b = 0,005 (mol) nKNO3 tạo ra từ Cu(NO3)2 = 0,04 (mol) => nKNO3 tạo ra từ HNO3 dư = 0,1 – 0,04 = 0,06 (mo) => nHNO3 dư = 0,12- 0,06 = 0,06 (mol) => nHNO3 bị khử = 0,06 – 0,02.2 = 0,02 (mol) Với ne( Cu nhường) = 2.nCu = 0,04 (mol) => Trung bình mỗi N+5 nhận 0,04/0,02 = 2e => Tạo NO2 (1e) và NO ( 3e) => nNO = nNO2 = 0,02/ 2= 0,01(mol) Vậy mdd X = mCu + mdd HNO3 – m khí = 1,28 + 12,6 – 0,01.30 – 0,01.46 = 13,12 (g) => C% Cu(NO3)2 = [( 0,02.188) : 13,12].100% = 28,66%
Câu 16 :
Cho các phản ứng hóa học sau: (1) (NH4)2SO4 + BaCl2 (2) CuSO4 + Ba(NO3)2 (3) Na2SO4 + BaCl2 (4) H2SO4 + BaSO3 (5) (NH4)2SO4 + Ba(OH)2 (6) Fe2(SO4)3 + Ba(NO3)2 Các phản ứng đều có cùng một phương trình ion thu gọn là
Đáp án : A Lời giải chi tiết :
Phương trình hóa học: (1) (NH4)2SO4 + BaCl2 → BaSO4 + 2NH4Cl (2) CuSO4 + Ba(NO3)2 → BaSO4 + Cu(NO3)2 (3) Na2SO4 + BaCl2→BaSO4 +2NaCl (4) H2SO4 + BaSO3 → BaSO4 + H2O + CO2 (5) (NH4)2SO4 + Ba(OH)2 → BaSO4 +2NH3 + 2H2O (6) Fe2(SO4)3 + 3Ba(NO3)2 → 3BaSO4 +2 Fe(NO3)3 Ta thấy ngoài BaSO4 là chất kết tủa phương trình (4), (5) còn sinh ra chất khí (CO2, NH3 ) chất điện li yếu nên chúng sẽ không có cùng phương trình ion thu gọn với các phương trình còn lại. Phản ứng: (1); (2); (3); (6) có chung phương trình ion rút gọn là: $\text{B}{\text{a}^{\text{2 + }}}\text{ + SO}_\text{4}^{\text{2 - }}\xrightarrow{{}}\text{BaS}{\text{O}_\text{4}}$
Câu 17 :
Nung nóng hoàn toàn 27,3 gam hổn hợp NaNO3, Cu(NO3)2. Hỗn hợp khí thoát ra được dẫn vào nước dư thấy có 1,12 lít khí (ở đktc) không bị hấp thụ, khối lượng Cu(NO3)2 trong hỗn hợp ban đầu là
Đáp án : A Phương pháp giải :
Gọi số mol của NaNO3, Cu(NO3)2 lần lượt là x và y +) Tính số mol NO2 và O2 sinh ra theo a và b +) Khí không bị hấp thụ là O2 còn dư => nO2 dư => a => mCu(NO3)2 Lời giải chi tiết :
Gọi số mol của NaNO3, Cu(NO3)2 lần lượt là x và y NaNO3 → NaNO2 + ½ O2 a → 0,5a Cu(NO3)2→ CuO + 2NO2 + ½ O2 b → 2b → 0,5b Hỗn hợp khí gồm nNO2 = 2b mol, nO2 = 0,5.(a + b) Hấp thụ hỗn hợp khí vào nước 4NO2 + O2 + 2H2O → 4HNO3 2b → 0,5b Khí không bị hấp thụ là O2 còn dư => nO2 dư = 0,5.(a +b) - 0,5b = 0,5a = 0,05 mol => a = 0,1 mol => mCu(NO3)2 = (27,3 – 85.0,1) = 18,8 gam
Câu 18 :
Dung dịch X chứa hỗn hợp gồm Na2CO3 1,5M và KHCO3 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là
Đáp án : D Phương pháp giải :
Với bài toán nhỏ từ từ axit vào muối cacbonat và ngược lại . Ta có : +) Nhỏ từ từ axit vào muối cacbonat thì ban đầu H+ thiếu nên thứ tự phản ứng là: CO32- + H+ → HCO3- HCO3- + H+ → CO2 + H2O +) Nhỏ từ từ muối cacbonat vào axit thì ban đầu H+ rất dư nên phản ứng là: 2H+ + CO32- → CO2 + H2O HCO3- + H+ → CO2 + H2O Lời giải chi tiết :
Phản ứng xảy ra theo thứ tự sau: CO32- + H+ → HCO3- (1) 0,15mol→0,15mol→0,15mol HCO3- + H+ → CO2 + H2O(2) 0,05mol ←0,05mol → 0,05mol Sau phản ứng (2) HCO3- còn dư 0,2 mol V = 1,12 lít
Câu 19 :
Khi sục từ từ đến dư khí CO2 vào dung dịch hỗn hợp chứa a mol Ca(OH)2 và b mol NaOH. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:  Tỉ lệ a: b là
Đáp án : A Phương pháp giải :
Chia đồ thị ra làm 3 giai đoạn: + giai đoạn 1: đồ thị đi lên xảy ra phản ứng CO2 + Ca(OH)2 → CaCO3↓ + H2O + giai đoạn 2: đồ thị đi ngang do xảy ra phản ứng CO2 + 2NaOH → Na2CO3 + H2O CO2 + Na2CO3 + H2O → 2NaHCO3 + giai đoạn 3: đồ thị đi xuống do xảy ra phản ứng CO2 + CaCO3 + H2O → Ca(HCO3)2 Lời giải chi tiết :
+ Tại giai đoạn 1: đồ thị đi lên do xảy ra phản ứng: CO2 + Ca(OH)2 → CaCO3↓ + H2O → nCaCO3 max = 0,5 (mol). BTNT "Ca": nCa(OH)2 bđ = 0,5 (mol) = a + Tại giai đoạn 3: đồ thị đi xuống khi hòa tan hoàn toàn kết tủa → Muối thu được gồm: NaHCO3 và Ca(HCO3)2 BTNT "Ca": nCa(HCO3)2 = nCa(OH)2 = 0,5 (mol) BTNT "C": nCO2 = nNaHCO3 + 2nCa(HCO3)2 → 1,4 = b + 2.0,5 → b = 0,4 (mol) Vậy a : b = 0,5 : 0,4 = 5 : 4
Câu 20 :
Câu nào sau đây đúng khi nói về sự điện li?
Đáp án : C Lời giải chi tiết :
Sự điện li là sự phân li một chất thành ion khi tan trong nước hay ở trạng thái nóng chảy.
Câu 21 :
Tính pH của dung dịch gồmNaOH 10-3M và NH3 10-2M (NH3 có Kb = 1,8.10-5 )
Đáp án : C Phương pháp giải :
\(NaOH \to N{a^ + } + O{H^ - }\) 10-3 \( \to\) 10-3 \(N{H_3} + {H_2}O \rightleftarrows NH_4^ + + O{H^ - }\) Ban đầu: 0,01 10-3 Phân li: x x 10-3 + x Cân bằng 0,01 – x x 10-3 + x Vì \({K_{b(N{H_3})}} = \dfrac{{{\text{[}}O{H^ - }{\text{]}}.{\text{[}}NH_4^ + {\text{]}}}}{{{\text{[}}N{H_3}{\text{]}}}} \) \( \to {\text{[}}O{H^ - }{\text{]}} \) \( \to pH \) Lời giải chi tiết :
\(NaOH \to N{a^ + } + O{H^ - }\) 10-3 \( \to\) 10-3 \(N{H_3} + {H_2}O \rightleftarrows NH_4^ + + O{H^ - }\) Ban đầu: 0,01 10-3 Phân li: x x 10-3 + x Cân bằng 0,01 – x x 10-3 + x Vì \({K_{b(N{H_3})}} = \dfrac{{{\text{[}}O{H^ - }{\text{]}}.{\text{[}}NH_4^ + {\text{]}}}}{{{\text{[}}N{H_3}{\text{]}}}} \to 1,{8.10^{ - 5}} = \dfrac{{({{10}^{ - 3}} + x)x}}{{0,01 - x}} \to x = 1,{536.10^{ - 4}}\) \( \to {\text{[}}O{H^ - }{\text{]}} = 1,{536.10^{ - 4}} + {10^{ - 3}} = 11,{536.10^{ - 4}}\,\,M\) \( \to pH = 14 + \log (11,{536.10^{ - 4}}) = 11,062\)
Câu 22 :
Khi đốt cháy chất hữu cơ X bằng oxi tinh khiết thu được hỗn hợp khí và hơi gồm CO2, H2O, N2. Điều đó chứng tỏ phân tử chất X
Đáp án : B Phương pháp giải :
Dựa vào phương pháp phân tích định tính các hợp chất hữu cơ: Chuyển các nguyên tố trong hợp chất hữu cơ thành các chất vô cơ đơn giản rồi nhận biết chúng bằng các phản ứng đặc trưng Lời giải chi tiết :
Khi đốt X trong oxi: - Thu được CO2 \( \to\) X có chứa C - Thu được H2O \( \to\) X có chứa H - Thu được N2 \( \to\) X có chứa N Vậy X có chứa C, H, N và có thể có O.
Câu 23 :
Dung dịch nào sau đây không tác dụng với dung dịch HCl loãng?
Đáp án : A Phương pháp giải :
Điều kiện xảy ra phản ứng trao đổi: Phản ứng trao đổi xảy ra khi thỏa mãn ít nhất 1 trong 3 điều kiện sau: 1. Tạo chất khí 2. Tạo kết tủa 3. Tạo chất điện li yếu Lời giải chi tiết :
A. KNO3 không phản ứng vì không thỏa mãn điều kiện của phản ứng trao đổi. B. AgNO3 có phản ứng vì tạo kết tủa (AgCl). C. NaOH có phản ứng vì tạo chất điện li yếu (H2O). D. Na2CO3 có phản ứng vì tạo ra khí (CO2).
Câu 24 :
Một chất Y có tính chất sau: - Không màu, rất độc. - Cháy trong không khí với ngọn lửa màu xanh và sinh ra chất khí làm đục nước vôi trong. Y là:
Đáp án : B Lời giải chi tiết :
CO là khí có những tính chất thỏa mãn với đề bài: - Không màu, rất độc - Cháy trong không khí với ngọn lửa màu xanh và sinh ra khí làm đục nước vôi trong: 2CO + O2 → 2CO2 (nhiệt độ) CO2+ Ca(OH)2 → CaCO3 + H2O
Câu 25 :
Thí nghiệm với dung dịch HNO3 thường sinh ra khí độc NO2. Để hạn chế khí NO2 thoát ra từ ống nghiệm, người ta nút ống nghiệm bằng (a) bông khô (b) bông có tẩm nước (c) bông có tẩm nước vôi trong (d) bông có tẩm giấm ăn Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là:
Đáp án : D Phương pháp giải :
Để ngăn khí độc ta dùng hóa chất phản ứng với khí đó tạo thành chất không độc. Lời giải chi tiết :
Trong 4 biện pháp trên, biện pháp có hiệu quả nhất là dùng bông có tẩm nước vôi trong để nút vào ống nghiệm. 2Ca(OH)2 + 4NO2 → Ca(NO3)2 + Ca(NO2)2 + 2H2O
Câu 26 :
Trong phòng thí nghiệm, khí CO được điều chế bằng phản ứng
Đáp án : C Lời giải chi tiết :
Trong phòng thí nghiệm người ta điều chế CO bằng phản ứng: HCOOH \(\xrightarrow{{{H_2}S{O_4},{t^o}}}\) CO + H2O
Câu 27 :
Một chất có CTĐGN là CH3. CTPT chất đó là
Đáp án : B Phương pháp giải :
Công thức phân tử của chất có dạng là CnH3n Mặt khác trong hidrocacbon ta luôn có: H ≤ 2C + 2 và H là số chẵn. Tìm điều kiện của n. Lời giải chi tiết :
Công thức phân tử của chất có dạng là CnH3n Mặt khác trong hidrocacbon ta luôn có: H ≤ 2C + 2 => 3n ≤ 2n + 2 => n ≤ 2 Mà số H chẵn nên ta suy ra n = 2 => CTPT C2H6
Câu 28 :
Hợp chất hữu cơ là hợp chất của nguyên tố
Đáp án : A Lời giải chi tiết :
Hợp chất hữu cơ là hợp chất của cacbon (trừ CO, CO2, HCN, muối cacbonat, muối xianua, muối cacbua…).
Câu 29 :
Để thu được muối trung hòa, cần bao nhiêu ml dung dịch NaOH 1M cho tác dụng với 50 ml dung dịch H3PO4 0,5M
Đáp án : D Phương pháp giải :
Tính theo PTHH: H3PO4 + 3NaOH → Na3PO4 + 3H2O Lời giải chi tiết :
nH3PO4 = 0,05.0,5 = 0,025 mol H3PO4 + 3NaOH → Na3PO4 + 3H2O 0,025 → 0,075 mol => V dd NaOH = 0,075 : 1 = 0,075 lít = 75 ml
Câu 30 :
Cho 20 gam NaOH vào dung dịch chứa 39,2 gam H3PO4. Hỏi muối nào được tạo thành? Khối lượng là bao nhiêu ?
Đáp án : D Phương pháp giải :
a = nOH- : nH3PO4 + a > 3 => Bazơ dư, sau phản ứng thu được muối PO43- và OH- + a = 3 => thu được muối PO43- + 2< a < 3 => thu được HPO42- và PO43- + a = 2 => thu được HPO42- + 1 < a < 2 => thu được HPO42- và H2PO4- + a = 1 => thu được H2PO4- + a < 1 => axit dư, sau phản ứng thu được H2PO4-và H+ Lời giải chi tiết :
nNaOH = 0,5 mol nH3PO4 = 0,4 mol 1 < nNaOH : nH3PO4 = 0,5:0,4 = 1,25 < 2 => Tạo thành 2 muối: NaH2PO4 (x mol) và Na2HPO4 (y mol) BT “Na”: x + 2y = nNaOH = 0,5 BT “P”: x + y = nH3PO4 = 0,4 => x = 0,3 và y = 0,1 mNaH2PO4 = 0,3.120 = 36 (g) mNa2HPO4 = 0,1.142 = 14,2 (g)
Câu 31 :
Phải thêm bao nhiêu ml dung dịch HCl 1M vào 90 ml nước để được dung dịch có pH = 1?
Đáp án : A Phương pháp giải :
pH = 1 => [H+] = 0,1M Đặt thể tích dung dịch HCl 1M cần thêm vào là V (lít) => nHCl = V mol Sau khi trộn với 90 ml H2O: [H+] = CM HCl sau trộn = \(\dfrac{V}{{V + 0,09}}\) = 0,1M => V Lời giải chi tiết :
pH = 1 => [H+] = 0,1M Đặt thể tích dung dịch HCl 1M cần thêm vào là V (lít) => nHCl = V mol Sau khi trộn với 90 ml H2O: [H+] = CM HCl sau trộn = \(\dfrac{V}{{V + 0,09}}\) = 0,1M => V = 0,01 lít = 10 ml
Câu 32 :
Một dung dịch chứa 0,02 mol Cu2+, 0,03 mol K+, x mol Cl– và y mol SO42–. Tổng khối lượng các muối tan có trong dung dịch là 5,435 gam. Giá trị của x và y lần lượt là ?
Đáp án : D Phương pháp giải :
Lập hệ phương trình để giải Bước 1: Bảo toàn điện tích tìm được pt (1): 2nCu2+ + nK+ = nCl- + nSO42- Bước 2: Bảo toàn khối lượng tìm được pt (2) mrắn = mCu2++ mK+ + mCl− + mSO42− Bước 3: Giải hệ tìm x, y Lời giải chi tiết :
Bước 1: Bảo toàn điện tích : 2nCu2+ + nK+ = nCl- + nSO42- => 0,02.2 + 0,03 = x + 2y (1) Bước 2: BTKL mmuối = mion = 0,02.64 + 0,03.39 + 35,5x + 96y = 5,435 (2) Bước 3: Giải hệ (1) (2) => x = 0,03 ; y = 0,02 mol
Câu 33 :
Axit nitric đặc , nóng phản ứng được với tất cả các chất trong nhóm nào sau đây?
Đáp án : A Lời giải chi tiết :
B. HNO3 không phản ứng được với Pt C. HNO3 không phản ứng được với CO2, Au D. HNO3 không phản ứng được với Au
Câu 34 :
Đốt cháy 200 ml hơi một hợp chất hữu cơ X chứa C, H, O trong 900 ml O2, thể tích hỗn hợp khí thu được là 1,3 lít. Sau khi ngưng tụ hơi nước chỉ còn 700 ml. Tiếp theo cho qua dung dịch KOH dư chỉ còn 100 ml khí bay ra. Các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất. Công thức phân tử của Y là
Đáp án : A Phương pháp giải :
1,3 lít gồm CO2, H2O và O2 dư Ngưng tụ hơi nước chỉ còn 700 ml => VH2O = 1300 – 700 = 600 lít CO2 được hấp thụ bởi KOH => VCO2 = 700-100 = 600 lít VO2 = 100 lít +) Bảo toàn nguyên tố C, H, O => CTPT Y Lời giải chi tiết :
Sơ đồ phản ứng : CxHy Oz + O2 ® CO2 + H2O + O2 dư lít: 200 900 600 600 100 Áp dụng định luật bảo toàn nguyên tố đối với các nguyên tố C, H, O ta có : \(\left\{ \begin{array}{l}200.x = 600\\200y = 600.2\\200z + 900.2 = 600 + 600.2 + 100.2\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}x = 3\\y = 6\\z = 1\end{array} \right.\) Þ Công thức của hiđrocacbon là C3H6O
Câu 35 :
Trộn 100 ml dung dịch natri nitrit 3M với 300 ml dung dịch amoni clorua 1,6M đun nóng đến phản ứng hoàn toàn. Thể tích khí N2 sinh ra và nồng độ mol các muối trong dung dịch sau phản ứng là:
Đáp án : A Phương pháp giải :
Tính theo PTHH: NaNO2 + NH4Cl \(\xrightarrow{{{t^o}}}\) NaCl + N2 + 2H2O Lời giải chi tiết :
Ta có: nNaNO2 = 0,1.3 = 0,3 mol; nNH4Cl = 0,3.1,6 = 0,48 mol PTHH: NaNO2 + NH4Cl \(\xrightarrow{{{t^o}}}\) NaCl + N2 + 2H2O Bđ: 0,3 0,48 Pư: 0,3 → 0,3 → 0,3 → 0,3 Sau: 0 0,18 0,3 0,3 ⟹ VN2 = 0,3.22,4 = 6,72 (lít); CM NaCl = 0,3 : 0,4 = 0,75 (M); CM NH4Cl = 0,18 : 0,4 = 0,45 (M).
Câu 36 :
Ứng dụng phổ biến nhất của amoni nitrat là làm phân bón, thuốc nổ quân sự. Amoni nitrat có công thức hóa học là
Đáp án : C Lời giải chi tiết :
Amoni nitrat có công thức hóa học là NH4NO3.
Câu 37 :
Cho các chất: O2 (1),CO2 (2), H2 (3), Fe2O3 (4), SiO2 (5), HCl (6), CaO (7), H2SO4 đặc (8), HNO3 (9), H2O (10), KMnO4 (11). Cacbon phản ứng trực tiếp được với bao nhiêu chất?
Đáp án : B Lời giải chi tiết :
C phản ứng lần lượt với O2, CO2, H2, Fe3O4, SiO2, CaO, H2SO4 đặc, HNO3 đặc, H2O => Tính khử => Tính khử => Tính oxi hóa => Tính khử => Tính khử => Tính khử => Tính khử => Tính khử => Tính khử
Câu 38 :
Dung dịch chất nào sau đây làm quỳ tím hóa xanh?
Đáp án : C Phương pháp giải :
Cách xác định nhanh môi trường của dung dịch muối: - Muối tạo bởi bazo yếu và axit mạnh => MT axit => Làm quỳ hóa đỏ - Muối tạo bởi bazo mạnh và axit yếu => MT bazo => Làm quỳ hóa xanh - Muối tạo bởi bazo mạnh và axit mạnh => MT trung tính => Không làm quỳ tím chuyển màu Lời giải chi tiết :
Quỳ hóa xanh: K2CO3 (do tạo bởi bazo mạnh KOH và axit yếu H2CO3) Quỳ hóa đỏ: AlCl3 (do tạo bởi bazo yếu Al(OH)3 và axit mạnh HCl) Quỳ tím không đổi màu: Ca(NO3)2 ; Na2SO4 (do tạo bởi các bazo mạnh Ca(OH)2, NaOH và axit mạnh HNO3, H2SO4)
Câu 39 :
Chọn phát biểu đúng trong số các phát biểu sau đây ?
Đáp án : A Phương pháp giải :
Ta có pH = -log [H+] → [H+] càng lớn thì pH càng nhỏ Xét giá trị pH thì: + Nếu pH < 7 thì dung dịch có MT axit → quỳ tím hóa đỏ + Nếu pH = 7 dung dịch có MT trung tính → quỳ tím không đổi màu + Nếu pH > 7 thì dung dịch có MT bazơ → quỳ tím hóa xanh Lời giải chi tiết :
pH = -log [H+] → [H+] càng lớn thì pH càng nhỏ → A đúng, B sai Nếu pH > 7 thì dung dịch có MT bazơ → quỳ tím hóa xanh → C sai Nếu pH < 7 thì dung dịch có MT axit → quỳ tím hóa đỏ → D sai
Câu 40 :
Cho m gam P2O5 tác dụng với 500 ml dung dịch KOH 1M. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X (không chứa H3PO4), cô cạn dung dịch X thu được 193m/71 gam chất rắn khan. Nếu cho X tác dụng với dung dịch BaCl2 dư thì thu được bao nhiêu gam kết tủa?
Đáp án : B Phương pháp giải :
Xét 2 trường hợp: TH 1: Chất rắn gồm K3PO4 và KOH dư TH2: Chất rắn chỉ gồm muối. Dùng bảo toàn khối lượng để tìm số mol H3PO4, từ đó tìm được số mol mỗi muối trong dung dịch X. Khi đó viết phương trình khi cho dung dịch X tác dụng với dung dịch BaCl2 tìm được khối lượng kết tủa. Lời giải chi tiết :
Đặt nP2O5 = x mol → nH3PO4 = 2x mol Nếu KOH vẫn còn dư → Chất rắn gồm K3PO4 (2x mol) và KOH dư (0,5- 6x) mol → 212.2x + 56. (0,5-6x) = 193.142/171 Suy ra x = 0,094 Loại vì 0,5 - 6x < 0. Vậy KOH phản ứng hết. Khi đó nH2O = nKOH = 0,5 mol Theo bảo toàn khối lượng: mH3PO4 + mKOH = mmuối + mH2O → 98.2x + 0,5.56 = 193.142x/71 + 0,5.18 → x = 0,1 → m = 14,2 Ta có: nH3PO4 = 0,2 mol và nKOH = 0,5 mol → X chứa K3PO4 (0,1 mol) và K2HPO4 (0,1 mol) Vậy kết tủa gồm Ba3(PO4)2 (0,05 mol) và BaHPO4 (0,1 mol) → mkết tủa = 53,35 gam |