Đề thi giữa kì 2 Hóa 11 - Đề số 4Đề bài
Câu 1 :
Đốt cháy hoàn toàn hỗn hợp gồm 0,1 mol C2H4 và 0,2 mol C3H6 thu được V lít khí CO2 (đktc). Giá trị của V là
Câu 2 :
Cho hỗn hợp but-1-in và hiđro dư qua xúc tác Pd/PbCO3 đun nóng, sản phẩm tạo ra là
Câu 3 :
Kết luận nào sau đây là đúng ?
Câu 4 :
Ankađien nào sau đây có đồng phân hình học ?
Câu 5 :
Để làm sạch etilen có lẫn axetilen, ta cho hỗn hợp đi qua dung dịch
Câu 6 :
Thuộc tính nào sau đây không phải là của các hợp chất hữu cơ ?
Câu 7 :
Hỗn hợp X gồm 2 ankin có tỷ lệ mol 1: 3. Đốt cháy hoàn toàn hỗn hợp X sau đó cho toàn bộ sản phẩm cháy vào nước vôi trong dư thấy khối lượng bình nước vôi trong tăng 10,96 gam và trong bình có 20 gam kết tủa. Vậy công thức của 2 ankin là:
Câu 8 :
Đốt cháy hoàn toàn x mol hiđrocacbon A thu được y mol H2O và z mol CO2, trong đó z – y = x. Công thức tổng quát của A là
Câu 9 :
Cho hỗn hợp X gồm x mol Al4C3 và y mol CaC2 vào nước dư thu được dung dịch A; a gam kết tủa B và hỗn hợp khí C. Lọc bỏ kết tủa B. Đốt cháy hoàn toàn khí C rồi dẫn sản phẩm cháy vào dung dịch A thu được thêm a gam kết tủa B nữa. Biết các phản ứng xảy ra hoàn toàn. Tỉ lệ x : y là
Câu 10 :
Chất nào sau đây có đồng phân hình học?
Câu 11 :
Một bình kín chứa hỗn hợp X gồm 0,06 mol axetilen; 0,09 mol vinylaxetilen; 0,16 mol H2 và một ít bột Ni. Nung hỗn hợp X thu được hỗn hợp Y gồm 7 hiđrocacbon (không chứa but-1-in) có tỉ khối hơi đối với H2 là 328/15. Cho toàn bộ hỗn hợp Y đi qua bình đựng dung dịch AgNO3/NH3 dư, thu được m gam kết tủa vàng nhạt và 1,792 lít hỗn hợp khí Z thoát ra khỏi bình. Để làm no hoàn toàn hỗn hợp Z cần vừa đúng 50 ml dung dịch Br2 1M. Các phản ứng xảy ra hoàn toàn. Giá trị của m là:
Câu 12 :
Phát biểu nào sau đây là không đúng?
Câu 13 :
Khi đốt cháy hoàn toàn một hiđrocacbon A thu được 1,12 lít CO2 (đktc) và 1,08 gam H2O. A có phân tử khối là 72 và khi cho tác dụng với clo (có askt) thì thu được bốn dẫn xuất monocle. A có tên gọi là:
Câu 14 :
Hidrat hóa 2-metylbut-2-en (ở điều kiện xúc tác và nhiệt độ thích hợp) thu được sản phẩm chính là
Câu 15 :
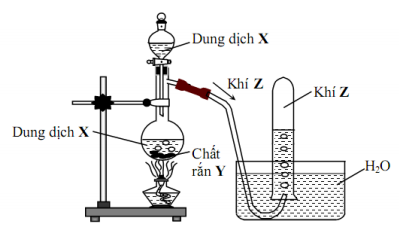
Mô hình thí nghiệm dùng để điều chế chất khí Z:
Phương trình hóa học nào sau đây phù hợp với mô hình trên?
Câu 16 :
Đốt chay hoàn toàn 0,1 mol chất X cần 6,16 lít khí O2 (đktc), thu được 13,44 lít (đktc) hỗn hợp CO2, N2 và hơi nước. Sau khi ngưng tụ hết hơi nước, còn lại 5,6 lít khí (đktc) có tỷ khối so với hiđro là 20,4. Công thức phân tử của X là
Câu 17 :
Đốt cháy hoàn toàn 0,1 lít chất hữu cơ A bằng 0,6 lít khí O2 lấy dư, thu được hỗn hợp khí và hợp có thể tích 0,85 lít. Cho hỗn hợp khí và hơi thu được qua bình chứa dung dịch H2SO4 đậm đặc, dư, còn lại 0,45 lít hỗn hợp khí Z. Cho hỗn hợp Z qua bình chứa KOH dư, còn lại 0,05 lít. Tìm công thức phân tử của hợp chất hữu cơ A, biết các thể tích khí đo ở cùng một điều kiện
Câu 18 :
Ở điều kiện thường hiđrocacbon nào sau đây không ở thể khí ?
Câu 19 :
Số liên kết \(\sigma\) trong phân tử propan là
Câu 20 :
Ankan X có công thức phân tử C5H12, khi tác dụng với clo tạo được 4 dẫn xuất monoclo. Tên của X là
Câu 21 :
Cho iso-pentan tác dụng với Cl2 theo tỉ lệ số mol 1 : 1, số sản phẩm monocle tối đa thu được là:
Câu 22 :
Khi crackinh hoàn toàn 1 thể tích ankan X thu được ba thể tích hỗn hợp Y( các thể tích đo ở cùng điều kiện nhiệt độ và áp suất). Tỉ khối của Y so với H2 bằng 12. Công thức phân tử của X là
Câu 23 :
Thực hiện phản ứng crackinh 11,2 lít hơi isopentan (đktc), thu được hỗn hợp X chỉ gồm ankan và anken. Trong hỗn hợp X có chứa 7,2 gam một chất Y mà đốt cháy thì thu được 11,2 lít CO2 và 10,8 gam nước. Hiệu suất phản ứng là:
Câu 24 :
Đốt cháy 13,7 ml hỗn hợp A gồm metan, propan và cacbon (II) oxit, ta thu được 25,7 ml khí CO2 ở cùng điều kiện nhiệt độ và áp suất. Thành phần % thể tích propan trong hỗn hợp A và khối lượng phân tử trung bình của hỗn hợp A so với nitơ là :
Câu 25 :
Chất nào sau đây có thể được điều chế metan bằng một phản ứng (giả sử các chất vô cơ cần thiết và điều kiện có đủ)?
Câu 26 :
Chất nào sau đây có đồng phân hình học?
Câu 27 :
Cho các chất sau: CH2=CH-CH2-CH2-CH=CH2, CH2=CH-CH=CH-CH2-CH3, CH3-C(CH3)=CH-CH2, CH2=CH-CH2-CH=CH2. Số chất có đồng phân hình học là :
Câu 28 :
Đốt cháy hoàn toàn V lít (đktc) một ankađien thu được H2O và CO2 có tổng khối lượng là 25,2 gam. Nếu cho sản phẩm cháy đi qua dung dịch Ca(OH)2 dư, được 45 gam kết tủa. V có giá trị là
Câu 29 :
Ý kiến khẳng định nào sau đây đúng?
Câu 30 :
Cho 2,24 lít hỗn hợp khí X (đktc) gồm 2 ankan là đồng đẳng kế tiếp nhau và propen sục qua nước brom dư thấy khối lượng bình đựng nước brom tăng 2,1 gam. Đốt cháy lượng khí còn lại thì thu được một lượng CO2 và 3,24 gam nước. Xác định công thức của hai ankan
Câu 31 :
Monome của sản phẩm trùng hợp có tên gọi là polipropilen (P.P) là:
Câu 32 :
Một phân tử polietilen có khối lượng phân tử bằng 56000u. Hệ số polime hóa của phân tử polietilen này là
Câu 33 :
Trong phòng thí nghiệm quá trình điều chế etilen thường có lẫn khí CO2 và SO2. Để loại bỏ CO2 và SO2 người ta cho hỗn hợp khí đi qua dung dịch dư nào sau đây?
Câu 34 :
Trong một bình kín chứa hiđrocacbon A ở thể khí (đkt) và O2 (dư). Bật tia lửa điện đốt cháy hết A đưa hỗn hợp về điều kiện ban đầu trong đó % thể tích của CO2 và hơi nước lần lượt là 30% và 20%. Công thức phân tử của A và % thể tích của hiđrocacbon A trong hỗn hợp là
Câu 35 :
X là hỗn hợp khí gồm 2 hiđrocacbon. Đốt cháy 1 lít hỗn hợp X được 1,5 lít CO2 và 1,5 lít hơi H2O (các thể tích khí đo ở cùng điều kiện). Công thức phân tử của 2 hiđrocacbon là
Câu 36 :
Cho sơ đồ phản ứng sau: \(C{H_3} - C \equiv CH + AgN{O_3}/N{H_3} \to X + N{H_4}N{O_3}\) X có công thức cấu tạo là
Câu 37 :
Sục 0,672 lít khí propin ở đktc qua 100 ml dung dịch AgNO3 0,2M trong NH3. Khối lượng kết tủa thu được là
Câu 38 :
Một hiđrocacbon A mạch thẳng có công thức phân tử là C6H6. Khi cho A tác dụng với dung dịch AgNO3/NH3 dư thu được hợp chất hữu cơ B có MB – MA = 214 đvC. Công thức cấu tạo của X có thể là
Câu 39 :
Đốt cháy hoàn toàn m gam hiđrocacbon ở thể khí, mạch hở, nặng hơn không khí thu được 7,04 gam CO2. Sục m gam hiđrocacbon này vào nước brom dư đến khi phản ứng hoàn toàn, thấy có 25,6 gam brom phản ứng . Giá trị của m là
Câu 40 :
Khi brom hóa một ankan chỉ thu được một dẫn xuất monobrom duy nhất có tỉ khối hơi đối với hiđro là 75,5. Tên của ankan đó là:
Lời giải và đáp án
Câu 1 :
Đốt cháy hoàn toàn hỗn hợp gồm 0,1 mol C2H4 và 0,2 mol C3H6 thu được V lít khí CO2 (đktc). Giá trị của V là
Đáp án : B Phương pháp giải :
Bảo toàn nguyên tố C: nCO2 = 2.nC2H4 + 3.nC3H6 Lời giải chi tiết :
Bảo toàn nguyên tố C: nCO2 = 2.nC2H4 + 3.nC3H6 = 0,1.2 + 0,2.3 = 0,8 mol => V = 0,8.22,4 = 17,92 lít
Câu 2 :
Cho hỗn hợp but-1-in và hiđro dư qua xúc tác Pd/PbCO3 đun nóng, sản phẩm tạo ra là
Đáp án : B Lời giải chi tiết :
CH≡C–CH2–CH3 + H2 $\xrightarrow{Pd/PbC{{O}_{3}}}$ CH2=CH–CH2–CH3
Câu 3 :
Kết luận nào sau đây là đúng ?
Đáp án : D Lời giải chi tiết :
Câu đúng là: Các chất khác nhau có cùng công thức phân tử được gọi là các chất đồng phân của nhau.
Câu 4 :
Ankađien nào sau đây có đồng phân hình học ?
Đáp án : C Phương pháp giải :
Xét các nối đôi của ankađien,nối đôi nào có 2 nhóm liên kết với mỗi cacbon khác nhau thì ankađien đó có đồng phân hình học. Lời giải chi tiết :
Ankađien có đồng phân hình học là CH3-CH=CH-CH=CH2 (có ở 1 nối đôi giữa)
Câu 5 :
Để làm sạch etilen có lẫn axetilen, ta cho hỗn hợp đi qua dung dịch
Đáp án : C Lời giải chi tiết :
Để làm sạch etilen có lẫn axetilen, ta cho hỗn hợp đi qua dung dịch AgNO3/NH3 dư vì axetilen có phản ứng tạo kết tủa còn etilen không phản ứng
Câu 6 :
Thuộc tính nào sau đây không phải là của các hợp chất hữu cơ ?
Đáp án : C Lời giải chi tiết :
+ Thuộc tính không phải là của các hợp chất hữu cơ là: liên kết hoá học trong hợp chất hữu cơ thường là liên kết ion. + Liên kết hóa học trong hợp chất hữu cơ thường là liên kết cộng hóa trị
Câu 7 :
Hỗn hợp X gồm 2 ankin có tỷ lệ mol 1: 3. Đốt cháy hoàn toàn hỗn hợp X sau đó cho toàn bộ sản phẩm cháy vào nước vôi trong dư thấy khối lượng bình nước vôi trong tăng 10,96 gam và trong bình có 20 gam kết tủa. Vậy công thức của 2 ankin là:
Đáp án : C Phương pháp giải :
+) mbình tăng = mCO2 + mH2O +) nankin = nCO2 – nH2O +) số C trung bình = nCO2 / nankin => trong X có C2H2 Vì hỗn hợp X gồm 2 ankin có tỉ lệ 1 : 3 => xét 2 TH TH1: nC2H2 = 0,02 mol => nCnH2n-2 = 0,06 mol TH2: nC2H2 = 0,06 mol; nCnH2n-2 = 0,02 mol Lời giải chi tiết :
nCaCO3 = 0,2 mol => nCO2 = nCaCO3 = 0,2 mol mbình tăng = mCO2 + mH2O = 10,96 gam => mH2O = 10,96 – 0,2.44 = 2,16 gam => nH2O = 0,12 mol => nankin = nCO2 – nH2O = 0,2 – 0,12 = 0,08 mol => số C trung bình = nCO2 / nankin = 0,2 / 0,08 = 2,5 => trong X có C2H2. Gọi ankin còn lại là CnH2n-2 Hỗn hợp X gồm 2 ankin có tỷ lệ mol 1: 3 TH1: nC2H2 = 0,02 mol => nCnH2n-2 = 0,06 mol => Bảo toàn C: 0,02.2 + 0,06n = 0,2 => n = 2,67 (loại) TH2: nC2H2 = 0,06 mol; nCnH2n-2 = 0,02 mol => Bảo toàn C: 0,06.2 + 0,02n = 0,2 => n = 4 => ankin còn lại là C4H6
Câu 8 :
Đốt cháy hoàn toàn x mol hiđrocacbon A thu được y mol H2O và z mol CO2, trong đó z – y = x. Công thức tổng quát của A là
Đáp án : A Lời giải chi tiết :
+ Đốt cháy CnH2n+2 thu được nH2O – nCO2 = nA + Đốt cháy CnH2n thu được nCO2 = nH2O + Đốt cháy CnH2n-2 thu được nCO2 – nH2O = nA => z – y = x
Câu 9 :
Cho hỗn hợp X gồm x mol Al4C3 và y mol CaC2 vào nước dư thu được dung dịch A; a gam kết tủa B và hỗn hợp khí C. Lọc bỏ kết tủa B. Đốt cháy hoàn toàn khí C rồi dẫn sản phẩm cháy vào dung dịch A thu được thêm a gam kết tủa B nữa. Biết các phản ứng xảy ra hoàn toàn. Tỉ lệ x : y là
Đáp án : A Phương pháp giải :
+) Kết tủa B là Al(OH)3 => trong dung dịch A chỉ chứa Ca(AlO2)2 +) Bảo toàn nguyên tố Ca: nCa(OH)2 = nCa(AlO2)2 +) Bảo toàn nguyên tố Al: 4.nAl4C3 = nAl(OH)3 (1) + 2.nCa(AlO2)2 +) Đốt cháy khí C (C2H2 và CH4) thu được CO2 => bảo toàn nguyên tố C: nCO2 = 3.nAl4C3 + 2.nCaC2 +) Sục CO2 vào dung dịch A : Ca(AlO2)2 + 2CO2 + 4H2O → 2Al(OH)3↓ + Ca(HCO3)2 Vì ${n_{Ca\left( {AlO2} \right)2}} < {\rm{ }}\frac{{{n_{CO2}}}}{2}$ => phản ứng tính theo Ca(AlO2)2 => nAl(OH)3 (2) = 2.nCa(AlO2)2 Vì lượng kết tủa lần 1 thu được bằng lượng kết tủa lần 2 => nAl(OH)3 (1) = nAl(OH)3 (2) Lời giải chi tiết :
(1) Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 (2) CaC2 + 2H2O → Ca(OH)2 + C2H2 (3) 2Al(OH)3 + Ca(OH)2 → Ca(AlO2)2 + 4H2O Kết tủa B là Al(OH)3 => trong dung dịch A chỉ chứa Ca(AlO2)2 Bảo toàn nguyên tố Ca: nCa(OH)2 = nCa(AlO2)2 = y mol Bảo toàn nguyên tố Al: 4.nAl4C3 = nAl(OH)3 (1) + 2.nCa(AlO2)2 => nAl(OH)3 (1) = 4x – 2y Đốt cháy khí C (C2H2 và CH4) thu được CO2 => bảo toàn nguyên tố C: nCO2 = 3.nAl4C3 + 2.nCaC2 = 3x + 2y Sục CO2 vào dung dịch A : Ca(AlO2)2 + 2CO2 + 4H2O → 2Al(OH)3↓ + Ca(HCO3)2 Vì ${n_{Ca\left( {AlO2} \right)2}} = {\rm{ }}y{\rm{ }} < {\rm{ }}\frac{{{n_{CO2}}}}{2} = {\rm{ }}\frac{{3x{\rm{ }} + {\rm{ }}2y}}{2} = 1,5x + y$ => phản ứng tính theo Ca(AlO2)2 => nAl(OH)3 (2) = 2.nCa(AlO2)2 = 2y Vì lượng kết tủa lần 1 thu được bằng lượng kết tủa lần 2 => nAl(OH)3 (1) = nAl(OH)3 (2) => 4x – 2y = 2y => x = y => tỉ lệ x : y = 1 : 1
Câu 10 :
Chất nào sau đây có đồng phân hình học?
Đáp án : B Lời giải chi tiết :
2-clopropen: CH2=CCl-CH3 => không có đồng phân hình học but-2-en: CH3-CH=CH-CH3 => có đồng phân hình học 1,2-đicloetan: CHCl2-CHCl2 => không có đồng phân hình học But-2-in: CH≡C-CH-CH3 => không có đphh
Câu 11 :
Một bình kín chứa hỗn hợp X gồm 0,06 mol axetilen; 0,09 mol vinylaxetilen; 0,16 mol H2 và một ít bột Ni. Nung hỗn hợp X thu được hỗn hợp Y gồm 7 hiđrocacbon (không chứa but-1-in) có tỉ khối hơi đối với H2 là 328/15. Cho toàn bộ hỗn hợp Y đi qua bình đựng dung dịch AgNO3/NH3 dư, thu được m gam kết tủa vàng nhạt và 1,792 lít hỗn hợp khí Z thoát ra khỏi bình. Để làm no hoàn toàn hỗn hợp Z cần vừa đúng 50 ml dung dịch Br2 1M. Các phản ứng xảy ra hoàn toàn. Giá trị của m là:
Đáp án : C Phương pháp giải :
+) Bảo toàn khối lượng: mY = mX => nY +) ${{n}_{{{H}_{2}}}}$phản ứng = nX – nY Gọi x và y là số mol C2H2 và C4H4 trong Y Ta có: nY = nC2H2 + nC4H4 + nZ => PT (1) Bảo toàn số mol π: ${{n}_{\pi \,({{C}_{2}}{{H}_{2}})}}+{{n}_{\pi \,({{C}_{4}}{{H}_{4}})}}=\sum{{{n}_{\pi \,trong\,X}}}-{{n}_{\pi \,trong\,Z}}$ => PT (2) => x; y ${{n}_{{{C}_{2}}A{{g}_{2}}}}={{n}_{{{C}_{2}}{{H}_{2}}}};\,\,{{n}_{{{C}_{4}}{{H}_{3}}Ag}}={{n}_{{{C}_{4}}{{H}_{4}}}}$ => m Lời giải chi tiết :
Bảo toàn khối lượng: mY = mX = 6,56 gam Vì $\Rightarrow {{n}_{{{H}_{2}}}}$phản ứng = nX – nY = 0,16 mol => H2 phản ứng hết Gọi x và y là số mol C2H2 và C4H4 trong Y Ta có: nY = nC2H2 + nC4H4 + nZ => x + y = 0,15 – 0,08 = 0,07 (1) Bảo toàn số mol π: ${{n}_{\pi \,({{C}_{2}}{{H}_{2}})}}+{{n}_{\pi \,({{C}_{4}}{{H}_{4}})}}=\sum{{{n}_{\pi \,trong\,X}}}-{{n}_{\pi \,trong\,Z}}$ => 2x +3y = 0,06.2 + 0,09.3 – 0,16 – 0,05 = 0,18 mol (2) Từ (1) và (2) => x = 0,03 mol; y = 0,04 mol ${{n}_{{{C}_{2}}A{{g}_{2}}}}={{n}_{{{C}_{2}}{{H}_{2}}}}=0,03\,mol;\,\,{{n}_{{{C}_{4}}{{H}_{3}}Ag}}={{n}_{{{C}_{4}}{{H}_{4}}}}=0,04\,mol$ => m = 0,03.240 + 0,04.159 = 13,56 gam
Câu 12 :
Phát biểu nào sau đây là không đúng?
Đáp án : D Lời giải chi tiết :
Phát biểu không đúng là: Công thức chung của hiđrocacbon no có dạng CnH2n+2 Vì xicloankan cũng là hiđrocacbon no mà CTPT dạng CnH2n
Câu 13 :
Khi đốt cháy hoàn toàn một hiđrocacbon A thu được 1,12 lít CO2 (đktc) và 1,08 gam H2O. A có phân tử khối là 72 và khi cho tác dụng với clo (có askt) thì thu được bốn dẫn xuất monocle. A có tên gọi là:
Đáp án : A Phương pháp giải :
+) Bảo toàn khối lượng cho A: mA = mC +mH => nA +) Từ số mol của A, CO2 và H2O => CTPT của A +) Từ các CTCT của A, xét CTCT có khả năng tạo 4 dẫn xuất monoclo Lời giải chi tiết :
nCO2 = 0,05 mol nH2O = 0,06 mol Bảo toàn khối lượng cho A ta có: mA = mC +mH =0,05*12+0,06*2=0,72 gam => nA = 0,01 mol ${C_x}{H_y} + (x + \dfrac{y}{4}){O_2} \to xC{O_2} + \dfrac{y}{2}{H_2}O$ 0,01 0,05 0,06 => x = 0,05/0,01 = 5 => y = 0,06 . 2/0,01 = 12 Vậy CTPT của A là: C5H12 Do A tác dụng với clo thu được bốn dẫn xuất monoclo nên A là: CH3-CH(CH3)-CH2-CH3 (isopentan)
Câu 14 :
Hidrat hóa 2-metylbut-2-en (ở điều kiện xúc tác và nhiệt độ thích hợp) thu được sản phẩm chính là
Đáp án : D Phương pháp giải :
Dựa vào quy tắc cộng Maccopnhicop: Cộng HX vào liên kết đôi C=C thì H sẽ cộng vào nguyên tử C bậc thấp hơn (có ít H hơn) và X sẽ cộng vào nguyên tử C có bậc cao hơn (có nhiều nguyên tử H hơn) Lời giải chi tiết :
Câu 15 :
Mô hình thí nghiệm dùng để điều chế chất khí Z:
Phương trình hóa học nào sau đây phù hợp với mô hình trên?
Đáp án : B Phương pháp giải :
Thu khí Z bằng cách đẩy nước nên khí Z phải hầu như không tan trong nước và không phản ứng với nước. Lời giải chi tiết :
Thu khí Z bằng cách đẩy nước nên khí Z phải hầu như không tan trong nước và không phản ứng với nước. A loại vì CaC2 tác dụng với H2O không cần nhiệt độ, H2O không được gọi là dung dịch B phù hợp C loại vì SO2 là khí độc không thu bằng cách đẩy nước D loại vì chất tham gia đều là chất rắn còn mô hình thí nghiệm là chất rắn tác dụng với chất lỏng
Câu 16 :
Đốt chay hoàn toàn 0,1 mol chất X cần 6,16 lít khí O2 (đktc), thu được 13,44 lít (đktc) hỗn hợp CO2, N2 và hơi nước. Sau khi ngưng tụ hết hơi nước, còn lại 5,6 lít khí (đktc) có tỷ khối so với hiđro là 20,4. Công thức phân tử của X là
Đáp án : A Phương pháp giải :
+) Gọi số mol CO2 và N2 là a, b. Lập hệ phương trình \(\left\{ \begin{array}{l}a + b = \dfrac{{5,6}}{{22,4}} = 0,25\\\dfrac{{44a + 28b}}{{(a + b)}} = 20,4.\,\,2\end{array} \right. = > a,b\) +) nCO2+ nN2+ nH2O= 6,16: 22,4 = 0,6 mol +) nC = nCO2 = 0,2 mol +) nH = 2nH2O =0,7 mol +) nN = 2nN2 = 0,1 mol +) BTNT O => nO(X) +) Tìm CTPT của X Lời giải chi tiết :
+) Gọi số mol CO2 và N2 là a, b. Lập hệ phương trình \(\left\{ \begin{array}{l}a + b = \dfrac{{5,6}}{{22,4}} = 0,25\\\dfrac{{44a + 28b}}{{(a + b)}} = 20,4.\,\,2\end{array} \right. = > \left\{ \begin{array}{l}a = 0,2\\b = 0,05\end{array} \right.\) +) nCO2 + nN2 + nH2O= 6,16: 22,4 = 0,6 mol => nH2O = 0,35 mol +) nC = nCO2 = 0,2 mol +) nH = 2nH2O = 0,7 mol +) nN = 2nN2 = 0,1 mol +) BTNT (O) => nO(X) + 2nO2 = 2nCO2 + nH2O => nO(X) = 0,2 mol nC: nH: nO: nN= 0,2: 0,7: 0,2: 0,1= 2: 7: 2: 1 Vậy CTPT của X là C2H7O2N
Câu 17 :
Đốt cháy hoàn toàn 0,1 lít chất hữu cơ A bằng 0,6 lít khí O2 lấy dư, thu được hỗn hợp khí và hợp có thể tích 0,85 lít. Cho hỗn hợp khí và hơi thu được qua bình chứa dung dịch H2SO4 đậm đặc, dư, còn lại 0,45 lít hỗn hợp khí Z. Cho hỗn hợp Z qua bình chứa KOH dư, còn lại 0,05 lít. Tìm công thức phân tử của hợp chất hữu cơ A, biết các thể tích khí đo ở cùng một điều kiện
Đáp án : C Phương pháp giải :
Bảo toàn nguyên tố Lời giải chi tiết :
Tỉ lệ về thể tích cũng là tỉ lệ về số mol 0,85 lít gồm CO2, H2O và O2 dư H2SO4 đậm đặc hấp thụ nước => nH2O = 0,4 mol KOH hấp thụ CO2 => nCO2 = 0,4 mol nO2 dư = 0,05 mol Bảo toàn nguyên tố: nC = nCO2 = 0,4 mol nH = 2nH2O = 0,8 mol BTNT O: nO(A) + 2nO2 = 2n CO2 + nH2O + 2n O2 dư => nO(A) = 0,1 mol BTNT Số C = nC: nA = 0,4: 0,1 = 4 Số H = nH: nA = 0,8: 0,1 = 8 Số O = nO(A): nA = 0,1: 0,1 = 1 Vậy công thức phân tử của A là C4H8O
Câu 18 :
Ở điều kiện thường hiđrocacbon nào sau đây không ở thể khí ?
Đáp án : D Phương pháp giải :
+ Ankan từ C1 C4 ở trạng thái khí. + An kan từ C5 khoảng C18 ở trạng thái lỏng. Từ C18 trở đi thì ở trạng thái rắn. Lời giải chi tiết :
+ Ankan từ C1 C4 ở trạng thái khí. + An kan từ C5 khoảng C18 ở trạng thái lỏng. Từ C18 trở đi thì ở trạng thái rắn. => C5H12 không ở thể khí
Câu 19 :
Số liên kết \(\sigma\) trong phân tử propan là
Đáp án : D Lời giải chi tiết :
Công thức cấu tạo của propan là CH3 – CH2 – CH3 => trong propan có 8 liên kết \(\sigma \) C-H và 2 liên kết \(\sigma \) C – C
Câu 20 :
Ankan X có công thức phân tử C5H12, khi tác dụng với clo tạo được 4 dẫn xuất monoclo. Tên của X là
Đáp án : B Lời giải chi tiết :
C5H12 có 3 đồng phân: C1H3 – C2H2 – C3H2 – C4H2 – C5H3 : có 3 vị trí thế Clo (1, 2, 3), vị trí C4 giống C2 và C5 giống C1
có 4 vị trí thế Clo (1, 2, 3, 4), vị trí C5 giống C1 (CH3)3C – CH3 : chỉ có 1 vị trí thế Clo vì 4 nhóm CH3 đều giống nhau
Câu 21 :
Cho iso-pentan tác dụng với Cl2 theo tỉ lệ số mol 1 : 1, số sản phẩm monocle tối đa thu được là:
Đáp án : D Lời giải chi tiết :
Ở vị trí C1 và C5 là giống nhau => có 4 vị trí thế monoclo là 1, 2 , 3, 4 => có thể thu được 4 dẫn xuất halogen
Câu 22 :
Khi crackinh hoàn toàn 1 thể tích ankan X thu được ba thể tích hỗn hợp Y( các thể tích đo ở cùng điều kiện nhiệt độ và áp suất). Tỉ khối của Y so với H2 bằng 12. Công thức phân tử của X là
Đáp án : D Phương pháp giải :
+) BTKL : mX= mY +) MX = 3MY +) MX = 72 <=> 14n +2 =72 => n = 5 Lời giải chi tiết :
\(BTKL:\,\,{m_X} = {m_Y}\) \({V_Y} = 3{V_X} = > {n_Y} = 3{n_X}\) \( < = > \frac{{{m_Y}}}{{{M_Y}}} = 3.\frac{{{m_X}}}{{{M_X}}} < = > {M_X} = 3{M_Y}\) Mặt khác MY = 24 => MX = 72 = 14n + 2 <=> n=5 X là C5H12
Câu 23 :
Thực hiện phản ứng crackinh 11,2 lít hơi isopentan (đktc), thu được hỗn hợp X chỉ gồm ankan và anken. Trong hỗn hợp X có chứa 7,2 gam một chất Y mà đốt cháy thì thu được 11,2 lít CO2 và 10,8 gam nước. Hiệu suất phản ứng là:
Đáp án : C Phương pháp giải :
+) nCO2 = 0, 5mol; nH2O = 0,6 mol > nCO2 => X là ankan +) nX = nH2O – nCO2 = 0,1 mol +) Số C trong X = 0,5: 0,1 = 5 => H% Lời giải chi tiết :
nC5H12 = 0,5mol nCO2 = 0,5mol; nH2O = 0,6 mol > nCO2 => X là ankan nX = nH2O – nCO2 = 0,1 mol Số C trong X = 0,5: 0,1 = 5 Số H trong X= (2. 0,6) : 0,1 = 12 => X là isopentan dư \(H\% = \dfrac{{0,5 - 0,1}}{{0,5}}.100\% = 80\% \)
Câu 24 :
Đốt cháy 13,7 ml hỗn hợp A gồm metan, propan và cacbon (II) oxit, ta thu được 25,7 ml khí CO2 ở cùng điều kiện nhiệt độ và áp suất. Thành phần % thể tích propan trong hỗn hợp A và khối lượng phân tử trung bình của hỗn hợp A so với nitơ là :
Đáp án : C Phương pháp giải :
CH4 CO2 (1) ; C3H8 3CO2 (2) ; CO CO2 (3) x x y 3y z z Từ (1), (2), (3) và giả thiết ta có hệ :
+) \({\overline M _A} = \dfrac{{16x + 44y + 28z}}{{x + y + z}} => \dfrac{{16(x + z) + 44y}}{{x + y + z}}\) Mặt khác \({M_{{N_2}}} = 28\,\,gam/mol\) nên suy ra khối lượng phân tử trung bình của A lớn hơn so với N2 hay \(\dfrac{{\overline M {}_A}}{{{M_{{N_2}}}}} > 1.\) Lời giải chi tiết :
Đặt số mol của metan, propan và cacbon (II) oxit lần lượt là x, y, z Sơ đồ phản ứng : CH4 CO2 (1) ; C3H8 3CO2 (2) ; CO CO2 (3) x x y 3y z z Từ (1), (2), (3) và giả thiết ta có hệ :
Khối lượng mol trung bình của hỗn hợp A là : \({\overline M _A} = \dfrac{{16x + 44y + 28z}}{{x + y + z}} > \dfrac{{16(x + z) + 44y}}{{x + y + z}} = \dfrac{{16.7,7 + 44.6}}{{13,7}} = 28,3\,\,gam/mol\) Mặt khác \({M_{{N_2}}} = 28\,\,gam/mol\) nên suy ra khối lượng phân tử trung bình của A lớn hơn so với N2 hay \(\dfrac{{\overline M {}_A}}{{{M_{{N_2}}}}} > 1.\)
Câu 25 :
Chất nào sau đây có thể được điều chế metan bằng một phản ứng (giả sử các chất vô cơ cần thiết và điều kiện có đủ)?
Đáp án : C Lời giải chi tiết :
Chất có thể điều chế metan bằng một phản ứng là C3H8 \({C_3}{H_8}\xrightarrow{{crackinh}}C{H_4} + {C_2}{H_4}\)
Câu 26 :
Chất nào sau đây có đồng phân hình học?
Đáp án : B Lời giải chi tiết :
Những chất có đồng phân cis – trans là: CH3-CH=CH-CH=CH2
Câu 27 :
Cho các chất sau: CH2=CH-CH2-CH2-CH=CH2, CH2=CH-CH=CH-CH2-CH3, CH3-C(CH3)=CH-CH2, CH2=CH-CH2-CH=CH2. Số chất có đồng phân hình học là :
Đáp án : B Lời giải chi tiết :
Chất có đồng phân hình học là : CH2=CH-CH=CH-CH2-CH3
Câu 28 :
Đốt cháy hoàn toàn V lít (đktc) một ankađien thu được H2O và CO2 có tổng khối lượng là 25,2 gam. Nếu cho sản phẩm cháy đi qua dung dịch Ca(OH)2 dư, được 45 gam kết tủa. V có giá trị là
Đáp án : D Phương pháp giải :
Gọi CTPT của ankadien là CnH2n-2 +) CnH2n-2 + \(\frac{{3n - 1}}{2}\) O2 → nCO2 + (n-1) H2O \(\begin{array}{l}{m_{C{O_2}}} + {m_{{H_2}O}} = 25,2\\{n_{C{O_2}}} = {n_{CaC{O_3}}} = 0,45(mol)\\ \to {n_{{H_2}O}}\\{n_{ankadien}} = {n_{C{O_2}}} - {n_{{H_2}O}}\end{array}\) Lời giải chi tiết :
Gọi CTPT của ankadien là CnH2n-2 +) CnH2n-2 + \(\frac{{3n - 1}}{2}\) O2 → nCO2 + (n-1) H2O \({m_{C{O_2}}} + {m_{{H_2}O}} = 25,2\) Ta có: \({n_{C{O_2}}} = {n_{CaC{O_3}}} = 0,45(mol)\) \(\begin{array}{l} \to {n_{{H_2}O}} = \dfrac{{25,2 - 0,45.44}}{{18}} = 0,3(mol)\\{n_{ankadien}} = {n_{C{O_2}}} - {n_{{H_2}O}} = 0,15(mol)\\V = 0,15.22,4 = 3,36(l)\end{array}\)
Câu 29 :
Ý kiến khẳng định nào sau đây đúng?
Đáp án : D Lời giải chi tiết :
Đáp án A sai vì CH2=CH-CH=CH2 cũng có CTPT CnH2n-2 nhưng không phải ankin. Đáp án B sai vì CH≡C-CH=CH2 có liên kết ba nhưng không phải ankin. Đáp án C sai vì axetilen và các đồng đẳng gọi chung là các ankin.
Câu 30 :
Cho 2,24 lít hỗn hợp khí X (đktc) gồm 2 ankan là đồng đẳng kế tiếp nhau và propen sục qua nước brom dư thấy khối lượng bình đựng nước brom tăng 2,1 gam. Đốt cháy lượng khí còn lại thì thu được một lượng CO2 và 3,24 gam nước. Xác định công thức của hai ankan
Đáp án : B Phương pháp giải :
+) Khối lượng bình nước brom tăng chính bằng khối lượng propen. => mpropen = 2,1 gam=> npropen = 0,05 mol => nankan = 0,05 mol +) Gọi CTPT chung của 2 ankan là \({C_{\overline n }}{H_{2\overline n + 2}}\) \(\begin{gathered}{C_{\overline n }}{H_{2\overline n + 2}} \to \overline n C{O_2} + (\overline n + 1){H_2}O \hfill \\ \overline n + 1 = \frac{{{n_{{H_2}O}}}}{{{n_{ankan}}}} = 3,6 = > \overline n = 2,6 \hfill \\ \end{gathered} \) Lời giải chi tiết :
Ta có khối lượng bình brom tăng lên 2,1 gam. => mpropen = 2,1 gam. => npropen =2,1/42=0,05 mol. => nankan = 0,05 mol. Gọi CTPT chung của ankan là \({C_{\overline n }}{H_{2\overline n + 2}}\) \(\begin{gathered}{C_{\overline n }}{H_{2\overline n + 2}} \to \overline n C{O_2} + (\overline n + 1){H_2}O \hfill \\\overline n + 1 = \frac{{{n_{{H_2}O}}}}{{{n_{ankan}}}} = 3,6 = > \overline n = 2,6 \hfill \\ \end{gathered} \) Hai ankan là C2H6 và C3H8
Câu 31 :
Monome của sản phẩm trùng hợp có tên gọi là polipropilen (P.P) là:
Đáp án : D Phương pháp giải :
xem lại lý thuyết phản ứng trùng hợp của anken. Lời giải chi tiết :
nCH3-CH=CH-CH3 → (-CH(CH3)-CH(CH2)-)n propilen poliprolilen
Câu 32 :
Một phân tử polietilen có khối lượng phân tử bằng 56000u. Hệ số polime hóa của phân tử polietilen này là
Đáp án : B Phương pháp giải :
Xem lại lý thuyết phản ứng trùng hợp anken. Lời giải chi tiết :
M(-CH2-CH2-)n = 28n = 56000 => n = 2000 Vậy hệ số polime là n = 2000
Câu 33 :
Trong phòng thí nghiệm quá trình điều chế etilen thường có lẫn khí CO2 và SO2. Để loại bỏ CO2 và SO2 người ta cho hỗn hợp khí đi qua dung dịch dư nào sau đây?
Đáp án : D Lời giải chi tiết :
CO2 + Ca(OH)2 → CaCO3 ↓+ H2O SO2 + Ca(OH)2 → CaSO3 ↓+ H2O Etilen không tác dụng với Ca(OH)2
Câu 34 :
Trong một bình kín chứa hiđrocacbon A ở thể khí (đkt) và O2 (dư). Bật tia lửa điện đốt cháy hết A đưa hỗn hợp về điều kiện ban đầu trong đó % thể tích của CO2 và hơi nước lần lượt là 30% và 20%. Công thức phân tử của A và % thể tích của hiđrocacbon A trong hỗn hợp là
Đáp án : A Phương pháp giải :
+) Giả sử hỗn hợp sau có 30 lít CO2; 20 lít H2O và 50 lít O2 dư. Vì \({V_{C{O_2}}} > {V_{{H_2}O}}\)=> ankin. => \({V_A} = {V_{{H_2}O}} - {V_{C{O_2}}} = 10(lit)\) => A có số C \( = \frac{{{V_{C{O_2}}}}}{{{V_A}}}\) +) Bảo toàn nguyên tố O, ta có: \(\begin{gathered}{V_{{O_2}(pu)}} = \frac{1}{2}(2{V_{C{O_2}}} + {V_{{H_2}O}}) \hfill \\\to {V_{{O_2}(bd)}} = {V_{{O_2}(du)}} + {V_{{O_2}(pu)}} \hfill \\\% {V_A} = \frac{{{V_A}}}{{{V_{hh}}}}.100\% \hfill \\ \end{gathered} \) Lời giải chi tiết :
Giả sử hỗn hợp sau có 30 lít CO2; 20 lít H2O và 50 lít O2 dư. Vì \({V_{C{O_2}}} > {V_{{H_2}O}}\)=> ankin. => \({V_A} = {V_{{H_2}O}} - {V_{C{O_2}}} = 10(lit)\) => A có số C \( = \frac{{{V_{C{O_2}}}}}{{{V_A}}} = 3\) A là C3H4 Bảo toàn nguyên tố O, ta có: \(\begin{gathered}{V_{{O_2}(pu)}} = \frac{1}{2}(2{V_{C{O_2}}} + {V_{{H_2}O}}) = 40(lit) \hfill \\ \to {V_{{O_2}(bd)}} = 90(lit) \hfill \\ \end{gathered} \) Hỗn hợp ban đầu gồm 90 lít O2 và 10 lít C3H4 \(\% {V_{{C_3}{H_4}}} = \frac{{10}}{{100}}.100\% = 10\% \)
Câu 35 :
X là hỗn hợp khí gồm 2 hiđrocacbon. Đốt cháy 1 lít hỗn hợp X được 1,5 lít CO2 và 1,5 lít hơi H2O (các thể tích khí đo ở cùng điều kiện). Công thức phân tử của 2 hiđrocacbon là
Đáp án : A Phương pháp giải :
+) Số C trung bình \( = \frac{{{V_{C{O_2}}}}}{{{V_X}}}\) +) Số H trung bình \( = \frac{{2{V_{{H_2}O}}}}{{{V_X}}}\) Lời giải chi tiết :
Số C trung bình \( = \frac{{{V_{C{O_2}}}}}{{{V_X}}} = 1,5\) => Trong X có CH4 Số H trung bình \( = \frac{{2{V_{{H_2}O}}}}{{{V_X}}} = 3\) Mà X có CH4 => trong X có C2H2
Câu 36 :
Cho sơ đồ phản ứng sau: \(C{H_3} - C \equiv CH + AgN{O_3}/N{H_3} \to X + N{H_4}N{O_3}\) X có công thức cấu tạo là
Đáp án : B Phương pháp giải :
Xem lại phản ứng cộng của ankin Lời giải chi tiết :
PTHH: CH3-C≡CH + AgNO3/NH3 → CH3-C≡CAg ↓ + NH4NO3
Câu 37 :
Sục 0,672 lít khí propin ở đktc qua 100 ml dung dịch AgNO3 0,2M trong NH3. Khối lượng kết tủa thu được là
Đáp án : A Phương pháp giải :
Xem lại phản ứng cộng của ankin Lời giải chi tiết :
nC3H4 = 0,03 mol, nAgNO3 = 0,02 CH3–C≡CH + AgNO3 + NH3 → CH3–C≡CAg ↓vàng nhạt + NH4NO3 0,03 0,02 => C3H4 dư, AgNO3 hết => nkết tủa = nAgNO3 = 0,02 mol => m = 0,02.147 = 2,94 gam
Câu 38 :
Một hiđrocacbon A mạch thẳng có công thức phân tử là C6H6. Khi cho A tác dụng với dung dịch AgNO3/NH3 dư thu được hợp chất hữu cơ B có MB – MA = 214 đvC. Công thức cấu tạo của X có thể là
Đáp án : A Phương pháp giải :
C6H6 → C6H6-xAgx MB – MA = 78 + 107x – 78 = 214 => x Lời giải chi tiết :
A mạch thẳng tạo kết tủa với AgNO3 => A có liên kết ba đầu mạch C6H6 → C6H6-xAgx MB – MA = 78 + 107x – 78 = 214 => x = 2
Câu 39 :
Đốt cháy hoàn toàn m gam hiđrocacbon ở thể khí, mạch hở, nặng hơn không khí thu được 7,04 gam CO2. Sục m gam hiđrocacbon này vào nước brom dư đến khi phản ứng hoàn toàn, thấy có 25,6 gam brom phản ứng . Giá trị của m là
Đáp án : D Phương pháp giải :
+) Hidrocacbon là C2H2 +) BTNT C: 2n ankin = nCO2 Lời giải chi tiết :
Hidrocacbon là C2H2 (vì M < Mkk; nBr2 = 2nankin) nBr2 = 0,16 mol; nCO2 = 0,16 mol=> nankin = 0,08 mol m = 0,08.26 = 2,08 gam
Câu 40 :
Khi brom hóa một ankan chỉ thu được một dẫn xuất monobrom duy nhất có tỉ khối hơi đối với hiđro là 75,5. Tên của ankan đó là:
Đáp án : B Phương pháp giải :
Công thức dẫn xuất monobrom là CnH2n+1Br. Từ khối lượng phân tử của dẫn xuất xác định được giá trị của n. Lời giải chi tiết :
M = 75,5.2 = 151 => \({M_{{C_n}{H_{2n + 1}}Br}}\) = 14n + 81 = 151 => n = 5 => CTPT ankan là C5H12 Do brom hóa ankan chỉ thu được 1 dẫn xuất monobrom duy nhất => CTCT thỏa mãn: C(CH3)4 |














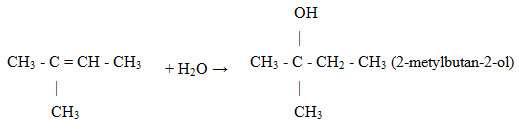
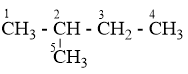
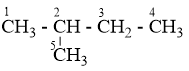
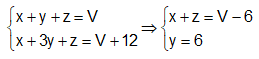
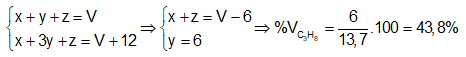





Danh sách bình luận