Đề số 2 - Đề kiểm tra học kì 2 – Hóa học 9Đáp án và lời giải chi tiết Đề số 2 - Đề kiểm tra học kì 2 (Đề thi học kì 2) – Hóa học 9 Quảng cáo
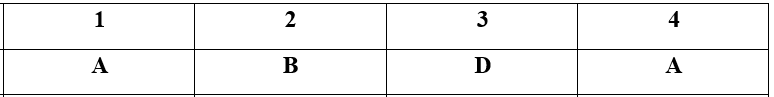
Đề bài I./TRẮC NGHIỆM (2,0 điểm) Câu 1 1,12 lít khí Axetilen làm mất màu tối đa bao nhiêu lít Br2 1M: A. 0,1 lít. B. 0,15 lít. C. 0,3 lít. D. 0,6 lít. Câu 2 Phản ứng đặc trưng của metan là: A. Phản ứng thủy phân. B. Phản ứng thế. C. Phản ứng cộng. D. Phản ứng cháy. Câu 3 Nhóm các nguyên tố nào được sắp xếp đúng theo chiều tính phi kim tăng dần A. O,F, N, P. B. F, O, N, P. C. O, N, P, F. D. P, N, O,F. Câu 4 Sau khi làm thí nghiệm, khí clo dư được loại bỏ bằng cách sục khí clo vào: A. Dung dịch NaOH. B. Dung dịch NaCl. C. Nước. D. Dung dịch HCl. II./TỰ LUẬN (8,0 đ) Câu 5 Thực hiện chuỗi phản ứng sau: Etilen → Rượu etylic → axit axetic → etyl axetat → Natri axetat Câu 6 Bằng phương pháp hóa học hãy nhận biết các chất khí riêng biệt sau: C2H4, SO2, Cl2. Câu 7 Đốt cháy hoàn toàn một hidrocacbon A, mạch hở ở thể khí thu được 13,44 lít khí CO2 ở đktc, 10,8 g H2O. Xác định công thức phân tử của A, biết tỉ khối của A so với hidro bằng 28. Viết công thức cấu tạo của A? Câu 8 Cho 19,4 gam hỗn hợp gồm Zn và Cu vào dd axit axetic có dư, sau phản ứng hoàn toàn thu được 4,48 lít khí không màu (đktc). Hãy tính khối lượng và phần trăm theo khối lượng mỗi chất trong hỗn hợp đầu. Lời giải chi tiết HƯỚNG DẪN GIẢI CHI TIẾT I.TRẮC NGHIỆM (2,0đ) Câu 1: Phương pháp: Tính toán theo PTHH: C2H2 + 2Br2 → C2H2Br4 Ghi nhớ công thức chuyển đổi: n(đktc) = V : 22,4 V = n : CM Hướng dẫn giải: nC2H2(đktc) = 1,12:22,4 = 0,05 (mol) C2H2 + 2Br2 → C2H2Br4 0,05 → 0,1 (mol) nBr2 = 2nC2H2 = 0,1 (mol) => VBr2 = n: CM = 0,1 : 1 = 0,1 (l) Đáp án A Câu 2: Phương pháp: Dựa vào kiến thức được học về metan trong sgk hóa 9 Hướng dẫn giải: Metan là hidrocacbon no nên phản ứng đặc trưng là phản ứng thế (với Cl2, điều kiện ánh sáng) Đáp án B Câu 3: Phương pháp: Trong bảng hệ thống tuần hoàn, đi từ trái sang phải tính phi kim tăng dần, đi từ trên xuống dưới tính phi kim giảm dần Hướng dẫn giải: Trong cùng 1 nhóm đi từ trên xuống dưới tính phi kim giảm dần => P < N Trong cùng 1 chu kì đi từ trái sang phải, tính phi kim tăng dần => N < O < F => thứ tự đúng: P < N < O < F Đáp án D Câu 4: Phương pháp: Chọn dd mà có phản ứng với Cl2 sinh ra chất không độc hại, từ đó sẽ loại bỏ được Cl2 thừa. Hướng dẫn giải: Clo được loại bỏ bằng cách cho sục vào dd NaOH vì có phản ứng Cl2 + 2NaOH → NaCl + NaClO + H2O Khi đó Cl2 sẽ bị giữ lại, tránh thoát ra ngoài gây độc hại môi trường Đáp án A II./TỰ LUẬN Câu 5: (Mỗi phương trình đúng 0,5đ) Phương pháp: Dựa vào kĩ năng viết các phương trình hóa học xảy ra, hầu hết tất cả các phương trình đã được học trong sgk hóa 9 Hướng dẫn giải: Câu 6: Phương pháp: Dựa vào tính chất hóa học khác nhau của các chất để chọn thuốc thử phù hợp Lưu ý: hiện tượng quan sát được phải rõ ràng, các hiện tượng nhìn được bằng mắt thường (sự thay đổi màu sắc, xuất hiện kết tủa hay không, có khí thoát ra hay không) Hướng dẫn giải: Dùng quỳ tím ẩm cho lần lượt vào các khí + Qùy tím ẩm chuyển sang màu đỏ là khí SO2 + Qùy tím ẩm mất màu là khí Cl2 + quỳ tím ẩm không đổi màu là C2H2 SO2 + H2O \(\underset{{}}{\overset{{}}{\longleftrightarrow}}\) H2SO3 (có môi trường axit nên làm quỳ chuyển đỏ) Cl2 + H2O \(\underset{{}}{\overset{{}}{\longleftrightarrow}}\) HCl + HClO (có tính oxi hóa mạnh nên làm quỳ tím mất màu) Câu 7: Phương pháp: - Bước 1: đi tìm công thức đơn giản nhất của A - Bước 2: Có phân tử khối của A từ đó tìm được công thức phân tử của A - Bước 3: Viết các công thức cấu tạo thỏa mãn Hướng dẫn giải: Số mol CO2 (đktc) = 13,44 :22,4 = 0,6 (mol) => nC = 0,6 (mol) Số mol H2O (đktc) = 10,08 :18 = 0,6 (mol) => nH = 2nH2O = 1,2 (mol) nC : nH = 0,6 : 1,2 = 1:2 => Công thức của A có dạng: (CH2)n MA = 18.2 = 56 (g/mol) => 14.n = 56 => n = 4 Vậy CTPT của A là: C4H8 4 CTCT của A là: CH2=CH-CH2-CH2 CH3-CH=CH-CH3 (cis + trans) CH2=C(CH3)-CH3 Câu 8: Phương pháp: Tính toán theo PTHH: Zn + 2CH3COOH → (CH3COO)2Zn + H2 Hướng dẫn giải: nH2(đktc) = 4,48 :22,4 = 0,2(mol) PTHH: Zn + 2CH3COOH → (CH3COO)2Zn + H2 Theo PTHH: nZn = nH2 = 0,2 (mol) => mZn = 0,2.65 = 13 (g) => mCu = 19,4 - 13 = 6,4 (g) Phần trăm khối lượng của các kim loại trong hỗn hợp là: %Zn = (mZn: mhh).100% = (13 :19,4).100% = 67,01% % Cu = 100% -% Zn = 100% - 67,01% = 32,99% Nguồn: Sưu tầm Loigiaihay.com
|














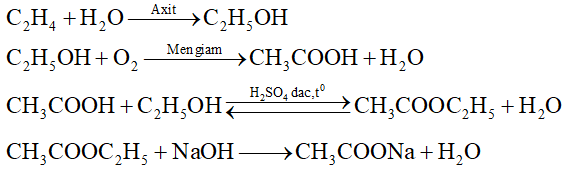






Danh sách bình luận