Đề kiểm tra 15 phút Hóa 11 chương 5: Hidrocacbon no - Đề số 1Đề bài
Câu 1 :
Phản ứng đặc trưng của hiđrocacbon no là :
Câu 2 :
Khi đốt cháy hoàn toàn V lít C2H6 (đktc) thu được 44 gam CO2 và 27 gam H2O. Giá trị của V là :
Câu 3 :
Sản phẩm của phản ứng thế clo (1:1, ánh sáng) vào 2,2-đimetylpropan là : (1) (CH3)3CCH2Cl (2) CH3C(CH2Cl)2CH3 (3) CH3ClC(CH3)3
Câu 4 :
Khi clo hóa C5H12 với tỉ lệ mol 1:1 thu được 3 sản phẩm thế monoclo. Danh pháp IUPAC của ankan đó là
Câu 5 :
Đốt cháy hoàn toàn một hiđrocacbon A. Sản phẩm thu được hấp thụ hoàn toàn vào 200 ml dung dịch Ca(OH)2 0,2M thấy thu được 3 gam kết tủa. Lọc bỏ kết tủa, cân lại phần dung dịch thấy khối lượng tăng lên so với ban đầu là 0,28 gam. Hiđrocacbon trên có CTPT là
Câu 6 :
Hiđrocacbon mạch hở X trong phân tử chỉ chứa liên kết σ và có hai nguyên tử cacbon bậc ba trong một phân tử. Đốt cháy hoàn toàn 1 thể tích X sinh ra 6 thể tích CO2 (ở cùng điều kiện nhiệt độ, áp suất). Khi cho X tác dụng với Cl2 (theo tỉ lệ số mol 1 : 1), số dẫn xuất monoclo tối đa sinh ra là :
Câu 7 :
Crackinh hoàn toàn 6,6 gam propan được hỗn hợp X gồm hai hiđrocacbon. Dẫn toàn bộ X qua bình đựng 400 ml dung dịch brom a mol/l thấy khí thoát ra khỏi bình có tỉ khối so metan là 1,1875. Giá trị a là :
Câu 8 :
Cho các chất sau : C2H6 (I) C3H8 (II) n-C4H10 (III) i-C4H10 (IV) Nhiệt độ sôi tăng dần theo dãy là :
Câu 9 :
Cho các chất sau : 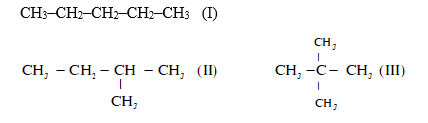 Thứ tự tăng dần nhiệt độ sôi của các chất là :
Câu 10 :
Trong phòng thí nghiệm, người ta điều chế CH4 bằng phản ứng
Câu 11 :
$A{l_4}{C_3} + {\text{ }}{H_2}O \to X + {\text{ }}Al{\left( {OH} \right)_3}$. X là
Câu 12 :
Từ CH4 (các chất vô cơ và điều kiện có đủ) có thể điều chế các chất nào sau đây?
Lời giải và đáp án
Câu 1 :
Phản ứng đặc trưng của hiđrocacbon no là :
Đáp án : B Phương pháp giải :
Xem lại lí thuyết phản ứng halogen hóa của ankan Lời giải chi tiết :
Phản ứng đặc trưng của hiđrocacbon no là phản ứng thế
Câu 2 :
Khi đốt cháy hoàn toàn V lít C2H6 (đktc) thu được 44 gam CO2 và 27 gam H2O. Giá trị của V là :
Đáp án : B Phương pháp giải :
Áp dụng công thức : nankan = nH2O – nCO2 Lời giải chi tiết :
nCO2 = 1 mol ; nH2O = 1,5 mol Áp dụng công thức : nankan = nH2O – nCO2 = 1,5 – 1 = 0,5 mol => VC2H6 = 0,5.22,4 = 11,2 lít
Câu 3 :
Sản phẩm của phản ứng thế clo (1:1, ánh sáng) vào 2,2-đimetylpropan là : (1) (CH3)3CCH2Cl (2) CH3C(CH2Cl)2CH3 (3) CH3ClC(CH3)3
Đáp án : D Phương pháp giải :
Xem lại lí thuyết phản ứng halogen hóa của ankan Lời giải chi tiết :
2,2-đimetylpropan: (CH3)3C-CH3 => chỉ có 1 vị trí thế Cl (CH3)3C-CH3 + Cl2 → (CH3)3C-CH2Cl + HCl
Câu 4 :
Khi clo hóa C5H12 với tỉ lệ mol 1:1 thu được 3 sản phẩm thế monoclo. Danh pháp IUPAC của ankan đó là
Đáp án : C Phương pháp giải :
- Viết đồng phân ankan - Xét các vị trí thế clo của mỗi đồng phân Lời giải chi tiết :
C5H12 có 3 đồng phân: $\overset{1}{\mathop{C}}\,{{H}_{3}}-\overset{2}{\mathop{C}}\,{{H}_{2}}-\overset{3}{\mathop{C}}\,{{H}_{2}}-C{{H}_{2}}-C{{H}_{3}}$ : có 3 vị trí thế Clo (1, 2, 3), vị trí C4 giống C2 và C5 giống C1 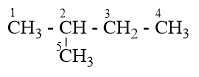 có 4 vị trí thế Clo (1, 2, 3, 4), vị trí C5 giống C1
(CH3)3C – CH3 : chỉ có 1 vị trí thế Clo vì 4 nhóm CH3 đều giống nhau
Câu 5 :
Đốt cháy hoàn toàn một hiđrocacbon A. Sản phẩm thu được hấp thụ hoàn toàn vào 200 ml dung dịch Ca(OH)2 0,2M thấy thu được 3 gam kết tủa. Lọc bỏ kết tủa, cân lại phần dung dịch thấy khối lượng tăng lên so với ban đầu là 0,28 gam. Hiđrocacbon trên có CTPT là
Đáp án : A Phương pháp giải :
- Trường hợp 1 : Ca(OH)2 dư, chỉ xảy ra phản ứng tạo kết tủa : CO2 + Ca(OH)2 → CaCO3 + H2O (1) +) mdung dịch tăng = ${{m}_{{{H}_{2}}O}}+{{m}_{C{{O}_{2}}}}-{{m}_{CaC{{O}_{3}}}}$ - Trường hợp 2 : Ca(OH)2 phản ứng hết : CO2 + Ca(OH)2 → CaCO3 + H2O (1) 2CO2 + Ca(OH)2 → Ca(HCO3)2 (2) +) mdung dịch tăng = ${{m}_{{{H}_{2}}O}}+{{m}_{C{{O}_{2}}}}-{{m}_{CaC{{O}_{3}}}}$ Lời giải chi tiết :
Theo giả thiết ta có : Do đó có hai trường hợp xảy ra : TH1: Ca(OH)2 dư, chỉ xảy ra phản ứng tạo kết tủa : CO2 + Ca(OH)2 → CaCO3 + H2O (1) 0,03 0,03 0,03 mdung dịch tăng = ${{m}_{{{H}_{2}}O}}+{{m}_{C{{O}_{2}}}}-{{m}_{CaC{{O}_{3}}}}=0,28\,\,gam\Rightarrow {{m}_{{{H}_{2}}O}}=0,28+3-0,03.44=\,\,1,96\,\,gam$ $\Rightarrow {{n}_{{{H}_{2}}O}}=0,1088\,\,mol\Rightarrow {{n}_{H}}=0,217\,\,mol\Rightarrow {{n}_{C}}:{{n}_{H}}=0,03:0,217=1:7,3\,\,(loại).$ TH2 : Ca(OH)2 phản ứng hết : CO2 + Ca(OH)2 → CaCO3 + H2O (1) 0,03 0,03 0,03 2CO2 + Ca(OH)2 → Ca(HCO3)2 (2) 0,02 0,01 $\Rightarrow {{n}_{C{{O}_{2}}}}=0,05\,\,mol.$ mdung dịch tăng = ${{m}_{{{H}_{2}}O}}+{{m}_{C{{O}_{2}}}}-{{m}_{CaC{{O}_{3}}}}=0,28\,\,gam\Rightarrow {{m}_{{{H}_{2}}O}}=0,28+3-0,05.44=\,\,1,08\,\,gam$ $\Rightarrow {{n}_{{{H}_{2}}O}}=0,06\,\,mol\Rightarrow {{n}_{H}}=0,12\,\,mol\Rightarrow {{n}_{C}}:{{n}_{H}}=0,05:0,12=5:12\,$ Vậy CTPT của ankan là C5H12
Câu 6 :
Hiđrocacbon mạch hở X trong phân tử chỉ chứa liên kết σ và có hai nguyên tử cacbon bậc ba trong một phân tử. Đốt cháy hoàn toàn 1 thể tích X sinh ra 6 thể tích CO2 (ở cùng điều kiện nhiệt độ, áp suất). Khi cho X tác dụng với Cl2 (theo tỉ lệ số mol 1 : 1), số dẫn xuất monoclo tối đa sinh ra là :
Đáp án : C Phương pháp giải :
- Xác định số nguyên tử C trong X Số C = \(\frac{{{n_{C{O_2}}}}}{{{n_X}}}\) - Xác định CTPT của X X chỉ chứa liên kết σ và có hai nguyên tử cacbon bậc ba trong một phân tử => X là ankan => số vị trí thế monoclo Lời giải chi tiết :
- Đốt cháy 1 thể tích X sinh ra 6 thể tích CO2 => trong X có 6 nguyên tử C - Vì X chỉ chứa liên kết σ và có hai nguyên tử cacbon bậc ba trong một phân tử => X là ankan C6H14 có công thức phân tử là (CH3)2 - CH – CH(CH3)2 => có 2 vị trí thế monoclo
Câu 7 :
Crackinh hoàn toàn 6,6 gam propan được hỗn hợp X gồm hai hiđrocacbon. Dẫn toàn bộ X qua bình đựng 400 ml dung dịch brom a mol/l thấy khí thoát ra khỏi bình có tỉ khối so metan là 1,1875. Giá trị a là :
Đáp án : B Phương pháp giải :
+) ${{n}_{{{C}_{3}}{{H}_{8}}}}={{n}_{C{{H}_{4}}}}={{n}_{{{C}_{2}}{{H}_{4}}}}$ +) Sau khi qua bình đựng brom khí thoát ra khỏi bình có nên ngoài CH4 còn có C2H4 dư. +) Từ $\bar{M}=19$ => a +) nC2H4 phản ứng với Br2 = nBr2 Lời giải chi tiết :
Các phản ứng xảy ra : C3H8 $\xrightarrow{{}}$ CH4 + C2H4 (1) C2H4 + Br2 $\xrightarrow{{}}$ C2H4Br2 (2) Theo (1) và giả thiết ta có : ${{n}_{{{C}_{3}}{{H}_{8}}}}={{n}_{C{{H}_{4}}}}={{n}_{{{C}_{2}}{{H}_{4}}}}=\frac{6,6}{44}=0,15\,\,mol$ Sau khi qua bình đựng brom khí thoát ra khỏi bình có $\overline{M}=1,1875.16=19$ nên ngoài CH4 còn có C2H4 dư. Gọi nC2H4 dư = a mol $\bar{M}=\frac{16.0,15+28a}{0,15+a}=19\,\,=>\,\,a=0,05\,\,mol$ => nC2H4 phản ứng với Br2 = 0,15 – 0,05 = 0,1 mol => nBr2 = 0,1 mol => CM Br2 = $\frac{0,1}{0,4}=0,25M$
Câu 8 :
Cho các chất sau : C2H6 (I) C3H8 (II) n-C4H10 (III) i-C4H10 (IV) Nhiệt độ sôi tăng dần theo dãy là :
Đáp án : C Phương pháp giải :
Khi cấu trúc phân tử càng gọn thì tonc, tos càng cao và ngược lại. Lời giải chi tiết :
Vì phân tử i-C4H10 có cấu trúc cồng kềnh hơn n-C4H10 nên tos nhỏ hơn: (IV) < (III) Nhiệt độ sôi tăng dần khi tăng khối lượng phân tử => (I) < (II) < (IV) < (III)
Câu 9 :
Cho các chất sau : 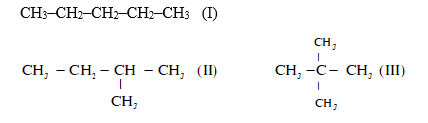 Thứ tự tăng dần nhiệt độ sôi của các chất là :
Đáp án : C Phương pháp giải :
Khi cấu trúc phân tử càng cồng kềnh thì tonc, tos càng thấp và ngược lại. Lời giải chi tiết :
Cả 3 chất đều có 5C => tos phụ thuộc vào cấu trúc phân tử. Phân tử càng cồng kềnh thì nhiệt độ sôi càng thấp => (III) có cấu trúc cồng kềnh nhất => (III) < (II) < (I)
Câu 10 :
Trong phòng thí nghiệm, người ta điều chế CH4 bằng phản ứng
Đáp án : C Lời giải chi tiết :
Trong phòng thí nghiệm, CH4 được điều chế bằng cách nung natri axetat với vôi tôi xút
Câu 11 :
$A{l_4}{C_3} + {\text{ }}{H_2}O \to X + {\text{ }}Al{\left( {OH} \right)_3}$. X là
Đáp án : A Lời giải chi tiết :
$A{l_4}{C_3} + {\text{12}}{H_2}O \to 3C{H_4} + {\text{ 4}}Al{\left( {OH} \right)_3}$
Câu 12 :
Từ CH4 (các chất vô cơ và điều kiện có đủ) có thể điều chế các chất nào sau đây?
Đáp án : D Phương pháp giải :
Xem lại phương pháp điều chế và ứng dụng của metan Lời giải chi tiết :
$C{H_4} + C{l_2}\xrightarrow{{as}}C{H_3}Cl + HCl$ $C{H_4}\xrightarrow{{1500^\circ C,\,xt}}{C_2}{H_2}\xrightarrow{{ + {H_2}(Ni,t^\circ )}}{C_2}{H_6}$ $C{H_4}\xrightarrow{{1500^\circ C,\,xt}}{C_2}{H_2}\xrightarrow{{đime{\text{ }}hóa}}{C_4}{H_4}\xrightarrow{{ + {H_2}(Ni,t^\circ )}}{C_4}{H_{10}}\xrightarrow{{crackinh}}{C_3}{H_6}\xrightarrow{{ + {H_2}(Ni,t^\circ )}}{C_3}{H_8}$ |



















Danh sách bình luận