Đề kiểm tra 1 tiết Hóa 11 chương 2: Cacbon - Silic - Đề số 1Đề bài
Câu 1 :
Thành phần chính của khí than ướt là
Câu 2 :
Thành phần chính của khí than khô là
Câu 3 :
Silic tác dụng với chất nào sau đây ở nhiệt độ thường
Câu 4 :
Số oxi hóa cao nhất của silic thể hiện ở hợp chất nào sau đây
Câu 5 :
Cấu hình electron của nguyên tử cacbon là :
Câu 6 :
Thêm từ từ từng giọt của 100 ml dung dịch chứa Na2CO3 1,2M và NaHCO3 0,6M vào 200 ml dung dịch HCl 1M, sau phản ứng hoàn toàn thu được dung dịch X. Cho dung dịch nước vôi trong dư vào dung dịch X thì thu được bao nhiêu gam kết tủa ?
Câu 7 :
Phản ứng dùng để khắc hình, khắc chữ lên thủy tinh là phản ứng giữa SiO2 với:
Câu 8 :
Chọn câu trả lời đúng: Trong các phản ứng hoá học, cacbon
Câu 9 :
Sục từ từ khí CO2 vào 100,0 ml dung dịch chứa đồng thời NaOH 1M, Ba(OH)2 0,5M và BaCl2 0,7M. Thể tích khí CO2 cần sục vào (đktc) để kết tủa thu được là lớn nhất là
Câu 10 :
Nhỏ rất từ từ đến hết 200ml dung dịch X chứa đồng thời H2SO4 aM và HCl 0,15M vào 100ml dung dịch chứa đồng thời NaOH 0,5M và Na2CO3 0,4M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,448 lít khí (đktc). Giá trị của a là:
Câu 11 :
Cho 4,48 lít khí CO (ở đktc) từ từ đi qua ống sứ nung nóng đựng 8 gam một oxit sắt đến khi phản ứng xảy ra hoàn toàn. Khí thu được sau phản ứng có tỉ khối so với hiđro bằng 20. Công thức của oxit sắt và phần trăm thể tích của khí CO2 trong hỗn hợp khí sau phản ứng là:
Câu 12 :
Có các axit sau: HCl, H2SiO3, H2CO3.Sắp xếp theo chiều tính axit tăng dần của 3 axit trên
Câu 13 :
Cho các chất: O2 (1), NaOH (2), Mg (3), Na2CO3 (4), SiO2 (5), HCl (6), CaO (7), Al (8), ZnO (9), H2O (10), NaHCO3 (11), KMnO4 (12), HNO3 (13), Na2O (14). Cacbon đioxit phản ứng trực tiếp được với bao nhiêu chất?
Câu 14 :
Khí CO2 điều chế trong phòng TN thường lẫn khí HCl và hơi nước. Để loại bỏ HCl và hơi nước ra khỏi hỗn hợp, ta dùng
Câu 15 :
Than được dùng làm chất độn cao su, sản xuất mực in, xi đánh giầy là:
Câu 16 :
Dung dịch đậm đặc của hợp chất nào sau đây được gọi là thủy tinh lỏng
Câu 17 :
Một loại thủy tinh có chứa 13% Na2O; 11,7% CaO; 75,3% SiO2 về khối lượng. Thành phần của thủy tinh này được viết dưới dạng hợp chất các oxit là
Câu 18 :
Cho 3,60 gam cacbon tác dụng với 8,10 gam nhôm. Khối lượng nhôm cacbua tạo thành nếu hiệu suất của phản ứng 70% là
Câu 19 :
Có 5 lọ mất nhãn đựng 5 chất bột màu trắng: NaCl, Na2CO3, Na2SO4, BaCO3, BaSO4. Chỉ dùng nước và khí CO2 thì có thể nhận được mấy chất
Câu 20 :
Dung dịch X chứa a mol NaHCO3 và b mol Na2CO3. Thực hiện các thí ngiệm sau TN1: cho (a + b) mol CaCl2 vào dd X TN2: cho (a + b) mol Ca(OH)2 vào dd X Khối lượng kết tủa thu được trong 2 TN là
Câu 21 :
Nhiệt phân hoàn toàn hỗn hợp BaCO3, MgCO3, Al2O3 được rắn X và khí Y. Hoà tan rắn X vào nước thu được kết tủa E và dung dịch Z. Sục khí Y dư vào dung dịch Z thấy xuất hiện kết tủa F, hoà tan E vào dung dịch NaOH dư thấy tan một phần được dung dịch G. Các chất trong dung dịch G và kết tủa F là
Câu 22 :
Khí X được dùng nhiều trong ngành sản xuất nước giải khát và bia rượu. Tuy nhiên, việc gia tăng nồng độ khí X trong không khí là nguyên nhân làm trái đất nóng lên. Khí X là
Câu 23 :
Cho 3,36 lít khí CO (đktc) phản ứng vừa đủ với 20 gam hỗn hợp X gồm CuO và MgO. Phần trăm khối lượng của MgO trong X là
Câu 24 :
Thuốc nổ đen là hỗn hợp
Câu 25 :
Trong các chất sau, chất có độ cứng lớn nhất là
Câu 26 :
Một chất Y có tính chất sau: - Không màu, rất độc. - Cháy trong không khí với ngọn lửa màu xanh và sinh ra chất khí làm đục nước vôi trong. Y là:
Câu 27 :
Oxit nào sau đây không tạo muối?
Câu 28 :
Từ 1 lít hỗn hợp CO và CO2 có thể điều chế tối đa bao nhiêu lít CO2? (H = 100%)
Câu 29 :
Dẫn luồng khí CO dư qua hỗn hợp Al2O3; CuO; MgO; Fe2O3 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn thu được chất rắn là
Câu 30 :
Kim cương và than chì là các dạng
Lời giải và đáp án
Câu 1 :
Thành phần chính của khí than ướt là
Đáp án : A Lời giải chi tiết :
Thành phần chính của khí than ướt là CO, CO2, H2, N2
Câu 2 :
Thành phần chính của khí than khô là
Đáp án : C Lời giải chi tiết :
Thành phần chính của khí than than khô là CO, CO2, N2
Câu 3 :
Silic tác dụng với chất nào sau đây ở nhiệt độ thường
Đáp án : B Lời giải chi tiết :
Silic tác dụng được với F2 ở nhiệt độ thường.
Câu 4 :
Số oxi hóa cao nhất của silic thể hiện ở hợp chất nào sau đây
Đáp án : D Lời giải chi tiết :
Số oxi hóa cao nhất của Si trong hợp chất là +4 => thể hiện trong SiO2 và SiF4
Câu 5 :
Cấu hình electron của nguyên tử cacbon là :
Đáp án : B Lời giải chi tiết :
C (Z = 6) có cấu hình e: 1s22s22p2
Câu 6 :
Thêm từ từ từng giọt của 100 ml dung dịch chứa Na2CO3 1,2M và NaHCO3 0,6M vào 200 ml dung dịch HCl 1M, sau phản ứng hoàn toàn thu được dung dịch X. Cho dung dịch nước vôi trong dư vào dung dịch X thì thu được bao nhiêu gam kết tủa ?
Đáp án : D Phương pháp giải :
- Tính số mol Na2CO3 và NaHCO3 có trong X Tính số mol Na2CO3 và NaHCO3 => tỉ lệ phản ứng khi phản ứng với HCl Đặt nNaHCO3 phản ứng = x mol => nNa2CO3 phản ứng = 2x mol Các phản ứng: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O NaHCO3 + HCl → NaCl + CO2 + H2O ${{n}_{HCl}}=\text{ }2.{{n}_{N{{a}_{2}}C{{O}_{3}}}}+\text{ }{{n}_{NaHC{{O}_{3}}}}$ => số mol Na2CO3 và NaHCO3 - Tính khối lượng kết tủa ${{n}_{CaC{{O}_{3}}}}=\text{ }{{n}_{CO_{3}^{2-}}}+\text{ }{{n}_{HCO_{3}^{-}}}$ Lời giải chi tiết :
- Ta có \(\begin{gathered} - Khi cho từ từ 100 ml dung dịch vào HCl thì cả 2 chất đều phản ứng đồng thời theo tỉ lệ mol Na2CO3 : NaHCO3 = 1,2 : 0,6 = 2 : 1 - Đặt x là số mol NaHCO3 phản ứng => nNa2CO3 = 2x mol Các phản ứng: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O NaHCO3 + HCl → NaCl + CO2 + H2O => nHCl = 0,2 = 2.2x + x => x = 0,04 mol \(\begin{array}{*{20}{l}} Khi cho nước vôi trong vào X thì tạo kết tủa CaCO3 có ${{n}_{CaC{{O}_{3}}}}=\text{ }{{n}_{CO_{3}^{2-}}}+\text{ }{{n}_{HCO_{3}^{-}}}$ = 0,06 mol => m kết tủa = 6 gam
Câu 7 :
Phản ứng dùng để khắc hình, khắc chữ lên thủy tinh là phản ứng giữa SiO2 với:
Đáp án : D Lời giải chi tiết :
Phản ứng dùng để khắc hình, khắc chữ lên thủy tinh là phản ứng giữa SiO2 với HF SiO2 + HF → SiF4 + 2H2O
Câu 8 :
Chọn câu trả lời đúng: Trong các phản ứng hoá học, cacbon
Đáp án : B Lời giải chi tiết :
Trong các phản ứng hoá học, cacbon vừa thể hiện tính khử vừa thể hiện tính oxi hóa.
Câu 9 :
Sục từ từ khí CO2 vào 100,0 ml dung dịch chứa đồng thời NaOH 1M, Ba(OH)2 0,5M và BaCl2 0,7M. Thể tích khí CO2 cần sục vào (đktc) để kết tủa thu được là lớn nhất là
Đáp án : B Phương pháp giải :
nBa2+ > ½.nOH- => kết tủa cực đại khi OH- tạo hết thành CO32- +) nCO2 = nCO32- = nBa2+ Lời giải chi tiết :
nOH- = 0,2 mol nBa2+ = 0,12 mol > ½.nOH- => kết tủa cực đại khi OH- tạo hết thành CO32- => nBaCO3 max = 0,1 mol => nCO2 = nCO32- = nBa2+ = 0,1 mol => V = 2,24 lít
Câu 10 :
Nhỏ rất từ từ đến hết 200ml dung dịch X chứa đồng thời H2SO4 aM và HCl 0,15M vào 100ml dung dịch chứa đồng thời NaOH 0,5M và Na2CO3 0,4M. Sau khi các phản ứng xảy ra hoàn toàn, thu được 0,448 lít khí (đktc). Giá trị của a là:
Đáp án : D Phương pháp giải :
- Chú ý thứ tự xảy ra phản ứng H+ + OH- → H2O H+ + CO32- → HCO3- H+ + HCO3- → H2O + CO2 - Tính số mol H+ \({n_{{H^ + }}} = {\text{ }}2{n_{{H_2}S{O_4}}} + {\text{ }}{n_{HCl}} = {\text{ }}{n_{O{H^ - }}} + {\text{ }}{n_{C{O_3}^{2 - }}} + {\text{ }}{n_{C{O_2}}}\) Lời giải chi tiết :
- Thứ tự phản ứng : H+ + OH- → H2O H+ + CO32- → HCO3- H+ + HCO3- → H2O + CO2 \([{n_{{H^ + }}} = {\text{ }}2{n_{{H_2}S{O_4}}} + {\text{ }}{n_{HCl}} = {\text{ }}{n_{O{H^ - }}} + {\text{ }}{n_{C{O_3}^{2 - }}} + {\text{ }}{n_{C{O_2}}}\) => 0,2.(2a + 0,15) = 0,05 + 0,04 + 0,02 => a = 0,2M
Câu 11 :
Cho 4,48 lít khí CO (ở đktc) từ từ đi qua ống sứ nung nóng đựng 8 gam một oxit sắt đến khi phản ứng xảy ra hoàn toàn. Khí thu được sau phản ứng có tỉ khối so với hiđro bằng 20. Công thức của oxit sắt và phần trăm thể tích của khí CO2 trong hỗn hợp khí sau phản ứng là:
Đáp án : D Phương pháp giải :
+) Mkhí sau phản ứng = 40 => khí sau phản ứng gồm CO2 (x mol) và CO dư (y mol) +) Bảo toàn C: nCO ban đầu = nCO2 + nCO dư => PT(1) \(\bar M = \frac{{44x + 28y}}{{x + y}} = 40\) => PT(2) +) nO trong oxit = nCO2 +) mFe = moxit – mO trong oxit Lời giải chi tiết :
nCO ban đầu = 0,2 mol Mkhí sau phản ứng = 40 => khí sau phản ứng gồm CO2 (x mol) và CO dư (y mol) Bảo toàn C: nCO ban đầu = nCO2 + nCO dư => x + y = 0,2 (1) \(\bar M = \frac{{44x + 28y}}{{x + y}} = 40\,\,\,(2)\) Từ (1) và (2) => nCO2 = 0,15 mol và nCO dư = 0,05 mol => %CO2 = 75% Ta có: nO trong oxit = nCO2 = 0,15 mol mFe = moxit – mO trong oxit => nFe = (8 – 0,15.16) : 56 = 0,1 mol Gọi công thức của oxit là FexOy => x : y = 0,1 : 0,15 = 2 : 3
Câu 12 :
Có các axit sau: HCl, H2SiO3, H2CO3.Sắp xếp theo chiều tính axit tăng dần của 3 axit trên
Đáp án : B Lời giải chi tiết :
Theo chiều tính axit tăng dần của 3 axit trên là: H2SiO3, H2CO3, HCl
Câu 13 :
Cho các chất: O2 (1), NaOH (2), Mg (3), Na2CO3 (4), SiO2 (5), HCl (6), CaO (7), Al (8), ZnO (9), H2O (10), NaHCO3 (11), KMnO4 (12), HNO3 (13), Na2O (14). Cacbon đioxit phản ứng trực tiếp được với bao nhiêu chất?
Đáp án : C Lời giải chi tiết :
CO2 phản ứng được với: NaOH, Mg, Na2CO3, CaO, H2O, Na2O, Al
Câu 14 :
Khí CO2 điều chế trong phòng TN thường lẫn khí HCl và hơi nước. Để loại bỏ HCl và hơi nước ra khỏi hỗn hợp, ta dùng
Đáp án : D Phương pháp giải :
Xem lại lí thuyết hợp chất cacbon Lời giải chi tiết :
A loại vì NaOH phản ứng với CO2 và HCl B loại vì Na2CO3 phản ứng với CO2 và HCl C loại vì H2SO4 đặc chỉ tách được nước, không tách được CO2và HCl. D đúng vì NaHCO3 chỉ phản ứng với HCl sinh ra khí CO2 và H2SO4 hút nước. NaHCO3 + HCl →NaCl + CO2 + H2O
Câu 15 :
Than được dùng làm chất độn cao su, sản xuất mực in, xi đánh giầy là:
Đáp án : B Lời giải chi tiết :
Than được dùng làm chất độn cao su, sản xuất mực in, xi đánh giầy là than muội.
Câu 16 :
Dung dịch đậm đặc của hợp chất nào sau đây được gọi là thủy tinh lỏng
Đáp án : A Lời giải chi tiết :
Thủy tinh lỏng là dung dịch đậm đặc của Na2SiO3 và K2SiO3
Câu 17 :
Một loại thủy tinh có chứa 13% Na2O; 11,7% CaO; 75,3% SiO2 về khối lượng. Thành phần của thủy tinh này được viết dưới dạng hợp chất các oxit là
Đáp án : A Phương pháp giải :
Công thức thủy tinh có dạng: xNa2O.yCaO.zSiO2 $x{\rm{ }}:{\rm{ }}y{\rm{ }}:{\rm{ }}z{\rm{ }} = \,\frac{{\% N{a_2}O}}{{{M_{N{a_2}O}}}}:\frac{{\% CaO}}{{{M_{CaO}}}}:\frac{{\% Si{{\rm{O}}_2}}}{{{M_{Si{{\rm{O}}_2}}}}}$ Lời giải chi tiết :
Công thức thủy tinh có dạng: xNa2O.yCaO.zSiO2 $x{\rm{ }}:{\rm{ }}y{\rm{ }}:{\rm{ }}z{\rm{ }} = \,\frac{{\% N{a_2}O}}{{{M_{N{a_2}O}}}}:\frac{{\% CaO}}{{{M_{CaO}}}}:\frac{{\% Si{{\rm{O}}_2}}}{{{M_{Si{{\rm{O}}_2}}}}}\,\, = \,\,\frac{{13}}{{62}}:\frac{{11,7}}{{56}}:\frac{{75,3}}{{60}} = 0,21:0,21:1,255 = 1:1:6$
Câu 18 :
Cho 3,60 gam cacbon tác dụng với 8,10 gam nhôm. Khối lượng nhôm cacbua tạo thành nếu hiệu suất của phản ứng 70% là
Đáp án : B Phương pháp giải :
+) 3C + 4Al $\xrightarrow{{{t}^{o}}}$ Al4C3 Xét tỉ lệ, biện luân chất dư, chất hết +) nAl4C3 lí thuyết = nAl / 4 +) nAl4C3 thực tế = nAl4C3 lí thuyết . H Lời giải chi tiết :
nC = 0,3 mol; nAl = 0,3 mol 3C + 4Al $\xrightarrow{{{t}^{o}}}$ Al4C3 Xét tỉ lệ : \(\frac{{{n_C}}}{3} = \frac{{0,3}}{3} = 0,1\,\, > \,\,\frac{{{n_{Al}}}}{4} = \frac{{0,3}}{4} = 0,075\) => phản ứng tính theo Al nAl4C3 lí thuyết = nAl / 4 = 0,075 mol H = 70% => nAl4C3 thực tế = 0,075.70/100 = 0,0525 mol => mAl4C3 = 7,56 gam Chú ý
không xét tỉ lệ dư thừa => tính nhầm hiệu suất theo C => chọn nhầm C
Câu 19 :
Có 5 lọ mất nhãn đựng 5 chất bột màu trắng: NaCl, Na2CO3, Na2SO4, BaCO3, BaSO4. Chỉ dùng nước và khí CO2 thì có thể nhận được mấy chất
Đáp án : D Lời giải chi tiết :
Vậy dùng nước và CO2 ta có thể nhận biết được cả 5 dung dịch
Câu 20 :
Dung dịch X chứa a mol NaHCO3 và b mol Na2CO3. Thực hiện các thí ngiệm sau TN1: cho (a + b) mol CaCl2 vào dd X TN2: cho (a + b) mol Ca(OH)2 vào dd X Khối lượng kết tủa thu được trong 2 TN là
Đáp án : B Phương pháp giải :
TN1: chỉ có Na2CO3 phản ứng: nCaCO3 = nNa2CO3 TN2: cả 2 chất đều phản ứng NaHCO3 + Ca(OH)2 → CaCO3 ↓ + NaOH + H2O Na2CO3 + Ca(OH)2 → CaCO3 ↓ + 2NaOH Lời giải chi tiết :
TN1: chỉ có Na2CO3 phản ứng: nCaCO3 = nNa2CO3 = b mol TN2: cả 2 chất đều phản ứng NaHCO3 + Ca(OH)2 → CaCO3 ↓ + NaOH + H2O a → a → a Na2CO3 + Ca(OH)2 → CaCO3 ↓ + 2NaOH b → b → b => ở TN2 thu được kết tủa nhiều hơn ở TN1
Câu 21 :
Nhiệt phân hoàn toàn hỗn hợp BaCO3, MgCO3, Al2O3 được rắn X và khí Y. Hoà tan rắn X vào nước thu được kết tủa E và dung dịch Z. Sục khí Y dư vào dung dịch Z thấy xuất hiện kết tủa F, hoà tan E vào dung dịch NaOH dư thấy tan một phần được dung dịch G. Các chất trong dung dịch G và kết tủa F là
Đáp án : B Phương pháp giải :
Dựa vào các phản ứng hóa học => xác định sản phẩm sau phản ứng Lời giải chi tiết :
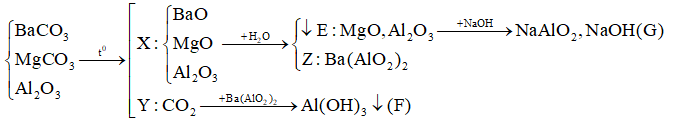 (Vì E tan 1 phần trong kiềm => trong E chứa Al2O3 còn dư => dung dịch Z không còn Ba(OH)2
Câu 22 :
Khí X được dùng nhiều trong ngành sản xuất nước giải khát và bia rượu. Tuy nhiên, việc gia tăng nồng độ khí X trong không khí là nguyên nhân làm trái đất nóng lên. Khí X là
Đáp án : D Lời giải chi tiết :
CO2 được dùng nhiều trong ngành sản xuất nước giải khát và bia rượu, tuy nhiên, việc gia tăng nồng độ khí X trong không khí là nguyên nhân làm trái đất nóng lên.
Câu 23 :
Cho 3,36 lít khí CO (đktc) phản ứng vừa đủ với 20 gam hỗn hợp X gồm CuO và MgO. Phần trăm khối lượng của MgO trong X là
Đáp án : D Phương pháp giải :
Khi cho CO qua hỗn hợp CuO và MgO chỉ có CuO phản ứng. Viết PTHH xảy ra, tính mol CuO theo mol CO, từ đó tính được % CuO và suy ra được %MgO còn lại. Lời giải chi tiết :
nCO(đktc) = 3,36 :22,4 = 0,15 (mol) Khi cho CO qua hỗn hợp CuO và MgO chỉ có CuO phản ứng CO + CuO \(\xrightarrow{{{t^0}}}\) Cu + H2O 0,15 → 0,15 (mol) nCuO = 0,15 (mol) => mCuO = 0,15.80 = 12 (g) %CuO = (mCuO : mhh).100% = (12 : 20).100% = 60% => %MgO = 100% -%CuO = 40%.
Câu 24 :
Thuốc nổ đen là hỗn hợp
Đáp án : A Phương pháp giải :
Thuốc nổ đen là hỗn hợp của muôi kali nitrat, cacbon và lưu huỳnh Lời giải chi tiết :
Thuốc nổ đen là hỗn hợp gồm KNO3, C và S.
Câu 25 :
Trong các chất sau, chất có độ cứng lớn nhất là
Đáp án : B Lời giải chi tiết :
Kim cương + tinh thể trong suốt, không màu, không dẫn điện, dẫn nhiệt kém + cúng nhất trong tất cả các chất
Câu 26 :
Một chất Y có tính chất sau: - Không màu, rất độc. - Cháy trong không khí với ngọn lửa màu xanh và sinh ra chất khí làm đục nước vôi trong. Y là:
Đáp án : B Lời giải chi tiết :
CO là khí có những tính chất thỏa mãn với đề bài: - Không màu, rất độc - Cháy trong không khí với ngọn lửa màu xanh và sinh ra khí làm đục nước vôi trong: 2CO + O2 → 2CO2 (nhiệt độ) CO2+ Ca(OH)2 → CaCO3 + H2O
Câu 27 :
Oxit nào sau đây không tạo muối?
Đáp án : C Lời giải chi tiết :
CO là một oxit trung tính nên không có khả năng tạo muối.
Câu 28 :
Từ 1 lít hỗn hợp CO và CO2 có thể điều chế tối đa bao nhiêu lít CO2? (H = 100%)
Đáp án : A Phương pháp giải :
Bảo toàn nguyên tố C. Lời giải chi tiết :
Bảo toàn nguyên tố C ta có: nCO2 thu được = nCO + nCO2 bđ Hay V CO2 thu được = VCO + VCO2 bđ = 1 lít
Câu 29 :
Dẫn luồng khí CO dư qua hỗn hợp Al2O3; CuO; MgO; Fe2O3 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn thu được chất rắn là
Đáp án : D Phương pháp giải :
CO khử được các oxit của KL đứng sau Al trong dãy hoạt động hóa học. Lời giải chi tiết :
CO khử được các oxit CuO, Fe2O3 nên sau phản ứng thu được chất rắn là: Al2O3, Cu, MgO, Fe.
Câu 30 :
Kim cương và than chì là các dạng
Đáp án : C Lời giải chi tiết :
Kim cương và than chì là hai dạng thù hình của cacbon. |


















