Đề kiểm tra 1 tiết Hóa 11 chương 1: Sự điện li - Đề số 1Đề bài
Câu 1 :
Công thức tính độ điện li là:
Câu 2 :
Theo A-rê-ni-ut, chất nào sau đây là axit ?
Câu 3 :
Hai dung dịch có pH bằng nhau là: NaOH aM và Ba(OH)2 bM. Quan hệ giữa a và b là:
Câu 4 :
Chất điện li yếu có độ điện li
Câu 5 :
Chọn phát biểu đúng trong số các phát biểu sau đây ?
Câu 6 :
Các dung dịch NaCl, NaOH, NH3, Ba(OH)2 có cùng nồng độ mol, dung dịch có pH lớn nhất là
Câu 7 :
Ở các vùng đất phèn người ta bón vôi để làm
Câu 8 :
Chất nào dưới đây vừa phản ứng được với dung dịch HCl vừa phản ứng được với dung dịch NaOH?
Câu 9 :
Trong các ion sau đây, ion nào tan trong nước cho môi trường trung tính?
Câu 10 :
Có 4 dung dịch: Natri clorua, rượu etylic (C2H5OH), axit axetic (CH3COOH), kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
Câu 11 :
Trộn V1 lít dung dịch axit mạnh (pH = 5) với V2 lít kiềm mạnh (pH = 9) theo tỉ lệ thể tích nào sau đây để thu được dung dịch có pH = 6
Câu 12 :
Cho dung dịch X chứa 0,1 mol Al3+, 0,2 mol Mg2+, 0,2 mol NO3-, x mol Cl-, y mol Cu2+ - Nếu cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủa - Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là :
Câu 13 :
Dung dịch axit fomic 0,007M có pH = 3. Kết luận nào sau đây không đúng ?
Câu 14 :
Muối nào tan trong nước tạo dung dịch có môi trường kiềm ?
Câu 15 :
Cho m gam hỗn hợp Mg, Al vào 250 ml dung dịch X chứa hỗn hợp axit HCl 1M và axit H2SO4 0,5M thu được 5,32 lít H2 (ở đktc) và dung dịch Y (coi thể tích dung dịch không đổi). Dung dịch Y có pH là:
Câu 16 :
Cho phản ứng hóa học: NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau đây có cùng phương trình ion rút gọn với phản ứng trên?
Câu 17 :
Hòa tan hoàn toàn m gam Al2(SO4)3 vào nước thu được dung dịch A chứa 0,6 mol Al3+
Câu 18 :
Tính pH của 300ml dung dịch (gồm 100 ml Ba(OH)2 0,1M và 200 ml NaOH 0,05M)
Câu 19 :
Cho các chất sau: SO2, C6H6 , C2H6, Ca(HCO3)2, H2SO4, NaClO, Mg(OH)2. Số chất hòa tan vào trong nước tạo thành chất điện li là:
Câu 20 :
Phương trình ion rút gọn của phản ứng cho biết
Câu 21 :
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
Câu 22 :
Trộn 150 ml dung dịch MgCl2 0,5M với 50 ml dung dịch NaCl 1M thì nồng độ ion Cl- trong dung dịch mới là
Câu 23 :
Đối với dung dịch axit mạnh HNO3 0,1M nếu bỏ qua sự điện li của nước thì đánh giá nào sau đây là đúng?
Câu 24 :
Thể tích (ml) của dung dịch NaOH 0,3M cần để trung hòa 3 lít dung dịch HCl 0,01M là
Câu 25 :
Cặp chất nào sau đây tác dụng với nhau tạo ra sản phẩm đều là chất khí?
Câu 26 :
Chất nào sau đây khi tan trong nước không phân li ra ion?
Câu 27 :
Dung dịch Y chứa 0,02 mol Mg2+; 0,03 mol Na+; 0,03 mol Cl- và y mol SO42-. Giá trị của y là
Câu 28 :
Chất nào sau đây không dẫn điện được?
Câu 29 :
Dung dịch X có chứa a mol Na+, b mol Mg2+, c mol Cl- và d mol SO42-. Biểu thức nào sau đây đúng:
Câu 30 :
Dung dịch A chứa Mg2+, Ca2+, 0,2 mol Cl-, 0,3 mol \(NO_3^ - \). Thêm dần dung dịch Na2CO3 1M vào dung dịch A cho đến khi thu được lượng kết tủa lớn nhất thì dừng lại. Thể tích dung dịch Na2CO3 đã thêm vào dung dịch là
Lời giải và đáp án
Câu 1 :
Công thức tính độ điện li là:
Đáp án : D Lời giải chi tiết :
Công thức tính độ điện li là $\alpha $ = nphân li / nchất tan
Câu 2 :
Theo A-rê-ni-ut, chất nào sau đây là axit ?
Đáp án : B Lời giải chi tiết :
Theo A-rê-ni-ut, axit là chất phân li ra H+ => HCl là axit
Câu 3 :
Hai dung dịch có pH bằng nhau là: NaOH aM và Ba(OH)2 bM. Quan hệ giữa a và b là:
Đáp án : D Phương pháp giải :
áp dụng công thức: pOH = -log[OH-] Lời giải chi tiết :
pOHNaOH = -log(a) pOHBa(OH)2 = -log(2b) Vì pHNaOH = pHBa(OH)2 => pOHNaOH = pOHBa(OH)2 => -log(a) = -log(2b) => a = 2b Chú ý
tính pOH theo nồng độ ion OH- nên phải nhân 2 ở biểu thức tính pOH của Ba(OH)2
Câu 4 :
Chất điện li yếu có độ điện li
Đáp án : C Lời giải chi tiết :
Chất điện li yếu có độ điện li: 0 < $\alpha $< 1
Câu 5 :
Chọn phát biểu đúng trong số các phát biểu sau đây ?
Đáp án : A Lời giải chi tiết :
A đúng vì pH tăng thì nồng độ OH- trong dung dịch tăng => độ axit giảm C. pH < 7 là môi trường axit => quỳ hóa đỏ D. pH > 7 là môi trường bazơ => quỳ hóa xanh
Câu 6 :
Các dung dịch NaCl, NaOH, NH3, Ba(OH)2 có cùng nồng độ mol, dung dịch có pH lớn nhất là
Đáp án : B Phương pháp giải :
pH = -log[H+] Mà: [H+].[OH-] = 10-14 => log[H+] + log[OH-] = - 14 => - log[H+] = 14 + log[OH-] => pH = 14 + log[OH-] => Giá trị pH tỉ lệ thuận với nồng độ OH- => chất càng phân li ra nhiều OH- thì chất đó có pH càng lớn Lời giải chi tiết :
$Ba{(OH)_2}{\text{ }}\xrightarrow{{}}{\text{ B}}{{\text{a}}^{2 + }}{\text{ }} + {\text{ 2O}}{{\text{H}}^ - }$ Cùng nồng độ ban đầu thì Ba(OH)2 phân li cho [OH−] lớn nhất. Nên pH lớn nhất
Câu 7 :
Ở các vùng đất phèn người ta bón vôi để làm
Đáp án : A Phương pháp giải :
Cần nhớ vôi có tính kiềm => tác dụng được với axit Lời giải chi tiết :
Đất bị nhiễm phèn là đất chua chứa nhiều ion H+, do vậy người ta phải bón vôi để trung hòa bớt ion H+ giúp tăng pH của đất lên từ 7 - 9 => môi trường đất ổn định
Câu 8 :
Chất nào dưới đây vừa phản ứng được với dung dịch HCl vừa phản ứng được với dung dịch NaOH?
Đáp án : D Lời giải chi tiết :
Chất vừa phản ứng được với dung dịch HCl vừa phản ứng được với dung dịch NaOH là NaHCO3
Câu 9 :
Trong các ion sau đây, ion nào tan trong nước cho môi trường trung tính?
Đáp án : A Phương pháp giải :
Xem lại lí thuyết axit – bazơ – muối Lời giải chi tiết :
Ion tan trong nước cho môi trường trung tính là Na+
Câu 10 :
Có 4 dung dịch: Natri clorua, rượu etylic (C2H5OH), axit axetic (CH3COOH), kali sunfat đều có nồng độ 0,1 mol/l. Khả năng dẫn điện của các dung dịch đó tăng dần theo thứ tự nào trong các thứ tự sau:
Đáp án : B Phương pháp giải :
- Xác định các chất điện li - Viết phương trình điện li, so sánh độ dẫn điện của các chất điện li Các dung dịch có cùng nồng độ, dung dịch nào phân li ra nhiều ion sẽ dẫn điện tốt hơn Lời giải chi tiết :
- C2H5OH tan trong nước nhưng không phân li ra ion=>không có khả năng dẫn điện. - CH3COOH là chất điện li yếu =>dẫn điện yếu hơn so với 2 muối Cùng nồng độ 0,1 mol/l thì: NaCl →Na+ +Cl− ; K2SO4 →2K+ + SO42− K2SO4 phân li ra nhiều ion hơn nên dẫn điện mạnh hơn NaCl. => C2H5OH < CH3COOH < NaCl < K2SO4
Câu 11 :
Trộn V1 lít dung dịch axit mạnh (pH = 5) với V2 lít kiềm mạnh (pH = 9) theo tỉ lệ thể tích nào sau đây để thu được dung dịch có pH = 6
Đáp án : B Phương pháp giải :
+ V1 dung dịch axit có pH = 5 => nH+ + V2 dung dịch bazơ có pH = 9 => pOH => nOH- + Dung dịch thu được có pH = 6 < 7 => môi trường axit. Vậy H+ dư sau phản ứng => tính toán PT theo OH−
Lời giải chi tiết :
+ V1 dung dịch axit có pH = 5 ${\text{ = > [}}{{\text{H}}^ + }{\text{]}} = {10^{ - 5}}M = > {\text{ }}{n_{{H^ + }}}{\text{ = 1}}{{\text{0}}^{ - 5}}.{V_1}{\text{ }}(mol)$ + V2 dung dịch bazơ có pH = 9 => pOH = 14 − 9 = 5 ${\text{ = > [O}}{{\text{H}}^ - }{\text{]}} = {10^{ - 5}}M = > {\text{ }}{n_{O{H^ - }}} = {\text{ }}{10^{ - 5}}.{V_2}{\text{ (mol)}}$ + Dung dịch thu được có pH = 6 < 7 => môi trường axit. Vậy H+ dư sau phản ứng H+ + OH− → H2O Ban đầu (mol) 10−5V1 10−5V2 Phản ứng ( mol) 10−5V2 10−5V2 Sau (mol) 10−5 (V1 −V2) − + Ta có : pH = 6 => [H+] dư = 10−6 $\frac{{{{10}^{ - 5}}({V_1} - {\text{ }}{V_2})}}{{{V_1} + {V_2}}} = {10^{ - 6}} = > \frac{{{V_1}}}{{{V_2}}} = \frac{{11}}{9}$
Câu 12 :
Cho dung dịch X chứa 0,1 mol Al3+, 0,2 mol Mg2+, 0,2 mol NO3-, x mol Cl-, y mol Cu2+ - Nếu cho dung dịch X tác dụng với dung dịch AgNO3 dư thì thu được 86,1 gam kết tủa - Nếu cho 850 ml dung dịch NaOH 1M vào dung dịch X thì khối lượng kết tủa thu được là :
Đáp án : A Phương pháp giải :
+) Từ nAgCl => x +) BTĐT => y +) Xác định số mol các chất kết tủa khi tác dụng với NaOH => khối lượng Lời giải chi tiết :
Câu 13 :
Dung dịch axit fomic 0,007M có pH = 3. Kết luận nào sau đây không đúng ?
Đáp án : A Lời giải chi tiết :
A sai vì HCOOH là axit yếu, phân li không hoàn toàn nên nồng độ $[{H^ + }{\text{]}}$ giảm, pH thay đổi tuy nhiên còn phụ thuộc cả vào độ điện li nên không tuân theo đúng tỉ lệ pha loãng. B đúng vì HCOOH $\overset {} \leftrightarrows $ HCOO- + H+. Khi thêm dung dịch HCl, nghĩa là thêm H+, như vậy cân bằng hóa học chuyển dịch sang trái → độ điện li của axit giảm. C đúng (SGK 11NC – trang 9) D đúng vì HCOOH $\overset {} \leftrightarrows $ HCOO- + H+. pH = 3 → $[{H^ + }{\text{]}}$ = 0,001M $\alpha = \dfrac{{{C_{HCOOH\,phân\,li}}}}{{{C_{HCOOH\,b\,\,{\text{đ}}ầu}}}}.100\% = \dfrac{{0,001}}{{0,007}}.100\% = 14,29\% $
Câu 14 :
Muối nào tan trong nước tạo dung dịch có môi trường kiềm ?
Đáp án : B Phương pháp giải :
Muối tạo bởi bazơ mạnh và axit yếu có môi trường kiềm Lời giải chi tiết :
Muối tạo bởi bazơ mạnh và axit yếu có môi trường kiềm => Na2S
Câu 15 :
Cho m gam hỗn hợp Mg, Al vào 250 ml dung dịch X chứa hỗn hợp axit HCl 1M và axit H2SO4 0,5M thu được 5,32 lít H2 (ở đktc) và dung dịch Y (coi thể tích dung dịch không đổi). Dung dịch Y có pH là:
Đáp án : A Phương pháp giải :
Tính được nH+ ban đầu, nH2 BTNT H: nH+ dư = nH+ ban đầu – 2nH2 Từ đó tính được: pH = -log[H+] Lời giải chi tiết :
$\left. \begin{gathered}{n_{{H^ + }(HCl)}} = 0,25.1 = 0,25(mol) \hfill \\{n_{{H^ + }({H_2}S{O_4})}} = 0,25.0,5.2 = 0,25(mol) \hfill \\ \end{gathered} \right\}\,\,{n_{H_{(X)}^ + }} = 0,25 + 0,25 = 0,5mol$ ${n_{{H_2}}} = \dfrac{{5,32}}{{22,4}} = 0,2375(mol)$ Bảo toàn nguyên tố H ta có: \({n_{{H^ + }}}\) dư = \({n_{{H^ + }}} + 2{n_{{H_2}}}\) => ${n_{{H^ + }(Y)}} = 0,5 - 0,475 = 0,025(mol)\,\, \Rightarrow [{H^ + }] = \dfrac{{0,025}}{{0,250}} = 0,1 = {10^{ - 1}}(mol/lít)$ → pH = 1
Câu 16 :
Cho phản ứng hóa học: NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau đây có cùng phương trình ion rút gọn với phản ứng trên?
Đáp án : B Phương pháp giải :
Bước 1: Viết phương trình ion thu gọn của phản ứng NaOH + HCl → NaCl + H2O Bước 2: Viết phương trình ion thu gọn của các đáp án => Phương trình ion thu gọn trùng Cách viết phương trình ion thu gọn: - Chuyển tất cả các chất vừa dễ tan, vừa điện li mạnh thành ion; các chất khí, kết tủa, điện li yếu để nguyên dưới dạng phân tử thu được phương trình ion đầy đủ. - Lược bỏ những ion không tham gia phản ứng ta được phương trình ion thu gọn. Lời giải chi tiết :
NaOH + HCl → NaCl + H2O có phương trình ion rút gọn là: OH- + H+ → H2O Xét các phương án: + 2KOH + FeCl2 → Fe(OH)2 + 2KCl → PT ion rút gọn: 2OH- + Fe2+ → Fe(OH)2 + NaOH + NaHCO3 → Na2CO3 + H2O → PT ion rút gọn: OH- + HCO3- → CO32- + H2O + NaOH + NH4Cl → NaCl + NH3 + H2O → PT ion rút gọn: OH- + NH4+ → NH3 + H2O + KOH + HNO3 → KNO3 + H2O → PT ion rút gọn: OH- + H+ → H2O => KOH + HNO3 → KNO3 + H2O có cùng phương trình ion rút gọn Chú ý
các chất điện li yếu, các chất không tan, các oxit, các khí khi viết phương trình ion rút gọn để nguyên phân tử.
Câu 17 :
Hòa tan hoàn toàn m gam Al2(SO4)3 vào nước thu được dung dịch A chứa 0,6 mol Al3+
Đáp án : A Phương pháp giải :
Dựa vào phương trình điện ly tính được số mol Al2(SO4) Từ đó tính được \({m_{A{l_2}{{(S{O_4})}_3}}}\) Lời giải chi tiết :
\(A{l_2}{(S{O_4})_3} \to 2{\text{A}}{l^{3 + }} + 3{\text{S}}O_4^{2 - }\) Theo phương trình điện ly: \({n_{A{l_2}{{(S{O_4})}_3}}} = \dfrac{1}{2}.{n_{A{l^{3 + }}}} = 0,3\,\,mol\) \( \to {m_{A{l_2}{{(S{O_4})}_3}}} = 0,3.342 = 102,6\,\,gam\)
Câu 18 :
Tính pH của 300ml dung dịch (gồm 100 ml Ba(OH)2 0,1M và 200 ml NaOH 0,05M)
Đáp án : B Phương pháp giải :
Từ số mol của Ba(OH)2 và NaOH \( \to {n_{O{H^ - }}} = 2{n_{Ba{{(OH)}_2}}} + {n_{NaOH}}\) \( \to {\text{[}}O{H^ - }{\text{] = }}\dfrac{{{n_{O{H^ - }}}}}{{0,3}}\) Mà [OH-].[H+] = 10-14 \( \to [{H^ + }] \to pH\) Lời giải chi tiết :
\({n_{Ba{{(OH)}_2}}} = 0,1.0,1 = 0,01\,\,mol;{n_{NaOH}} = 0,2.0,05 = 0,01\,\,mol\) \( \to {n_{OH - }} = 2{n_{Ba{{(OH)}_2}}} + {n_{NaOH}} = 2.0,01 + 0,01 = 0,03\,\,mol\) \( \to [O{H^ - }] = \dfrac{{0,03}}{{0,3}} = 0,1\,\,M\) Mà [OH-].[H+] = 10-14 \( \to [{H^ + }] = \dfrac{{{{10}^{ - 14}}}}{{0,1}} = {10^{ - 13}}\) \( \to pH = - \log {10^{ - 13}} = 13\)
Câu 19 :
Cho các chất sau: SO2, C6H6 , C2H6, Ca(HCO3)2, H2SO4, NaClO, Mg(OH)2. Số chất hòa tan vào trong nước tạo thành chất điện li là:
Đáp án : B Lời giải chi tiết :
Các chất thỏa mãn: SO2 (tác dụng với nước tạo thành dung dịch axit), Ca(HCO3)2 ; H2SO4 ; NaClO ; Mg(OH)2 (phần hòa tan). Vậy có 5 chất thỏa mãn.
Câu 20 :
Phương trình ion rút gọn của phản ứng cho biết
Đáp án : C Lời giải chi tiết :
Phương trình ion thu gọn cho biết bản chất của phản ứng trong dung dịch các chất điện ly
Câu 21 :
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
Đáp án : B Lời giải chi tiết :
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
Câu 22 :
Trộn 150 ml dung dịch MgCl2 0,5M với 50 ml dung dịch NaCl 1M thì nồng độ ion Cl- trong dung dịch mới là
Đáp án : C Phương pháp giải :
MgCl2 và NaCl là các chất điện li mạnh, khi hòa tan vào nước phân li hoàn toàn thành các ion: MgCl2 → Mg2+ + 2Cl- NaCl → Na+ + Cl- Lời giải chi tiết :
\({n_{MgC{l_2}}} = 0,15 \times 0,5 = 0,075mol\); \({n_{NaCl}} = 0,05 \times 1 = 0,05mol\) MgCl2 và NaCl là các chất điện li mạnh, khi hòa tan vào nước phân li hoàn toàn thành các ion: MgCl2 → Mg2+ + 2Cl- 0,075 → 0,15 (mol) NaCl → Na+ + Cl- 0,05 → 0,05 (mol) => \(n_{{Cl}^-}\) = 0,15 + 0,05 = 0,2 mol \[{\text{[}}C{l^ - }{\text{]}} = \dfrac{n}{V} = \frac{{0,2}}{{0,15 + 0,05}} = 1M\]
Câu 23 :
Đối với dung dịch axit mạnh HNO3 0,1M nếu bỏ qua sự điện li của nước thì đánh giá nào sau đây là đúng?
Đáp án : A Phương pháp giải :
Axit mạnh khi tan vào nước điện li hoàn toàn thành các ion. Lời giải chi tiết :
HNO3 khi tan vào nước điện li hoàn toàn thành các ion: HNO3 → H+ + NO3- 0,1M 0,1M 0,1M => [H+] = [NO3-] = 0,1M
Câu 24 :
Thể tích (ml) của dung dịch NaOH 0,3M cần để trung hòa 3 lít dung dịch HCl 0,01M là
Đáp án : D Phương pháp giải :
Tính theo PTHH: NaOH + HCl → NaCl + H2O Lời giải chi tiết :
nHCl = 3.0,01 = 0,03 mol PTHH: NaOH + HCl → NaCl + H2O nNaOH = nHCl = 0,03 mol => V dd NaOH = n : CM = 0,03 : 0,3 = 0,1 lít = 100 ml
Câu 25 :
Cặp chất nào sau đây tác dụng với nhau tạo ra sản phẩm đều là chất khí?
Đáp án : D Lời giải chi tiết :
Ta có: C + H2O → CO + H2 hoặc C + 2H2O → CO2 + 2H2 => Sản phẩm đều là chất khí
Câu 26 :
Chất nào sau đây khi tan trong nước không phân li ra ion?
Đáp án : D Lời giải chi tiết :
C2H5OH khi tan trong nước không phân li ra ion.
Câu 27 :
Dung dịch Y chứa 0,02 mol Mg2+; 0,03 mol Na+; 0,03 mol Cl- và y mol SO42-. Giá trị của y là
Đáp án : D Phương pháp giải :
Bảo toàn điện tích. Lời giải chi tiết :
Áp dụng định luật bảo toàn điện tích ta có: 2nMg2+ + nNa+ = nCl- + 2nSO42- => 0,02.2 + 0,03.1 = 0,03.1 + 2y => y = 0,02
Câu 28 :
Chất nào sau đây không dẫn điện được?
Đáp án : C Lời giải chi tiết :
Chất dẫn điện là các chất điện li được trong nước
Câu 29 :
Dung dịch X có chứa a mol Na+, b mol Mg2+, c mol Cl- và d mol SO42-. Biểu thức nào sau đây đúng:
Đáp án : B Phương pháp giải :
Áp dụng định luật bảo toàn điện tích: ∑n(+) = ∑n(-) Lời giải chi tiết :
Áp dụng định luật bảo toàn điện tích cho dung dịch X ta có:
=> a + 2b = c + 2d
Câu 30 :
Dung dịch A chứa Mg2+, Ca2+, 0,2 mol Cl-, 0,3 mol \(NO_3^ - \). Thêm dần dung dịch Na2CO3 1M vào dung dịch A cho đến khi thu được lượng kết tủa lớn nhất thì dừng lại. Thể tích dung dịch Na2CO3 đã thêm vào dung dịch là
Đáp án : B Phương pháp giải :
Vì cả 2 ion Mg2+ và Ca2+ đều tạo kết tủa với \(CO_3^{2 - }\) nên đến khi được kết tủa lớn nhất thì dung dịch chỉ chứa Na+, Cl- và \(NO_3^ - \) Áp dụng định luật bảo toàn điện tích: \({n_{N{a^ + }}} = {n_{C{l^ - }}} + {n_{NO_3^ - }}\) Lời giải chi tiết :
Vì cả 2 ion Mg2+ và Ca2+ đều tạo kết tủa với \(CO_3^{2 - }\) nên đến khi được kết tủa lớn nhất thì dung dịch chỉ chứa Na+, Cl- và \(NO_3^ - \) Gọi số mol Na2CO3 là x mol \( \to {n_{N{a^ + }}} = 2{\rm{x}}\,\,mol\) Áp dụng định luật bảo toàn điện tích ta có \({n_ + } = {n_ - } \to 2{\rm{x}}.1 = 0,2.1 + 0,3.1 \to x = 0,25\) \( \to {V_{N{a_2}C{O_3}}} = \dfrac{{0,25}}{1} = 0,25\) lít = 250 ml |














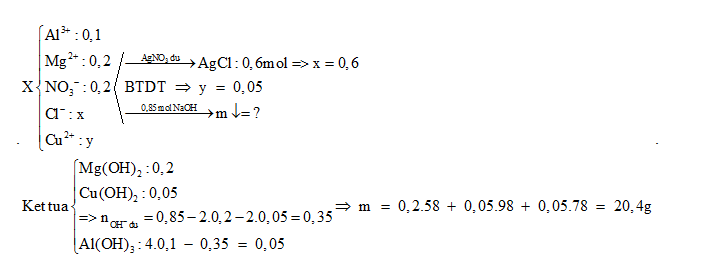





Danh sách bình luận