Bài 3 trang 9 SGK Hóa học 9200ml dung dịch HCl Quảng cáo
Đề bài 200ml dung dịch HCl có nồng độ 3,5M hòa tan vừa hết 20 g hỗn hợp hai oxit CuO và Fe2O3 a) Viết các phương trình hóa học b) Tính khối lượng của mỗi oxit có trong hỗn hợp ban đầu. Video hướng dẫn giải Phương pháp giải - Xem chi tiết Đổi số mol của HCl Gọi số mol của CuO và lần lượt là x, y (mol) PTHH: CuO + 2HCl → CuCl2 + H2O Phản ứng x → 2x x (mol) Fe2O3 + 6HCl → 2FeCl3 + 3H2O Phản ứng: y → 6y 2y (mol) Giải hệ 2 ẩn 2 phương trình \(\left\{ \begin{gathered} Lời giải chi tiết Số mol HCl = 3,5 . 0,2 = 0,7 mol Gọi x, y là số mol của CuO và Fe2O3
Từ phương trình phản ứng trên ta có nHCl(1) = 2nCuO = 2x mol \({n_{HCl(2)}} = 6{n_{F{{\rm{e}}_2}{O_3}}} = 6y\,\,mol\) \( \to {n_{HCl}} = 2{\rm{x}} + 6y = 0,7\,\,mol(*)\) \({m_{CuO}} = (64 + 16)x = 80{\rm{x}}\,\,{\rm{gam}}\) \({m_{F{{\rm{e}}_2}{O_3}}} = (56.2 + 16.3)y = 160y\,\,gam\) Theo bài: mhỗn hợp = \({m_{CuO}} + {m_{F{{\rm{e}}_2}{O_3}}} = 80{\rm{x}} + 160y = 20g\)(**) Từ (*) và (**) ta có hệ phương trình: \(\left\{ \begin{gathered} Vậy \({n_{CuO}} = 0,05\,mol\) và \({n_{F{e_2}{O_3}}} = 0,1\,mol\) b) \({m_{CuO}}= 0,05 . 80 = 4\, g\) \({m_{F{e_2}{O_3}}}= 20 - 4 = 16\, g\) Loigiaihay.com
|














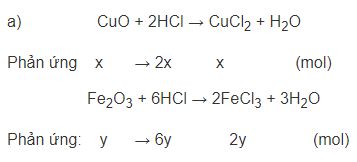






Danh sách bình luận