Lý thuyết bài 19: Tốc độ phản ứngTốc độ phản ứng hóa học, tốc độ trung bình, biểu thức tốc độ phản ứng theo hằng số tốc độ phản ứng và nồng độ, hệ số nhiệt độ Van't Hoff Quảng cáo
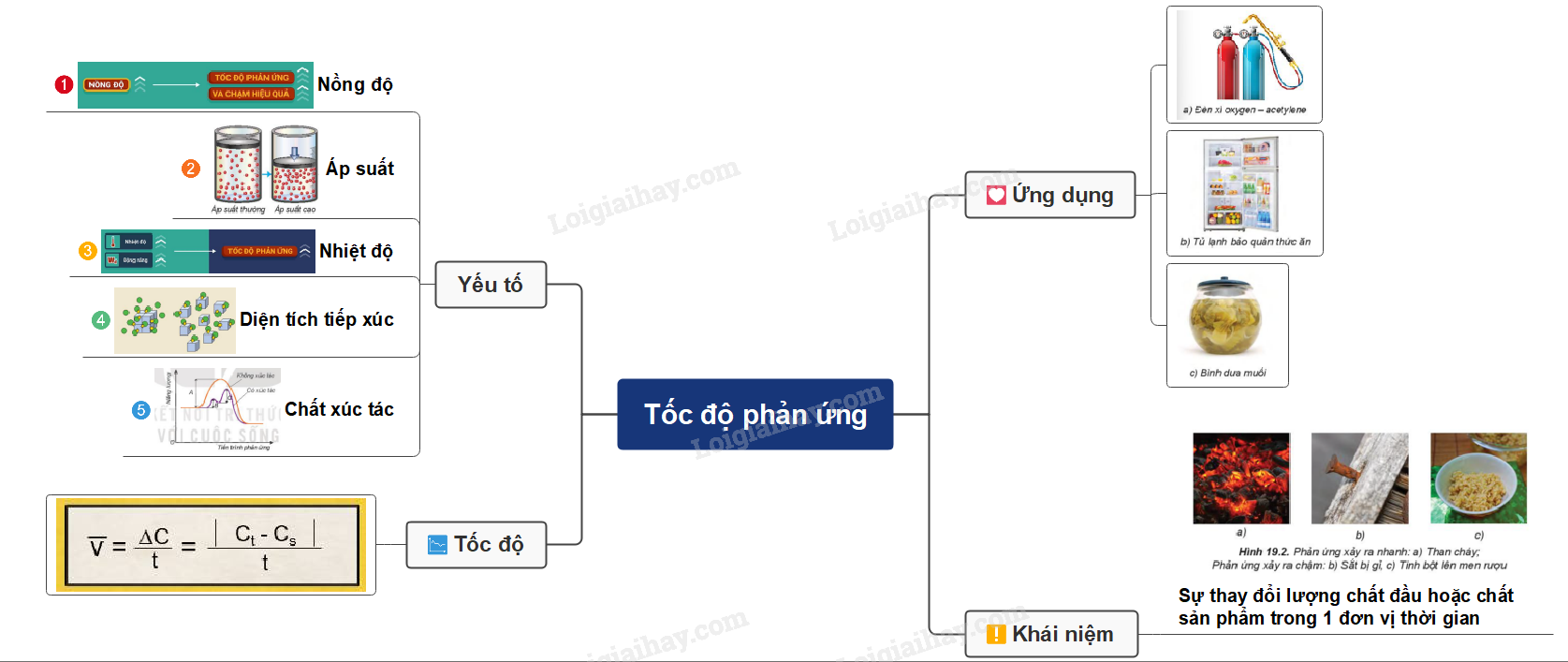
Lý thuyết: Tốc độ phản ứng I. Tốc độ phản ứng hóa học 1. Khái niệm tốc độ phản ứng hóa học - Tốc độ phản ứng được xác định bằng sự thay đổi lượng chất đầu hoặc chất sản phẩm trong một đơn vị thời gian: giây (s), phút (min), giờ (h), ngày (d),… Lượng chất có thể được biểu diễn bằng số mol, nồng độ mol, khối lượng, hoặc thể tích - Các tốc độ phản ứng xảy ra với tốc độ khác nhau
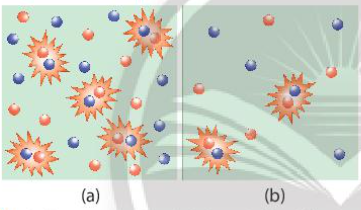
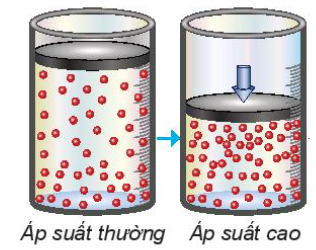
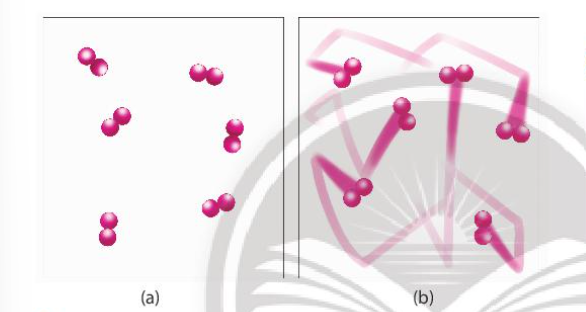
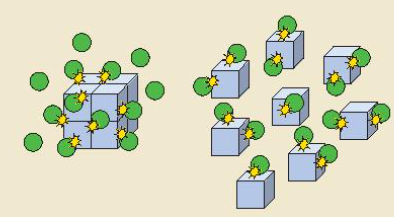
- Đa số các phản ứng hóa học có tốc độ giảm dần theo thời gian. Để đặc trưng cho sự nhanh chậm của phản ứng trong một khoảng thời gian, ta dùng tốc độ phản ứng trung bình. - Xét phản ứng tổng quát: aA + bB → cC + dD Gọi ∆CA, ∆CB, ∆CC, ∆CD lần lượt là biến thiên lượng chất các chất A, B, C, D trong khoảng thời gian ∆t. Tốc độ trung bình của phản ứng được tính theo công thức II. Các yếu tố ảnh hưởng đến tốc độ phản ứng 1. Ảnh hưởng của nồng độ đến tốc độ phản ứng - Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ thuận với tích số nồng độ các chất phản ứng với số mũ thích hợp. Đối với phản ứng đơn giản (phản ứng chỉ xảy ra qua một giai đoạn), số mũ là hệ số của chất tham gia trong phương trình hóa học Ví dụ: 2NO + O2 → 2NO2 => v = k.CNO2.CO2 Trong đó: CNO và CO2 là nồng độ mol của NO và O2 tại thời điểm đang xét k là hằng số tốc độ phản ứng (chỉ phụ thuộc vào nhiệt độ) v là tốc độ phản ứng tại thời điểm đang xét - Giải thích: trong quá trình phản ứng, các hạt (phân tử, nguyên tử hoặc ion) luôn chuyển động không ngừng và va chạm với nhau. Những va chạm có năng lượng đủ lớn phá vỡ liên kết cũ và hình thành liên kết mới dẫn tới phản ứng hóa học 2. Ảnh hưởng của áp suất đến tốc độ phản ứng - Việc tăng áp suất hỗn hợp khí cũng tương tự như tăng nồng độ, sẽ làm tốc độ phản ứng tăng - Việc thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng không có chất khí tham gia 3. Ảnh hưởng của nhiệt độ đến tốc độ phản ứng - Khi tăng nhiệt độ, tốc độ phản ứng tăng - Giải thích: Ở nhiệt độ thường, các chất phản ứng chuyển động với tốc độ nhỏ, khi tăng nhiệt độ, các chất sẽ chuyển động với tốc độ lớn hơn, dẫn đến tăng số va chạm hiệu quả nên tốc độ phản ứng tăng - Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hóa học: \(\frac{{{v_2}}}{{{v_1}}} = {\gamma ^{\frac{{{T_2} - {T_1}}}{{10}}}}\) Trong đó: v1, v2 là tốc độ phản ứng ở 2 nhiệt độ t1 và t2, γ là hệ số nhiệt độ Van’t Hoff 4. Ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng - Khi tăng diện tích bề mặt tiếp xúc, số va chạm giữa các chất đầu tăng lên, số va chạm hiệu quả cũng tăng theo, dẫn đến tốc độ phản ứng tăng
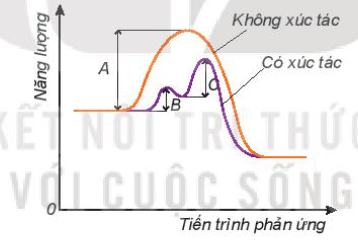
5. Ảnh hưởng của chất xúc tác đến tốc độ phản ứng - Với một số phản ứng hóa học, để tăng tốc độ phản ứng, người ta sử dụng chất xúc tác, được ghi trên mũi tên trong phương trình hóa học III. Một số ứng dụng của việc thay đổi tốc độ phản ứng - Trong đời sống và trong sản xuất, con người áp dụng nhiều biện pháp kĩ thuật để thay đổi tốc độ phản ứng như thay đổi nồng độ, nhiệt độ, chất xúc tác… Ví dụ:
Sơ đồ tư duy |
















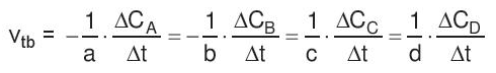







Danh sách bình luận