Bài 18. Ôn tập chương 5 trang 89, 90 Hóa 10 Kết nối tri thứcPhản ứng chuyển hóa giữa hai dạng đơn chất của phosphorus (P): Cho biết biến thiên enthalpy của phản ứng sau ở điều kiện tiêu chuẩn: Dung dịch glucose (C6H12O6) 5% có khối lượng riêng là 1,02 g/mL, phản ứng oxi hóa 1 mol glucose tạo thành CO2(g) và H2O (l) tỏa ra nhiệt lượng là 2803,0 kJ. Một người bệnh được truyền một chai chứa 500 ml dung dịch glucose 5%. Năng lượng tối đa từ phản ứng oxi hóa thành glucose mà bênh nhân đó có thể nhận được là: Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Bài tập 1
Phương pháp giải: Chất phản ứng → Sản phẩm \({\Delta _r}H_{298}^o\) > 0 ( phản ứng thu nhiệt) \({\Delta _r}H_{298}^o\) < 0 ( phản ứng tỏa nhiệt) - Biến thiên enthalpy của phản ứng được xác định bằng hiệu số giữa tổng nhiệt tạo thành các chất sản phẩm (sp) và tổng nhiệt tạo thành của các chất đầu (cđ). Lời giải chi tiết: \({\Delta _r}H_{298}^o\) = 17,6 kJ > 0 => P đỏ bền hơn P trắng => Đáp án: A Bài tập 2
Phương pháp giải: Nhiệt tạo thành của một chất là biến thiên enthalpy của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền vững nhất, ở một điều kiện xác định. Lời giải chi tiết: \({\Delta _r}H_{298}^o\) = \({\Delta _r}H_{298}^o\) (CO2(g)) - \({\Delta _r}H_{298}^o\) (CO(g)) -283,0 = - 393,5 - \({\Delta _r}H_{298}^o\) (CO(g)) => \({\Delta _r}H_{298}^o\) (CO(g)) = -393,5 + 283 = -110,5 kJ/mol => Đáp án A Bài tập 3
Phương pháp giải: Cứ 1 mol glucose được đốt cháy sẽ tỏa ra lượng nhiệt là 2803,0 kJ. Lời giải chi tiết:
Bài tập 4
Phương pháp giải:
Lời giải chi tiết:
Bài tập 5
Phương pháp giải:
Lời giải chi tiết: Gọi nhiệt tạo thành chuẩn của khí methane là x -> -890,3 = 2.(-285,8) -393,5 - x - 2.0 -> x = – 74,8 kJ/mol
Bài tập 6
Phương pháp giải: Giá trị tuyệt đối của biến thiên enthalpy càng lớn thì nhiệt lượng tỏa ra hay thu vào của phản ứng càng nhiều Lời giải chi tiết:
Bài tập 7
Phương pháp giải:
Lời giải chi tiết:
Bài tập 8
Phương pháp giải: Cứ 1 mol khí propane đốt cháy tỏa 2220 kJ Cứ 1 mol khí butane đốt cháy tỏa 2874 kJ Lời giải chi tiết: Gọi số mol của propane và butane lần lượt là x và y 2x – y = 0 44x + 58y = 12000 => x = 75 mol và y = 150 mol 75 mol khí propane đốt cháy tỏa 75 . 2220 = 166500 kJ 150 mol khí butane đốt cháy tỏa 150 . 2874 = 431100 kJ Tổng lượng nhiệt bình gas 12 kg có thê cung cấp là 166500 + 431100 = 597600 kJ Một ngày, bình gas cần cung cấp lượng nhiệt thực tế là 10000 : 0,8 = 12500 kJ Số ngày để hộ gia đình sử dụng hết bình gas 12 kg là: 597600 : 12500 = 48 ngày
|














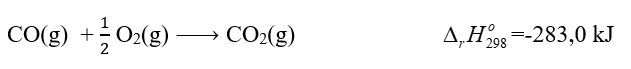


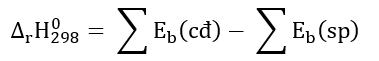
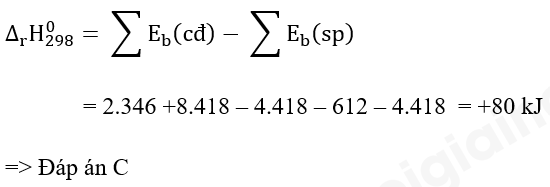
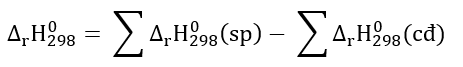
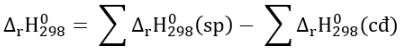
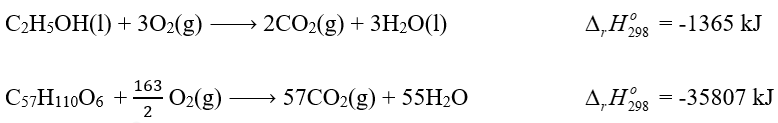

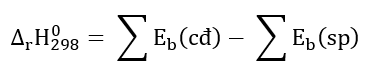

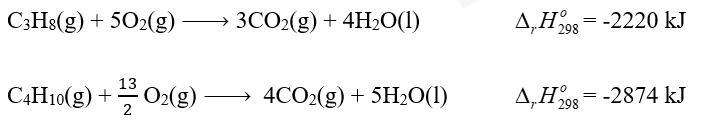






Danh sách bình luận