Bài 21. Nhóm halogen trang 104, 105, 106, 107, 108, 109, 110, 111 Hóa 10 Kết nối tri thứcTrong tự nhiên, một số phi kim như carbon, nitrogen, oxygen tồn tại ở cả dạng đơn chất và hợp chất, còn các halogen đều chỉ tồn tại ở dạng hợp chất. Vì sao có sự khác biệt này? Kể tên một số hợp chất phổ biến của halogen trong tự nhiên Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 104 MĐ
Phương pháp giải: Do nguyên tử của các nguyên tố này hoạt động hóa học rất mạnh Lời giải chi tiết: - Các nguyên tố halogen chỉ tồn tại ở dạng hợp chất trong tự nhiên do nguyên tử của các nguyên tố này hoạt động hóa học rất mạnh - Halogen có ái lực electron lớn. Nguyên tử halogen X với 7 electron lớp ngoài cùng => Dễ dàng nhận thêm 1 electron để tạo thành ion âm X- có cấu hình electron của khí hiếm => Các halogen mau chóng tạo liên kết với các nguyên tử nguyên tố khác CH tr 105 CH
Phương pháp giải: Trong tự nhiên, halogen thường tồn tại ở dạng muối Lời giải chi tiết: - Clo: NaCl có trong nước biển và đại dương, KCl có trong khoáng vật như KCl.MgCl2.6H2O và NaCl.KCl - Flo: Phần lớn có trong 2 loại khoáng vật là florit (CaF2) và criolit (Na3AlF6 hay AlF3.3NaF) - Brom: KBr, NaBr, MgBr2 - Iot: tồn tại dưới dạng muối iotua như NaI, KI, trong tuyến giáp iot tồn tại dưới dạng hợp chất hữu cơ như tetraiodothyronine hoặc triiodothyronine CH tr 105 HĐ
Phương pháp giải:
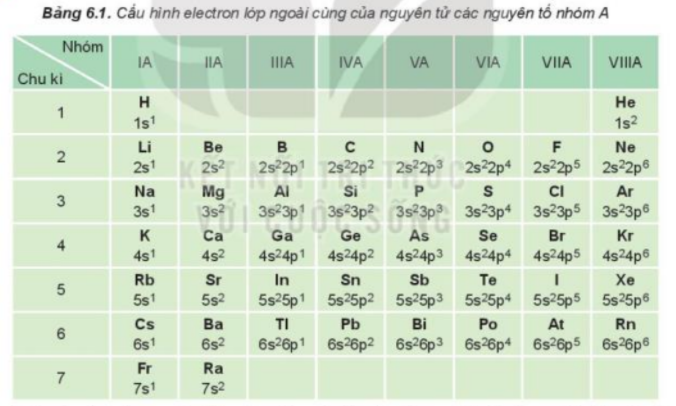
a) Có 7 electron ở lớp electron ngoài cùng b) - Bán kính nguyên tử được xác định bằng nửa khoảng cách trung bình giữa 2 hạt nhân nguyên tửu gần nhau nhất trong chất rắn đơn chất hoặc trong phân tử 2 nguyên tử giống nhau - Độ âm điện là đại lượng đặc trưng cho khả năng hút electron của nguyên tử - Tính oxi hóa là khả năng nhận thêm electron c) Fluorine có độ âm điện lớn nhất Lời giải chi tiết:
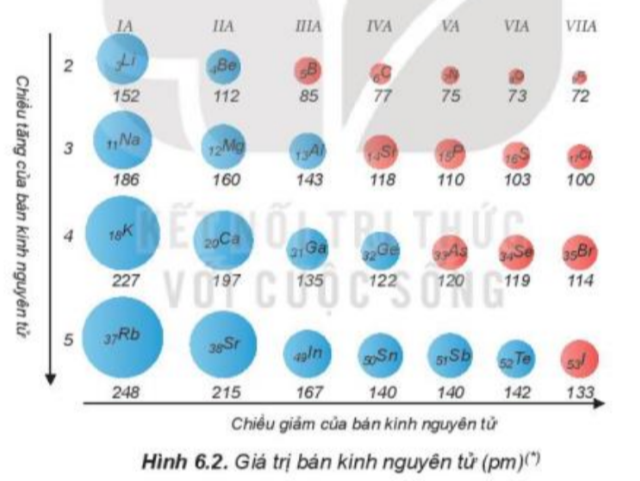
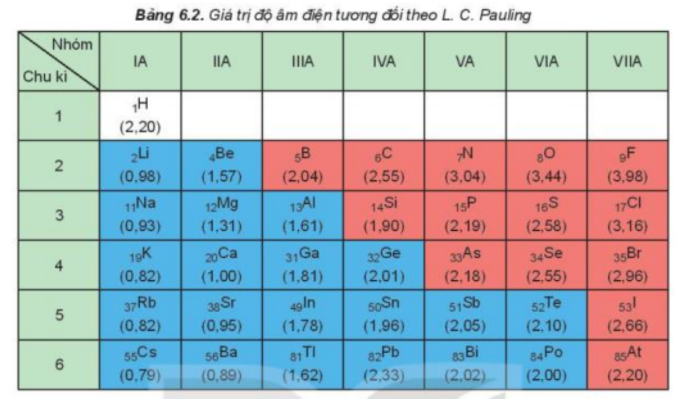
a) - Nguyên tử halogen có 7 electron ở lớp ngoài cùng, dễ nhận thêm 1 electron để đạt được cấu hình electron bền cùng khí hiếm gần nhất. + Khi nguyên tử halogen liên kết với kim loại => Khi đó kim loại sẽ nhường electron và nguyên tử halogen sẽ nhận 1 electron để trở thành ion mang điện tích âm + Khi nguyên tử halogen liên kết với phi kim => 2 phi kim kết hợp với nhau tạo thành phân tử, chúng sẽ góp electron để tạo thành các cặp electron dùng chung => Halogen sẽ góp chung 1 electron để đạt cấu hình electron bền vững b) - Bán kính nguyên tử: Đi từ trên xuống dưới, số lớp electron tăng => Lực hút giữa hạt nhân và lớp electron ngoài cùng giảm dần => Bán kính tăng dần - Độ âm điện: Đi từ trên xuống dưới, số lớp electron tăng => Lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm nên độ âm điện giảm - Từ F đến I, độ âm điện giảm dần => Khả năng hút (nhận) electron giảm dần => Tính oxi hóa giảm dần c) - Nguyên tử fluorine có 7 electron ở lớp ngoài cùng và có độ âm điện lớn nhất => Khi tham gia liên kết hóa học, fluorine chỉ nhận 1 electron từ các nguyên tử khác => Fluorine chỉ có số oxi hóa -1 trong các hợp chất CH tr 105 HĐ
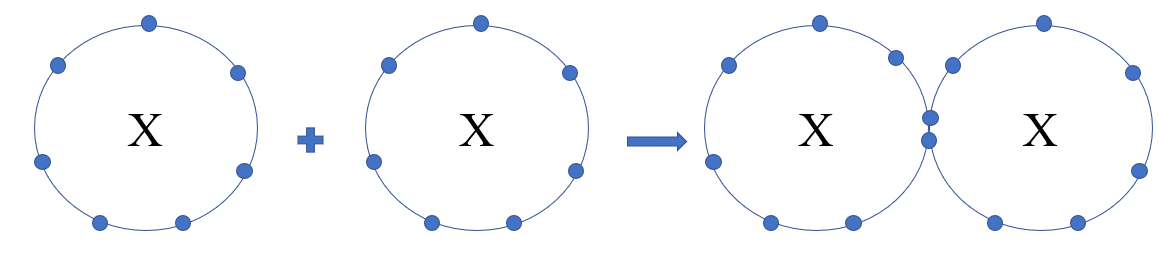
Phương pháp giải: a) Trong phân tử halogen mỗi nguyên tử halogen sẽ góp 1 electron để tạo thành 1 đôi electron dùng chung b) Phân tử halogen được hình thành nhờ sự góp chung electron của mỗi nguyên tử halogen c) Đi từ trên xuống dưới, bán kính nguyên tử tăng dần, độ âm điện giảm dần => Độ dài liên kết Lời giải chi tiết: a) Khi 2 nguyên tử halogen liên kết với nhau, mỗi nguyên tử sẽ góp 1 electron tạo thành 1 cặp electron dùng chung
b) - Trong phân tử halogen, liên kết hình thành giữa 2 nguyên tử giống nhau => Hiệu độ âm điện = 0, cặp electron dùng chung không bị hút lệch về phía nguyên tử nào => Liên kết cộng hóa trị không phân cực c) - Độ dài liên kết là khoảng cách giữa 2 hạt nhân của 2 nguyên tử - Đi từ F đến I, bán kính nguyên tử tăng dần => Khoảng cách giữa 2 hạt nhân tăng dần => Độ dài liên kết trong dãy các phân tử halogen tăng dần CH tr 106 HĐ
Phương pháp giải: - Trong đơn chất, số oxi hóa của nguyên tử bằng 0 - Trong phân tử các hợp chất, thông thường số oxi hóa của H là +1, của O là -2, các kim loại điển hình có số oxi hóa dương bằng số electron hóa trị - Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử = 0 - Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion, trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử = điện tích ion Lời giải chi tiết: Trong phân tử các hợp chất, thông thường số oxi hóa của H là +1, của O là -2. Gọi số oxi hóa của Cl là x - Cl2 (đơn chất): Số oxi hóa của Cl là 0 - HCl: (+1) + x = 0 => x = -1 => Cl trong HCl có số oxi hóa là -1 - HClO: (+1) + x + (-2) = 0 => x = +1 => Cl trong HClO có số oxi hóa là +1 - HClO2: (+1) + x + 2.(-2) = 0 => x = +3 => Cl trong HCl O2 có số oxi hóa là +3 - HClO3: (+1) + x + 3.(-2) = 0 => x = +5 => Cl trong HClO3 có số oxi hóa là +5 - HClO4: (+1) + x + 4.(-2) = 0 => x = +7 => Cl trong HClO4 có số oxi hóa là +7 CH tr 106 HĐ
Phương pháp giải: - Ở trạng thái đơn chất: Cl có số oxi hóa = 0 - Ở trạng thái hợp chất: Cl có số oxi hóa = -1, +1, +3, +5, +7 Lời giải chi tiết: - Ở trạng thái đơn chất (Cl2): Cl có số oxi hóa = 0 - Ở trạng thái hợp chất: Cl có số oxi hóa = -1, +1, +3, +5, +7 => Cl2 vừa có khả năng nhận electron (tính oxi hóa)để tạo thành Cl-1, vừa có khả năng nhường electron (tính khử) để tạo thành Cl+1, Cl+3, Cl+5, Cl+7 CH tr 107 CH
Phương pháp giải: Tham khảo trên sách, báo, tivi, internet Lời giải chi tiết: - Clo: NaCl có trong nước biển và đại dương, KCl có trong khoáng vật như KCl.MgCl2.6H2O và NaCl.KCl - Flo: Phần lớn có trong 2 loại khoáng vật là florit (CaF2) và criolit (Na3AlF6 hay AlF3.3NaF) - Brom: KBr, NaBr, MgBr2 - Iot: tồn tại dưới dạng muối iotua như NaI, KI, trong tuyến giáp iot tồn tại dưới dạng hợp chất hữu cơ như tetraiodothyronine hoặc triiodothyronine CH tr 106 CH
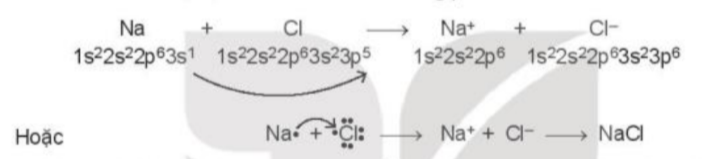
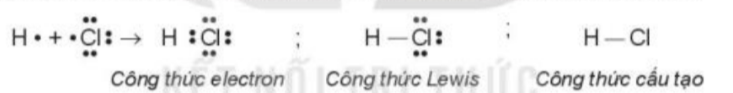
Phương pháp giải: - NaCl: liên kết ion - HCl: Liên kết cộng hóa trị Lời giải chi tiết: - Sự hình thành liên kết trong phân tử NaCl: Nguyên tử chlorine đã nhận 1 electron của nguyên tử sodium để tạo thành Na+ và Cl- - Sự hình thành liên kết trong phân tử HCl: Mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl CH tr 107 CH
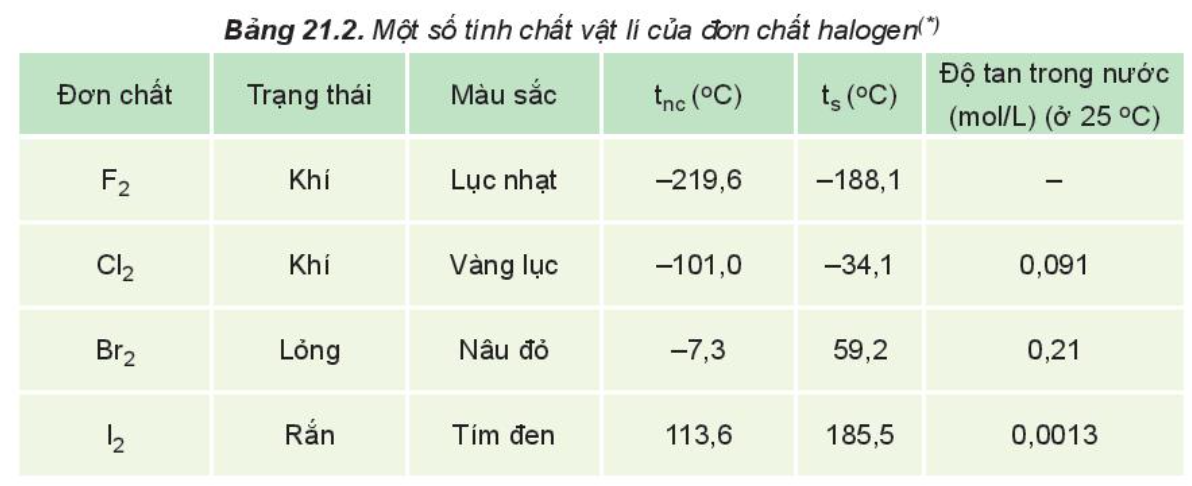
Phương pháp giải: - Tương tác van der Waals - Khối lượng phân tử Lời giải chi tiết: - Nhiệt độ nóng chảy, nhiệt độ sôi tăng từ F2 đến I2 do: + Tương tác van der Waals giữa các phân tử tăng + Khối lượng phân tử tăng CH tr 108 CH
Phương pháp giải: Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron Lời giải chi tiết: \(2N{a^0} + Cl_2^0\xrightarrow{{{t^o}}}2\mathop {Na}\limits^{ + 1} \mathop {Cl}\limits^{ - 1} \) - Na0 nhường electron thành Na+1 => Na là chất khử - Cl0 nhận electron thành Cl-1 => Cl2 là chất oxi hóa \(2F{e^0} + 3Cl_2^0\xrightarrow{{{t^o}}}2\mathop {Fe}\limits^{ + 3} {\mathop {Cl}\limits^{ - 1} _3}\) - Fe0 nhường electron thành Fe+3 => Fe là chất khử - Cl0 nhận electron thành Cl-1 => Cl2 là chất oxi hóa CH tr 108 HĐ
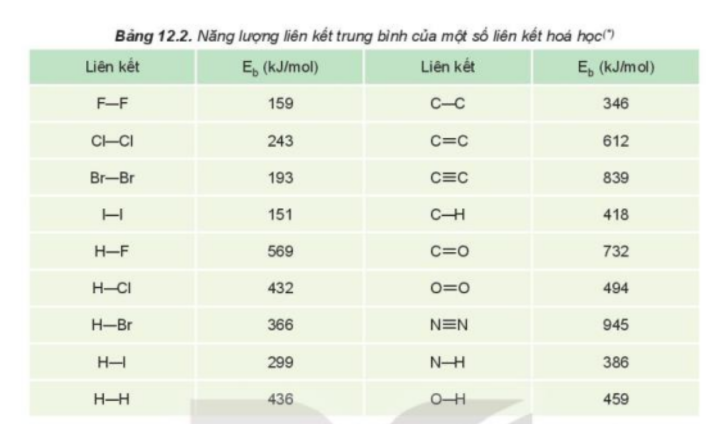
Phương pháp giải: 1. Tính oxi hóa giảm dần 2. Từ F đến I, năng lượng liên kết của halogen với hydrogen giảm dần Lời giải chi tiết: 1. - Từ F2 đến I2, tính oxi hóa của các halogen giảm dần => Khả năng hoạt động của các đơn chất halogen giảm dần => Xu hướng phản ứng với hydrogen giảm dần 2. - Dựa vào Bảng 12.2 ta nhận thấy: Từ F đến I, năng lượng liên kết của halogen với hydrogen giảm dần => Khả năng halogen liên kết với hydrogen giảm dần => Xu hướng phản ứng của các đơn chất halogen với hydrogen giảm dần từ F2 đến I2 CH tr 109 CH
Phương pháp giải: Bước 1: Đổi 80 000 m3 = 8.107 dm3 = 8.107 L Bước 2: 5 mg Cl2 để khử trùng 1 L nước x mg Cl2 để khử trùng 8.107 L nước Lời giải chi tiết: Đổi 80 000 m3 = 8.107 dm3 = 8.107 L 5 mg Cl2 để khử trùng 1 L nước x mg Cl2 để khử trùng 8.107 L nước => x = 5 x 8.107 = 4.108 (mg) = 400 kg Vậy cần 400 kg Cl2 để khử trùng 80 000 m3 nước sinh hoạt CH tr 109 HĐ
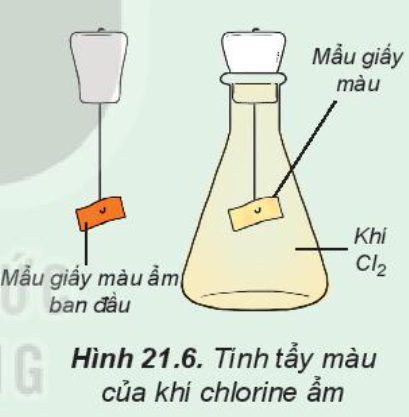
Phương pháp giải: 1. Mẩu giấy màu bị nhạt dần 2. Cl2 vừa là chất oxi hóa vừa là chất khử Lời giải chi tiết: 1. - Trước khi cho vào bình khí chlorine, mẩu giấy màu vẫn giữ nguyên màu ban đầu - Sau khi cho vào bình khí chlorine, mẩu giấy màu bị nhạt màu dần - Giải thích: + Khi cho mẩu giấy ẩm vào bình chlorine, Cl2 đã tác dụng với H2O tạo thành HCl và HClO $C{l_2} + {H_2}O \rightleftarrows HCl + HClO$ + HClO có tính oxi hóa mạnh nên Cl2 trong H2O có khả năng tẩy màu, diệt khuẩn 2. - Xét số oxi hóa của Cltrong phản ứng: $Cl_2^0 + {H_2}O \rightleftarrows HC{l^{ - 1}} + H\mathop {Cl}\limits^{ + 1} O$ - Nhận xét: Trong phản ứng, Cl2 vừa là chất oxi hóa vừa là chất khử vì + Cl0 nhận thêm electron để thành Cl-1 => Chất oxi hóa + Cl0 nhường đi electron để thành Cl+1 => Chất khử => Trong phản ứng này, chlorine tự oxi hóa – tự khử CH tr 110 CH
Phương pháp giải: - Phương pháp thăng bằng electron: Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử các nguyên tố ở 2 vế Lời giải chi tiết: - Xác định nguyên tử có sự thay đổi số oxi hóa \(Cl_2^0 + NaOH \to Na\mathop {Cl}\limits^{ - 1} + Na\mathop {Cl}\limits^{ + 1} O + {H_2}O\)
- Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ, tính ra hệ số của các chất khác Cl2 + 2NaOH → NaCl + NaClO + H2O CH tr 110 HĐ
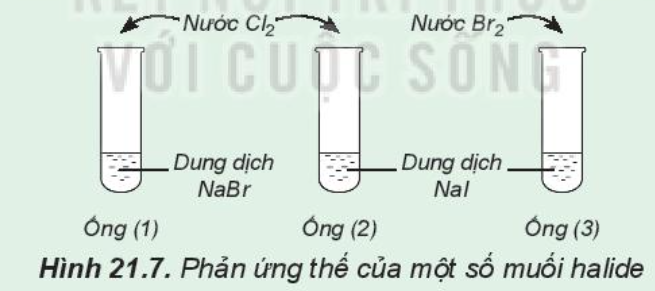
Phương pháp giải: 1. Quan sát hiện tượng thí nghiệm: màu sắc của dung dịch trước và sau phản ứng 2. Tính oxi hóa của Cl2 > Br2 > I2 3. Sử dụng hồ tinh bột để nhận biết I2 Lời giải chi tiết: 1. - Khi cho nước Cl2 vào dung dịch NaBr: dung dịch chuyển từ không màu thành màu vàng - Khí cho nước Cl2 vào dung dịch NaI: dung dịch chuyển từ không màu thành màu vàng nâu - Khi cho nước Br2 (màu vàng) vào dung dịch NaI: dung dịch chuyển từ không màu thành màu vàng nâu 2. - Cl2 có thể oxi hóa ion Br- trong dung dịch NaBr thành Br2: Cl2 + NaBr → NaCl + Br2 => Cl2 có tính oxi hóa mạnh hơn Br2 - Cl2 có thể oxi hóa ion I- trong dung dịch NaI thành I2: Cl2 + NaI → NaCl + I2 => Cl2 có tính oxi hóa mạnh hơn I2 - Br2 có thể oxi hóa ion I- trong dung dịch NaI thành I2: Br2 + NaI → NaBr + I2 => Br2 có tính oxi hóa mạnh hơn I2 => Tính oxi hóa của Cl2 > Br2 > I2 3. - Sử dụng thuốc thử là hồ tinh bột để chứng tỏ có sự tạo thành I2 => Hiện tượng quan sát được: dung dịch màu vàng chuyển sang màu xanh tím CH tr 110 CH
Phương pháp giải: - Cl2 tác dụng với NaBr, NaI - Br2 tác dụng với NaI Lời giải chi tiết: Cl2 + NaBr → NaCl + Br2 => Cl2 có tính oxi hóa mạnh hơn Br2 Cl2 + NaI → NaCl + I2 => Cl2 có tính oxi hóa mạnh hơn I2 Br2 + NaI → NaBr + I2 => Br2 có tính oxi hóa mạnh hơn I2 => Tính oxi hóa giảm dần trong dãy Cl2, Br2, I2 CH tr 111 CH
Phương pháp giải: Cl2 tác dụng với NaOH Lời giải chi tiết: - Trong công nghiệp người ta điều chế Cl2 bằng cách điện phân dung dịch NaCl có màng ngăn - Mục đích của màng ngăn là để tránh Cl2 tiếp xúc phản ứng với dung dịch NaOH tạo nước Gia – ven: Cl2 + 2NaOH → NaCl + NaClO + H2O
|





















Danh sách bình luận