Bài 3. Cấu trúc lớp vỏ electron nguyên tử trang 21, 22, 23, 24, 25 Hóa 10 Kết nối tri thứcTrong nguyên tử các electron chuyển động như thế nào? 1. Mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử như thế nào? 2. Orbital s có dạng 3. Quan sát Hình 3.3 và nêu sự định hướng của các AO p trong không gian Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 21 MĐ
Phương pháp giải: - Electron chuyển động rất nhanh, không theo quỹ đạo xác định - Electron sắp xếp thành từng lớp và phân lớp theo năng lượng từ thấp đến cao Lời giải chi tiết: - Trong nguyên tử, electron luôn chuyển động rất nhanh quanh hạt nhân, không theo quỹ đạo xác định và sắp xếp thành từng lớp, mỗi lớp có một số electron nhất định - Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao (nguyên lí vững bền) - Trong cùng 1 phân lớp, các electron sẽ phân bổ trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau (quy tắc Hund) CH tr 22 CH
Phương pháp giải: Electron chuyển động rất nhanh, không theo quỹ đạo xác định Lời giải chi tiết: Theo mô hình hiện đại, trong nguyên tử, electron chuyển động rất nhanh, không theo quỹ đạo xác định. Người ta có thể xác định được vùng không gian xung quanh hạt nhân mà ở đó xác suất có mặt electron là lớn nhất (khoảng 90%) CH tr 22 CH
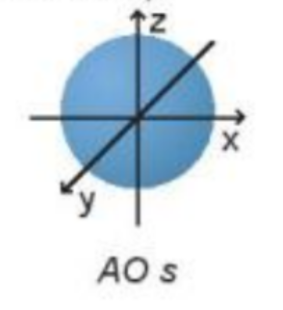
Phương pháp giải: Các orbital s có dạng hình cầu và orbital p có dạng hình số 8 nổi Lời giải chi tiết: Các orbital s có dạng hình cầu
Đáp án C CH tr 22 CH
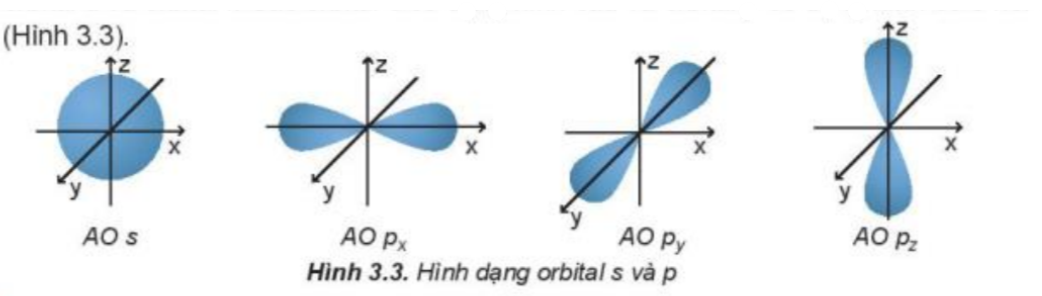
Phương pháp giải: Các orbital p trong không gian vuông góc với nhau, nằm trên trục x, y, z của hệ tọa độ Đề các Lời giải chi tiết: - Orbital p gồm 3 orbital px, py, pz có dạng hình số 8 nổi. - Mỗi orbital só sự định hướng khác nhau trong không gian, chẳng hạn như: + Orbital px định hướng theo trục x + Orbital py định hướng theo trục y + Orbital pz định hướng theo trục z CH tr 23 CH
Phương pháp giải: a) Phân lớp p có 3 orbital b) Phân lớp d có 5 orbital => Mỗi orbital chứa tối đa 2 electron Lời giải chi tiết: a) Phân lớp p có 3 AO px, py, pz. Trong đó mỗi AO chứa tối đa 2 electron => Số electron tối đa chứ trong phân lớp p = 3 x 2 = 6 electron b) Phân lớp d có 5 AO. Trong đó mỗi AO chứa tối đa 2 electron => Số electron tối đa chứ trong phân lớp d = 5 x 2 = 10 electron CH tr 23 CH
Phương pháp giải: - Lớp thứ 2 (lớp L) có 2 phân lớp, được kí hiệu là 2s, 2p - Lớp thứ 3 (lớp M) có 3 phân lớp, được kí hiệu là 3s, 3p và 3d - Phân lớp s có 1 AO, phân lớp p có 3 AO, phân lớp d có 5 AO Lời giải chi tiết: - Lớp thứ 2 (lớp L) có 2 phân lớp, được kí hiệu là 2s, 2p - Mà phân lớp s có 1 AO, phân lớp p có 3 AO. Mỗi AO chứa tối đa 2 electron => Tổng số electron tối đa có trong lớp L = 1x2 + 3x2 = 8 electron - Lớp thứ 3 (lớp M) có 3 phân lớp, được kí hiệu là 3s, 3p và 3d - Mà phân lớp s có 1 AO, phân lớp p có 3 AO, phân lớp d có 5 AO. Mỗi AO chứa tối đa 2 electron => Tổng số electron tối đa có trong lớp L = 1x2 + 3x2 + 5x2 = 18 electron CH tr 24 CH
Phương pháp giải: Bước 1: Xác định số electron trong nguyên tử Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng dần của năng lượng: 1s 2s 2p 3s 3p 4s 3d… Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng Lời giải chi tiết: - Nguyên tử có Z = 16 => Có 16 electron - Viết theo thứ tự: 1s 2s 2p 3s 3p 4s 3d… (trong đó phân lớp s chứa tối ta 2 electron, phân lớp p chứa tối đa 6 electron, phân lớp d chứa tối đa 10 electron, phân lớp f chứa tối đa 14 electron) - Điền các electron: 1s22s22p63s23p4 Đáp án C CH tr 24 CH
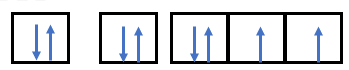
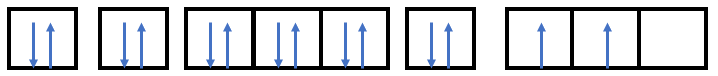
Phương pháp giải: Bước 1: Viết cấu hình electron của nguyên tử Bước 2: Vẽ các AO ứng với mỗi phân lớp trong đó ( phân lớp s có 1 AO, phân lớp p có 3 AO, phân lớp d có 5 AO, phân lớp f có 7 AO) + Mỗi AO chứa tối đa 2 electron được biểu diễn bằng 2 mũi tên ngược chiều nhau và phân bố trên các orbital sao cho số electron độc thân là tối đa (quy tắc Hund) Lời giải chi tiết: - Nguyên tử có Z = 8 => Có 8 electron - Điền các electron: 1s22s22p4
- Nguyên tử có Z = 11 => Có 11 electron - Điền các electron: 1s22s22p63s1
CH tr 25 CH
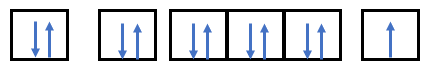
Phương pháp giải: - Nguyên lí vững bền: các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao - Nguyên lí Pauli: trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau - Quy tắc Hund: trong cùng 1 phân lớp, các electron độc thân là tối đa và các electron này có chiều tự quay giống nhau Lời giải chi tiết: - Nguyên tử có Z = 14 => Có 14 electron - Điền các electron: 1s22s22p63s23p2
- Nguyên lí vững bền: các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm orbital mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d… - Nguyên lí Pauli: trong 1 orbital chỉ chứa tối đa 2 electron có chiều tự quay ngược nhau, nếu orbital có 1 electron thì biểu diễn bằng 1 mũi tên đi lên - Quy tắc Hund: trong cùng 1 phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa, các electron này có chiều tự quay giống nhau CH tr 25 CH
Phương pháp giải: Bước 1: Xác định số electron trong nguyên tử Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng dần của năng lượng: 1s 2s 2p 3s 3p 4s 3d… Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng - Nguyên tố mà nguyên tử có 1, 2, 3 electron lớp ngoài cùng thường là nguyên tố kim loại - Nguyên tố mà nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tố phi kim Lời giải chi tiết: - Nguyên tử chlorine có Z = 17 => Có 17 electron - Viết theo thứ tự: 1s 2s 2p 3s 3p 4s 3d… (trong đó phân lớp s chứa tối ta 2 electron, phân lớp p chứa tối đa 6 electron, phân lớp d chứa tối đa 10 electron, phân lớp f chứa tối đa 14 electron) - Điền các electron: 1s22s22p63s23p5 - Nguyên tố chlorine có 7 electron lớp ngoài cùng (lớp 3) => Nguyên tố phi kim CH tr 25 Em có thể
Phương pháp giải: Bước 1: Xác định số hiệu nguyên tử của mỗi nguyên tố Bước 2: Viết cấu hình electron của mỗi nguyên tố Bước 3: Dự đoán tính chất hóa học dựa vào số electron lớp ngoài cùng + Nguyên tử có 8 electron lớp ngoài cùng đều rất bền vững, hầu như không tham gia phản ứng hóa học + Nguyên tố mà nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng là kim loại => Có tính chất của 1 kim loại + Nguyên tố mà nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng là phi kim => Có tính chất của 1 phi kim + Nguyên tố mà nguyên tử có 4 electron ở lớp ngoài cùng có thể là kim loại hoặc phi kim Lời giải chi tiết: - Nitrogen (Z = 7): 1s22s22p3 => Nitrogen có 5 electron ở lớp ngoài cùng (lớp 2) => Là 1 phi kim và có tính chất hóa học của một phi kim - Oxygen (Z = 8): 1s22s22p4 => Oxygen có 6 electron ở lớp ngoài cùng (lớp 2) => Là 1 phi kim và có tính chất hóa học của một phi kim - Aluminium (Z = 13): 1s22s22p63s23p1 => Aluminium có 3 electron ở lớp ngoài cùng (lớp 3) => Là 1 kim loại và có tính chất hóa học của một kim loại
|




















Danh sách bình luận