Bài 20. Ôn tập chương 6 trang 101, 102 Hóa 10 Kết nối tri thứcHãy cho biết trong các phản ứng sau, phản ứng nào có tốc độ nhanh, phản ứng nào có tốc độ chậm? Cho khoảng 2 g zinc dạng hạt vào một cốc đựng dung dịch H2SO4 2M (dư) ở nhiệt độ phòng. Nếu chỉ biến đổi một trong các điều kiện sau đây ( các điều kiện khác giữ nguyên) Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Bài tập 1
Phương pháp giải: Phản ứng xảy ra nhanh hay chậm phụ thuộc vào nhiều yếu tố: trạng thái tồn tại, nồng độ, nhiệt độ, áp suất,… Lời giải chi tiết: (a) Phản ứng xảy ra nhanh. (b) Phản ứng xảy ra chậm (c) Phản ứng xảy ra nhanh. Bài tập 2
Phương pháp giải: - Tốc độ phản ứng tăng khi: tăng diện tích tiếp xúc, tăng nồng độ, tăng nhiệt độ… Lời giải chi tiết: (a) Kẽm được dùng dưới dạng bột nên tăng diện tích tiếp xúc => Tốc độ phản ứng tăng lên (b) Dung dịch H2SO4 1M có nồng độ giảm so với ban đầu H2SO4 2M => Tốc độ phản ứng giảm xuống (c) Tăng nhiệt độ của phản ứng => Tốc độ phản ứng tăng lên Bài tập 3
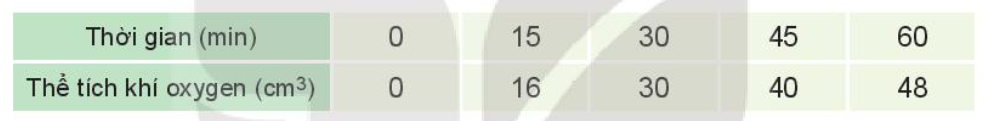
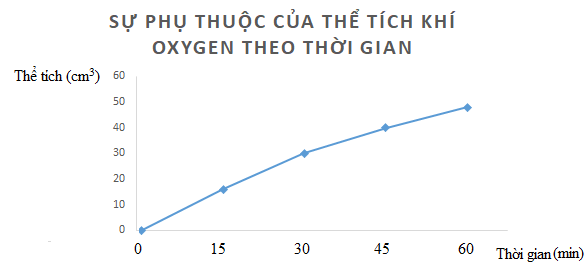
Phương pháp giải:
Lời giải chi tiết: a)
b) Nhận xét: Tốc độ trung bình giảm dần theo thời gian Bài tập 4
Phương pháp giải: Nhiệt độ tăng lên, tốc độ phản ứng cũng tăng. Lời giải chi tiết: Chuẩn bị: 2 ống nghiệm, 2 kẹp gỗ, 1 đèn cồn, 4 gam Zn hạt và dung dịch H2SO4 loãng 0,1 M. Tiến hành: - Cho vào 2 ống nghiệm, mỗi ống 5mL H2SO4 0,1M - Cho cùng một lượng (2 gam) zinc dạng viên vào ống nghiệm (1) và (2). - Đun nóng 1 ống nghiệm Kết quả: Ống nghiệm dược đun nóng sẽ thoát khí nhanh hơn. Bài tập 5
Phương pháp giải: \(\gamma = \frac{{{v_{T + 10}}}}{{{v_T}}}\) Lời giải chi tiết: \(\gamma = \frac{{{v_{T + 10}}}}{{{v_T}}}\) => \(\frac{{{v_2}}}{{{v_1}}} = {\gamma ^{\frac{{{T_2} - {T_1}}}{{10}}}}\) Ta có: v1 = 0,068 v2 = 0,017 T1 = 45oC => \(\frac{{0,017}}{{0,068}} = {2^{\frac{{x - 45}}{{10}}}}\) => x = 25oC
|





















Danh sách bình luận