Lý thuyết bài 12: Liên kết cộng hóa trịLiên kết cộng hóa trị Quảng cáo
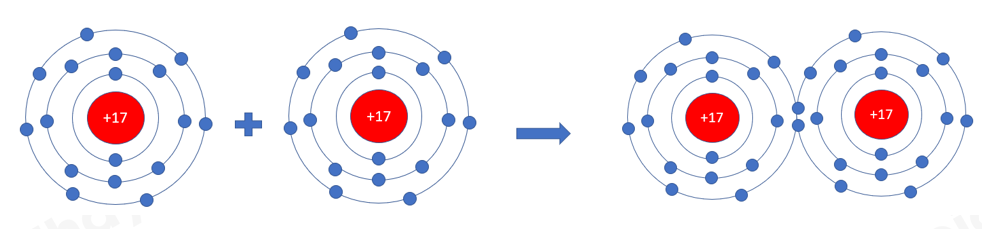
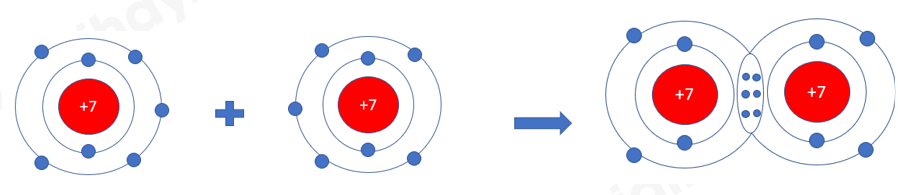
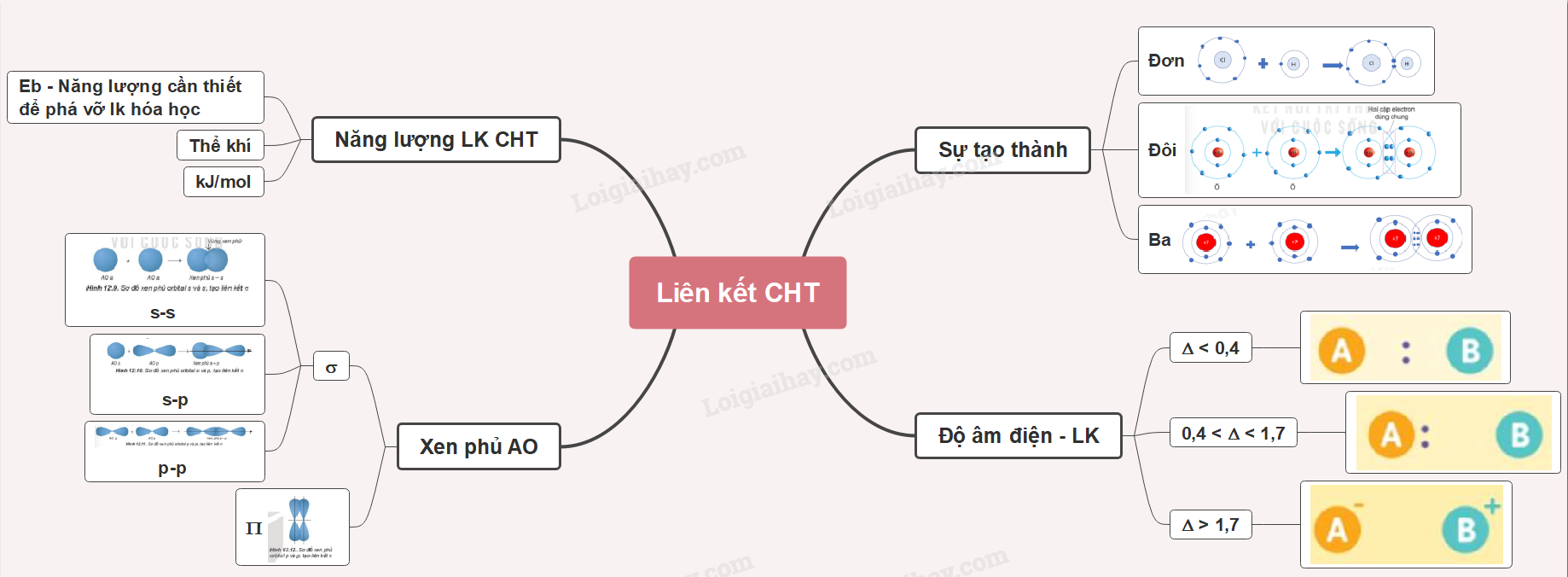
Lý thuyết: Liên kết cộng hóa trị I. Sự tạo thành liên kết cộng hóa trị - Nguyên tử phi kim có lớp electron hóa trị gần bão hòa và có xu hướng nhận thêm electron để đạt cấu hình electron bền vững của khí hiếm => Khi 2 nguyên tử phi kim liên kết với nhau, chúng sẽ góp 1 hoặc nhiều electron để tạo thành electron dùng chung => Cặp electron dùng chung tạo ra liên kết cộng hóa trị giữa hai nguyên tử - Cặp electron dùng chung giữa 2 nguyên tử có thể được tạo thành theo 2 kiểu khác nhau: + Mỗi nguyên tử góp 1 hay nhiều electron để tạo thành các cặp electron dùng chung + Các cặp electron dùng chung chỉ do một nguyên tử đóng góp, liên kết giữa 1 nguyên tử là liên kết cộng hóa trị kiểu cho – nhận 1. Sự tạo thành phân tử có liên kết đơn Ví dụ: Phân tử chlorine: mỗi nguyên tử chlorine có 7 electron hóa trị, 2 nguyên tử chlorine liên kết với nhau bằng cách mỗi nguyên tử chlorine góp 1 electron => 1 cặp electron dùng chung
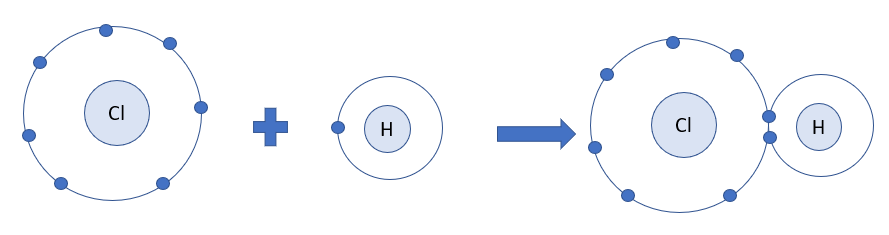
- Thay 1 cặp electron dùng chung bằng 1 gạch nối => Liên kết đơn Ví dụ: Phân tử hydrogen chloride: Nguyên tử hydrogen liên kết với nguyên tử chlorine bằng cách mỗi nguyên tử góp 1 electron tạo thành 1 cặp electron dùng chung trong phân tử HCl
=> Giữa 2 nguyên tử H và Cl có 1 cặp electron dùng chung => Liên kết đơn Ví dụ: Liên kết cho - nhận
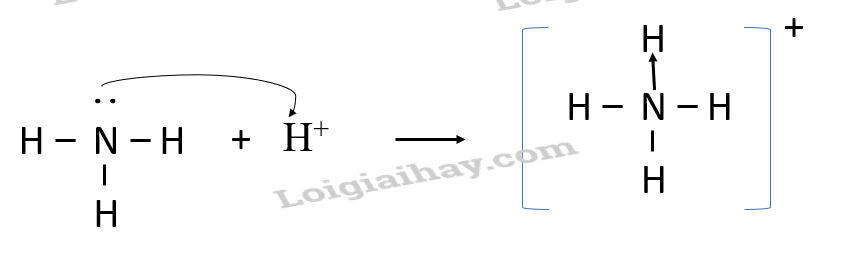
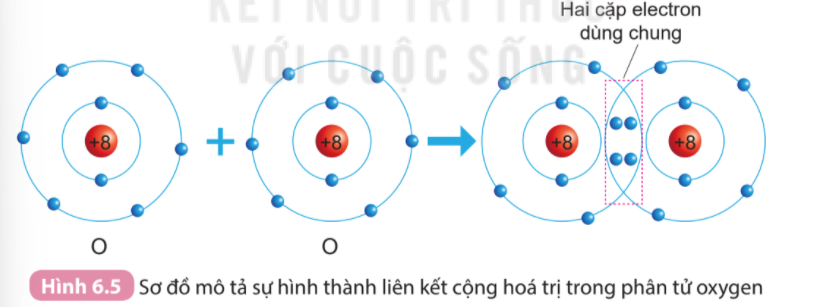
- Phân tử NH3, lớp ngoài cùng của nguyên tử N có 5 electron, trong đó có cặp electron chưa liên kết => Ion H+ có orbital trống, không có electron => Khi phân tử NH3 kết hợp với H+, nguyên tử N đóng góp cặp electron chưa liên kết để tạo liên kết với H+ tạo thành NH4+ => Liên kết cho – nhận được hình thành => Nguyên tử N là nguyên tử cho, ion H+ là nguyên tử nhận 2. Sự tạo thành phân tử có liên kết đôi Ví dụ: Phân tử oxygen: Mỗi nguyên tử oxygen có 6 electron hóa trị, 2 nguyên tử oxygen liên kết với nhau bằng cách mỗi nguyên tử đóng góp 2 electron, tạo thành 2 cặp electron dùng chung
=> Giữa 2 nguyên tử oxygen có 2 cặp electron dùng chung => Liên kết đôi 3. Sự tạo thành phân tử có liên kết ba Ví dụ: Phân tử nitrogen: Nguyên tử nitrogen có 5 electron hóa trị, 2 nguyên tử nitrogen liên kết với nhau bằng cách mỗi nguyên tử nitrogen đóng góp 3 electron, tạo thành 3 cặp electron dùng chung
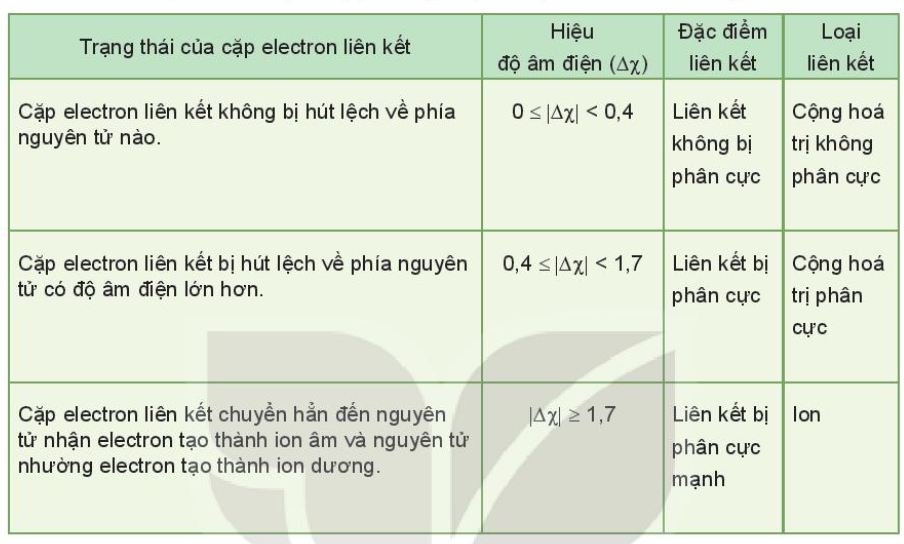
=> Giữa 2 nguyên tử nitrogen có 3 cặp electron dùng chung => Liên kết ba II. Độ âm điện và liên kết hóa học
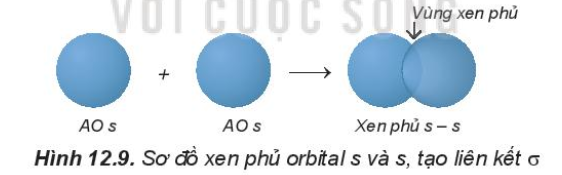
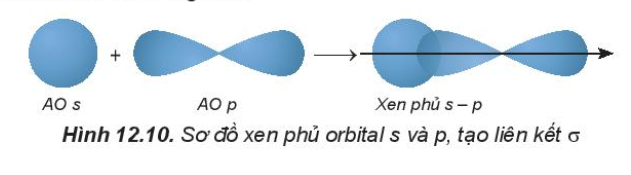
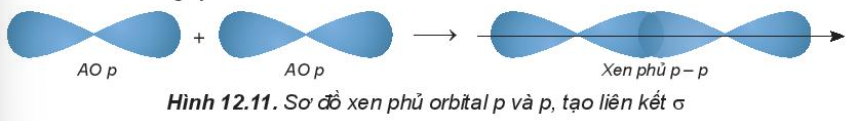
Ví dụ: - Trong phân tử HCl, hiệu độ âm điện của Cl và H: 3,16 – 2,20 = 0.96 => Liên kết cộng hóa trị phân cực - Trong phân tử NaCl, hiệu độ âm điện của Cl và Na: 3,16 – 0,93 = 2,23 => Liên kết ion III. Mô tả liên kết cộng hóa trị bằng sự xen phủ các orbital nguyên tử 1. Sự xen phủ các orbital nguyên tử tạo liên kết σ - Sự xen phủ s – s - Sự xen phủ s – p - Sự xen phủ p – p
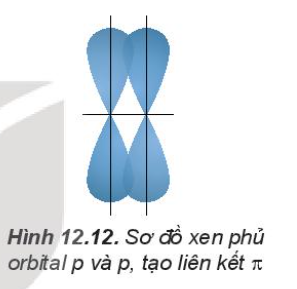
2. Sự xen phủ các orbital nguyên tử tạo lên liên kết п
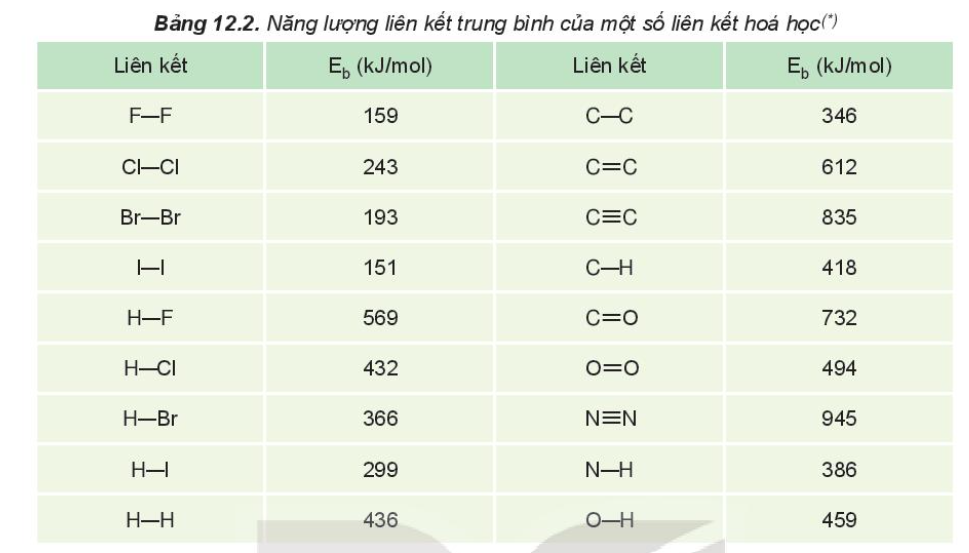
IV. Năng lượng liên kết cộng hóa trị - Khái niệm: Năng lượng liên kết (Eb) là năng lượng cần thiết để phá vỡ một liên kết hóa học trong phân tử ở thể khí thành các nguyên tử ở thể khí - Đơn vị: kJ/mol Ví dụ: Để phá vỡ 1 mol liên kết H-Cl thành các nguyên tử H và Cl (ở thể khí) theo phương trình HCl(g) → H(g) + Cl(g) Cần năng lượng là 432 kJ, nên năng lượng liên kết H-Cl là Eb = 432 kJ/mol
=> Năng lượng liên kết càng lơn thì liên kết càng bền và phân tử càng khó bị phân hủy (đặc trưng cho độ bền của liên kết)
|























Danh sách bình luận