Đề thi giữa kì 1 KHTN 7 Chân trời sáng tạo - Đề số 9Tải về Câu 1: Phát biểu nào dưới đây không đúng? A. Nguyên tử được cấu thành từ các hạt cơ bản là proton, neutron và electron. B. Hầu hết hạt nhân nguyên tử được cấu thành từ các hạt proton và neutron. Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
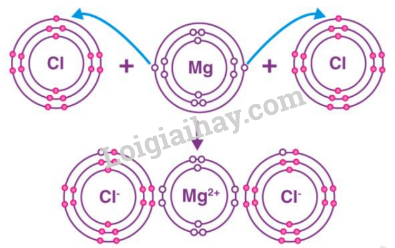
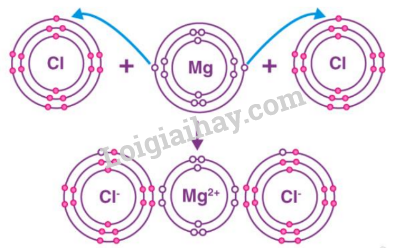
Đề thi I. Trắc nghiệm Câu 1: Phát biểu nào dưới đây không đúng? A. Nguyên tử được cấu thành từ các hạt cơ bản là proton, neutron và electron. B. Hầu hết hạt nhân nguyên tử được cấu thành từ các hạt proton và neutron. C. Vỏ nguyên tử được cấu thành bởi các hạt electron. D. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử. Câu 2: Chọn phương án đúng. Nguyên tố hoá học là tập hợp những nguyên tử A. có cùng số proton. B. có cùng khối lượng nguyên tử. C. có cùng số neutron. D. có cùng số hạt proton, neutron và electron. Câu 3: Nguyên tử của nguyên tố X có 2 lớp electron và có 4 electron ở lớp ngoài cùng. Vị trí của nguyên tố X trong bảng tuần hoàn là A. chu kỳ 4, nhóm VI C. chu kì 4, nhóm II B. chu kì 2, nhóm IV D. chu kì 2, nhóm II Câu 4: Trong mật ong có nhiều fructose. Phân tử fructose gồm 6 nguyên tử C, 12 nguyên tử H và 6 nguyên tử O. Khối lượng phân tử fructose tính theo đơn vị amu là A. 80 amu. B. 100 amu. C. 180 amu. D. 160 amu. Câu 5: Phát biểu nào sau đây đúng? A. để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhường các electron ở lớp ngoài cùng B. để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhận thêm electron để có đủ 8 electron ở lớp ngoài cùng C. để tạo ion dương thì nguyên tử của nguyên tố kim loại sẽ nhận thêm electron để có đủ 8 electron ở lớp ngoài cùng D. để tạo ion dương thì nguyên tử của nguyên tố hóa học sẽ nhường các electron ở lớp ngoài cùng Câu 6: Phần trăm khối lượng của Cu, O trong hợp chất CuO lần lượt là A. 20%, 80%. B. 80%, 20%. C. 30%, 70%. D. 70%, 30%. Câu 7: Khối lượng phân tử CaCO3 là A. 99 amu. B. 100 amu. C. 90 amu. D. 95 amu. Câu 8: Một chất lỏng dễ bay hơi có thành phần % khối lượng là 23,8% C, 5,9% H, 70,3% Cl. Biết phân tử khối của hợp chất là 50,5 amu. Số nguyên tử của C, H, Cl lần lượt là A. 1, 3, 1. B. 1, 2, 1. C. 1, 1,3. D. 1, 1, 2. Câu 9: Tổng số hạt trong hạt nhân của nguyên tử nguyên tố X là 14 hạt, trong đó số hạt không mang điện bằng số hạt mang điện. Nguyên tố X là A. P (phosphorus). B. Ni (nitrogen). C. N (nitrogen). D. O (oxygen). Câu 10: Công thức hóa học của hợp chất tạo bởi hai nguyên tố N và H là (biết N có hóa trị III, H có hóa trị I) A. NH. B. NH2. C. NH3. D. N2H. II. Tự luận Câu 1: Nguyên tử của nguyên tố X có tổng số các loại hạt trong hạt nhân bằng 31. Trong hạt nhân nguyên tử X, số hạt mang điện ít hơn số hạt không mang điện là 1 hạt. Xác định số hiệu nguyên tử, khối lượng nguyên tử và viết kí hiệu nguyên tử của X. Câu 2: Cho sơ đồ mô tả sự hình thành liên kết ion trong phân tử magnesium chloride như sau: Hãy cho biết: a. Nguyên tử Mg và nguyên tử Cl đã nhường hay nhận bao nhiêu electron. b. Sau khi nhường (nhận) electron để hình thành liên kết ion thì lớp vỏ của nguyên tử Mg và nguyên tử Cl giống với lớp vỏ của nguyên tử khí hiếm nào? Đáp án Phần trắc nghiệm
Câu 1: Phát biểu nào dưới đây không đúng? A. Nguyên tử được cấu thành từ các hạt cơ bản là proton, neutron và electron. B. Hầu hết hạt nhân nguyên tử được cấu thành từ các hạt proton và neutron. C. Vỏ nguyên tử được cấu thành bởi các hạt electron. D. Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử. Phương pháp giải Dựa vào kiến thức về nguyên tử Lời giải chi tiết Nguyên tử có cấu trúc rỗng Đáp án D Câu 2: Chọn phương án đúng. Nguyên tố hoá học là tập hợp những nguyên tử A. có cùng số proton. B. có cùng khối lượng nguyên tử. C. có cùng số neutron. D. có cùng số hạt proton, neutron và electron. Phương pháp giải: Các nguyên tử có cùng số proton trong hạt nhân thuộc cùng một nguyên tố hóa học. Lời giải chi tiết: Nguyên tố hoá học là tập hợp những nguyên tử có cùng số proton. → Chọn A. Câu 3: Nguyên tử của nguyên tố X có 2 lớp electron và có 4 electron ở lớp ngoài cùng. Vị trí của nguyên tố X trong bảng tuần hoàn là A. chu kỳ 4, nhóm VI C. chu kì 4, nhóm II B. chu kì 2, nhóm IV D. chu kì 2, nhóm II Phương pháp giải Số lớp electron = chu kì, số electron lớp ngoài cùng = số nhóm Lời giải chi tiết X có 2 lớp electron => chu kì 2 X có 4 electon lớp ngoài cùng => nhóm IV Đáp án B Câu 4: Trong mật ong có nhiều fructose. Phân tử fructose gồm 6 nguyên tử C, 12 nguyên tử H và 6 nguyên tử O. Khối lượng phân tử fructose tính theo đơn vị amu là A. 80 amu. B. 100 amu. C. 180 amu. D. 160 amu. Phương pháp giải Dựa vào công thức của hợp chất fructose để tính khối lượng phân tử fructose Lời giải chi tiết Khối lượng phân tử fructose = 6.MC + 12. MH + 6. MO = 6.12 + 12.1 + 6.16 = 180 amu ( Với M: kí hiệu khối lượng nguyên tử) Câu 5: Phát biểu nào sau đây đúng? A. để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhường các electron ở lớp ngoài cùng B. để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhận thêm electron để có đủ 8 electron ở lớp ngoài cùng C. để tạo ion dương thì nguyên tử của nguyên tố kim loại sẽ nhận thêm electron để có đủ 8 electron ở lớp ngoài cùng D. để tạo ion dương thì nguyên tử của nguyên tố hóa học sẽ nhường các electron ở lớp ngoài cùng Phương pháp giải Để tạo ion dương thì nguyên tử của nguyên tố kim loại sẽ nhường các electron ở lớp ngoài cùng Để tạo ion âm thì nguyên tử của nguyên tố phi kim sẽ nhận các electron để có đủ 8 electron lớp ngoài cùng Lời giải chi tiết Đáp án A Câu 6: Phần trăm khối lượng của Cu, O trong hợp chất CuO lần lượt là A. 20%, 80%. B. 80%, 20%. C. 30%, 70%. D. 70%, 30%. Phương pháp giải Tính khối lượng phân tử của CuO. Áp dụng công thức tính phần trăm khối lượng các nguyên tố trong hợp chất Lời giải chi tiết Khối lượng phân tử CuO = M Cu + M O = 64 + 16 = 80amu \(\begin{array}{l}{\% _{Cu}} = \frac{{{M_{Cu}}}}{{{M_{CuO}}}}.100\% = \frac{{64}}{{80}}.100\% = 80\% \\{\% _O} = 100\% - 80\% = 20\% \end{array}\) Đáp án B Câu 7: Khối lượng phân tử CaCO3 là A. 99 amu. B. 100 amu. C. 90 amu. D. 95 amu. Phương pháp giải Khối lượng phân tử = tổng khối lượng các nguyên tử của nguyên tố Lời giải chi tiết Khối lượng phân tử CaCO3 = khối lượng nguyên tử Ca + khối lượng nguyên tử C + 3. Khối lượng nguyên tử O = 40 + 12 + 16.3 = 100 amu Đáp án B Câu 8: Một chất lỏng dễ bay hơi có thành phần % khối lượng là 23,8% C, 5,9% H, 70,3% Cl. Biết phân tử khối của hợp chất là 50,5 amu. Số nguyên tử của C, H, Cl lần lượt là A. 1, 3, 1. B. 1, 2, 1. C. 1, 1,3. D. 1, 1, 2. Phương pháp giải Dựa vào thành phần % khối lượng của các nguyên tố trong phân tử để xác định công thức Lời giải chi tiết Giả sử công thức của hợp chất: có x nguyên tử C, y nguyên tử H, z nguyên tử Cl Công thức hóa học: CxHyClz \(\begin{array}{l}\% C = \frac{{x.{M_C}}}{{{M_X}}}.100\% = 23,8\% \to x = \frac{{23,8\% .50,5}}{{12}} = 1\\\% H = \frac{{y.{M_O}}}{{{M_X}}}.100\% = 5,9\% \to y = \frac{{5,9\% .50,5}}{1} = 3\\\% Cl = \frac{{z.{M_{Cl}}}}{{{M_X}}}.100\% = 70,3\% \to z = \frac{{70,3\% .50,5}}{{35,5}} = 1\end{array}\) Số nguyên tử của C, H, Cl lần lượt là: 1:3:1 Đáp án A Câu 9: Tổng số hạt trong hạt nhân của nguyên tử nguyên tố X là 14 hạt, trong đó số hạt không mang điện bằng số hạt mang điện. Nguyên tố X là A. P (phosphorus). B. Ni (nitrogen). C. N (nitrogen). D. O (oxygen). Lời giải chi tiết (1) P + N = 14 (2) P = N Mà P = E nên P = E = 7, N = 7 Nguyên tố nitrogen (N) Đáp án C Câu 10: Công thức hóa học của hợp chất tạo bởi hai nguyên tố N và H là (biết N có hóa trị III, H có hóa trị I) A. NH. B. NH2. C. NH3. D. N2H. Phương pháp giải Dựa vào hóa trị của nguyên tố N và H để xác định công thức hóa học Lời giải chi tiết Vì N có hóa trị III và H có hóa trị I => công thức hóa học của hợp chất là NH3 II. Tự luận Câu 1: Nguyên tử của nguyên tố X có tổng số các loại hạt trong hạt nhân bằng 31. Trong hạt nhân nguyên tử X, số hạt mang điện ít hơn số hạt không mang điện là 1 hạt. Xác định số hiệu nguyên tử, khối lượng nguyên tử và viết kí hiệu nguyên tử của X. Lời giải chi tiết Ta có: số e = số p = Z; số n = N \(\left\{ \begin{array}{l}{\rm{Z + N = 31}}\\{\rm{ - Z\;}}\,\,{\rm{ + N = 1}}\end{array} \right. \Leftrightarrow \)\(\left\{ \begin{array}{l}{\rm{Z = 15}}\\{\rm{N = 16}}\end{array} \right.\) Số hiệu nguyên tử = Z = 15. Khối lượng nguyên tử: A = Z + N = 15 +16 =31 Kí hiệu nguyên tử X: \({}_{15}^{31}X\) Câu 2: Cho sơ đồ mô tả sự hình thành liên kết ion trong phân tử magnesium chloride như sau: Hãy cho biết: a. Nguyên tử Mg và nguyên tử Cl đã nhường hay nhận bao nhiêu electron. b. Sau khi nhường (nhận) electron để hình thành liên kết ion thì lớp vỏ của nguyên tử Mg và nguyên tử Cl giống với lớp vỏ của nguyên tử khí hiếm nào? Lời giải chi tiết a) Nguyên tử Mg đã nhường 2 electron, mỗi nguyên tử Cl đã nhận 1 electron b) Sau khi nhường 2 electron nguyên tử Mg có 8 electron lớp ngoài cùng giống với khí hiếm Ne Sau khi nhận 1 electron nguyên tử Cl có 8 electron lớp ngoài cùng giống với khí hiếm Ar
|




















Danh sách bình luận