Đề kiểm tra 15 phút – Đề số 6 – Chương 7 – Hóa học 12Đáp án và lời giải chi tiết đề thi kiểm tra 15 phút – Đề số 6 – Chương 7 – Hóa học 12 Quảng cáo
Đề bài Câu 1. Phản ứng nào sau đây đúng? \(\begin{array}{l}A.\,Zn + {O_2} \to Zn{O_2}\\B.\,Pb + {O_2} \to Pb{O_2}\\C.\,Sn + {O_2} \to Sn{O_2}\\D.\,Ni + {O_2} \to Ni{O_2}\end{array}\) Câu 2. Kim loại kẽm dùng để khử bạc từ phức \(Na\left[ {Ag{{(CN)}_2}} \right].\) Muốn loại bỏ hoàn toàn Zn dư người ta dùng hóa chất nào sau đây? A. Dung dịch \(CuS{O_4}.\) B. Dung dịch \(HN{O_3}\) loãng. C. Dung dịch \({H_2}S{O_4}\) đặc nóng. D. Dung dịch NaOH. Câu 3. Để phân biệt các dung dịch \(Pb{(N{O_3})_2},\,Sn{(N{O_3})_2},\,Zn{(N{O_3})_2},\)\(\,Ca{(N{O_3})_2}\) người ta dùng dung dịch \(N{a_2}S.\) Hiện tượng quan sát được ở dung dịch \(Sn{(N{O_3})_2}\) là A. kết tủa đen. B. kết tủa trắng. C. kết tủa nâu. D. không kết tủa. Câu 4. Ứng dụng nào sau đây không đúng với kim loại tương ứng? A. Kẽm – sản xuất pin khô. B. Thiếc – giấy gói bánh kẹo. C. Chì – thiết bị ngăn phóng xạ. D. Niken – sản xuất dây dẫn điện. Câu 5. Ngâm một lá niken trong các dung dịch loãng các muối sau: \(MgC{l_2},NaCl,Cu{(N{O_3})_2},AlC{l_3},\)\(\,ZnC{l_2},Pb(N{O_2}).\) Niken sẽ khử được các muối \(\begin{array}{l}A.\,AlC{l_3},ZnC{l_2},Pb{(N{O_3})_2}.\\B.\,Cu{(N{O_3})_2},Pb{(N{O_3})_2}.\\C.\,MgC{l_2},NaCl,Cu{(N{O_3})_2}.\\D.\,MgC{l_2},AlC{l_3},Pb{(N{O_3})_2}.\end{array}\) Câu 6. Quá trình phóng điện (chiều thuận) và quá trình sạc điện (chiều nghịch) cả acquy chì diễn ra như sau: \(Pb + Pb{O_2} + 2{H_2}S{O_4} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} 2PbS{O_4} + 2{H_2}O\). Chất nào bị khử trong quá trình phóng điện? \(\begin{array}{l}A.\,Pb.\\C.\,{H_2}S{O_4}.\end{array}\) \(\begin{array}{l}B.\,Pb{O_2}.\\D.\,SO_4^{2 - }/{H^ + }\end{array}\) Câu 7. Cho từ từ dung dịch kiềm dư vào dung dịch hỗn hợp \(Pb{(N{O_3})_2}\) và\(Zn{(N{O_3})_2}.\) Sau phản ứng A. có kết tủa trắng keo. B. có kết tủa sau đó kết tủa tan một phần. C. dung dịch trong suốt. D. có kết tủa xanh lam. Câu 8. Vỏ đồ hộp đựng thực phẩm bằng sắt được mạ một lớp kim loại. Lớp mạ đó là A. Zn; vì Zn có thể chịu ăn mòn thay cho sắt. B. Sn: vì nếu đồ hộp bị ăn mòn thì Sn cũng không tan, không gây nhiễm độc. C. Ag; vì Ag có tính diệt khuẩn. D. Ni: vì Ni rất bền với nước và không khí ở nhiệt độ thường. Câu 9. Hòa tan hoàn toàn hỗn hợp Zn, ZnO bằng dung dịch \(HN{O_3}\) loãng, dư. Kết thúc thí nghiệm không có khí thoát ra, dung dịch thu được có chứa 8 gam \(N{H_4}N{O_3}\) và 113,4 gam \(Zn{(N{O_3})_2}\). Phần trăm số mol Zn có trong hỗn hợp ban đầu là A. 66,67%. B. 33,33%. C. 16,66%. D. 93,34%. Câu 10. Nhiệt phân hoàn toàn một muối nitrat của kim loại M có hóa trị không đổi, được 8,8125 gam hợp chất rắn A và 12,69 gam hỗn hợp khí B. Kim loại M là A. Ag (108). B. Ni (59). C. Zn (65). D. Pb (207). Lời giải chi tiết Câu 1. Chọn C. Câu 2. Chọn D. \(\begin{array}{l}2NaOH + Zn \to N{a_2}Zn{O_2} + {H_2}\\A\,sai:Zn + CuS{O_4} \to ZnS{O_4} + Cu\end{array}\) B, C sai: Ag cũng bị hòa tan. Câu 3. Chọn C. Dùng phương pháp loại trừ: PbS màu đen, ZnS màu trắng, CaS không kết tủa (không phản ứng). Câu 4. Chọn D. Câu 5. Chọn B. Ni khử được các muối \(Cu{(N{O_3})_2},Pb{(N{O_3})_2}.\) Do Ni đứng trước Cu, Pb trong dãy điện hóa học của kim loại.. Câu 6. Chọn B. PbO2 + 4H+ + 2e + SO42- \( \to \)PbSO4 + 2H2O Câu 7. Chọn C. Vì \(Pb{(OH)_2}\) và \(Zn{(OH)_2}\) đều lưỡng tính. Muối \(ZnO_2^{2 - }\) và \(PbO_2^{2 - }\) đều không màu. Câu 8. Chọn B. Câu 9. Chọn A.
Câu 10. Chọn B. \(AgN{O_3}\) nhiệt phân chỉ thu được kim loại. Các kim loại còn lại đều hóa trị 2. Loigiaihay.com
|














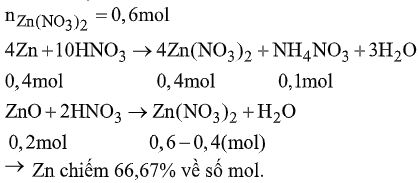
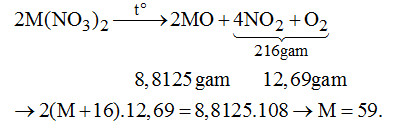






Danh sách bình luận