Đề kiểm tra 15 phút – Đề số 4 – Chương 7 – Hóa học 12Đáp án và lời giải chi tiết đề thi kiểm tra 15 phút – Đề số 4 – Chương 7 – Hóa học 12 Quảng cáo
Đề bài Câu 1. Cấu hình electron của \({}_{24}Cr\) là \(\begin{array}{l}A.\,\left[ {Ar} \right]3{d^5}4{s^1}.\\B.\,\left[ {Ar} \right]3{d^4}4{s^2}.\\C.\,\left[ {Ar} \right]3{d^6}.\\D.\,\left[ {Ar} \right]4{s^2}3{d^4}.\end{array}\) Câu 2. Nhận xét nào sau đây đúng? A. Crom là kim loại có màu vàng da cam đẹp, dùng làm đồ trang sức. B. Crom là kim loại cứng nhất có thể rạch được kim cương. C. Các vật liệu kim loại được mạ Crom để tăng độ cứng. D. Crom dùng để luyện các loại thép có độ cứng cao. Câu 3. Phản ứng nào sau đây sai?
Câu 4. Giữa muối đicromat \((C{r_2}O_7^{2 - })\) và \((CrO_4^{2 - }),\) có màu vàng tươi, có cân bằng: Hiện tượng xảy ra khi từ từ tới dư dung dịch xút loãng vào dung dịch \({K_2}C{r_2}{O_7}\) là A. Thấy màu đỏ da cam nhạt dần do có sự pha loãng của dung dịch xút. B. Không có hiện tượng gì lạ, vì không có phản ứng xảy ra. C. Màu dung dịch trong ống nghiệm không đổi. D. Dung dịch chuyển dần san màu vàng tươi. Câu 5. Có thể phân biệt phend crom \(({K_2}S{O_4}.C{r_2}{(S{O_4})_3},24{H_2}O)\) và phèn sắt \(({K_2}S{O_4}.F{e_2}{(S{O_4})_3}.24{H_2}O)\) bằng thuốc thử là A. \({H_2}O.\) B. dung dịch HCl. C. dung dịch \(B{r_2}.\) D. dung dịch NaOH. Câu 6. Phần trăm khối lượng của crom trong một oxit crom là 68,421%. Nhận xét nào sau đây đúng về oxit này? A. Có màu đỏ thẫm. B. Có tính khử mạnh. C. Không phản ứng với bột nhôm đốt nóng. D. Là sản phẩm nhiệt phân \(Cr{(OH)_2}\) trong không khí. Câu 7. Trong sơ đồ phản ứng sau: \(Cr{O_3} \to X \to Cr \to Y \to C{r_2}{O_3}\). Các chất X, Y lần lượt là \(\begin{array}{l}A.\,{K_2}C{r_2}{O_7},\,CrO.\\B.\,C{r_2}{O_3},\,C{r_2}{S_3}.\\C.\,{H_2}Cr{O_4},\,Cr{(OH)_3}.\\D.\,CrO,\,Cr{(N{O_3})_3}.\end{array}\) Câu 8. Chất X tan trong \({H_2}S{O_4}\) đặc, nguội không tan trong HCl loãng. X tan được trong dung dịch kiềm đặc, dư cho dung dịch Y không màu. Thêm tiếp nước clo và Y thấy dung dịch chuyển màu vang. X là \(\begin{array}{l}A.\,C{r_2}{O_3}\\C.\,Cr{(OH)_3}.\end{array}\) \(\begin{array}{l}B.\,Cr.\\D.\,Cr{O_3}.\end{array}\) Câu 9. Cho dung dịch chứa a mol \(CrC{l_3}\) tác dụng với dung dịch chứa 0,5 mol NaOH thu được 6,18 gam kết tủa. Giá trị của a là A. 0,06. B. 0,04. C. 0,14. D. 0,167. Câu 10. Hòa tan hết 1,08 gam hỗn hợp Cr và Fe trong dung dịch HCl loãng, nóng thu được 448 ml khí (đktc). Khối lượng crom có trong hỗn hợp là A. 0,065 gam. B. 0,520 gam. C. 0,560 gam. D. 1,015 gam. Lời giải chi tiết Câu 1. Chọn A. Câu 2. Chọn D. Câu 3. Chọn B. \(2CrC{l_3} + Zn \to 2CrC{l_2} + ZnC{l_2}\) Câu 4. Chọn D. Thêm NaOH trung hòa \({H^ + }\) làm cân bằng chuyển dịch về chiều thuận. Câu 5. Chọn D. \(\begin{array}{l}C{r^{3 + }} + 3O{H^ - } \to Cr{(OH)_3}\\Cr{(OH)_3} + O{H^ - } \to CrO_2^ - + 2{H_2}O\end{array}\) Câu 6. Chọn D. Oxit là \(C{r_2}{O_3}.\) \(\begin{array}{l}C{r_2}{O_3} + 2Al \to 2Cr + A{l_2}{O_3}\\4Cr{(OH)_2} + {O_2} \to 2C{r_2}{O_3} + 4{H_2}O\end{array}\) \(Cr{O_3}\) có màu đỏ thẫm, CrO có màu đen.. \(Cr{O_3}\) có tính oxi hóa mạnh. CrO có tính khử mạnh. Câu 7. Chọn B. \(\begin{array}{l}2Cr{O_3} + 2N{H_3} \to C{r_2}{O_3} + {N_2} + 3{H_2}O\\C{r_2}{O_3} + 2Al \to 2Cr + A{l_2}{O_3}\\3Cr + 3S \to C{r_2}{S_3}\\C{r_2}{S_3} + \dfrac{9}{2}{O_2} \to C{r_2}{O_3} + 3S{O_2}\end{array}\) Câu 8. Chọn A. Cr thụ động trong \({H_2}S{O_4}\) đặc nguội. \(Cr{(OH)_3}\) tan dễ dàng trong dung dịch axit loãng. \(2NaCr{O_2} + 8NaOH + 3C{l_2} \to \)\(\,2N{a_2}Cr{O_4} + 6NaCl + 4{H_2}O\) \(Cr{O_3}\) tan dễ dàng trong nước \( \to \) tan trong dung dịch HCl. Câu 9. Chọn C. \(3NaOH + CrC{l_3} \to Cr{(OH)_3} + 3NaCl\) 0,18 mol 0,06 mol 0,06 mol \( \to \) còn 0,32 mol NaOH phản ứng tạo ra \(NaCr{O_2}.\) \(4NaOH + CrC{l_3} \to NaCr{O_2} + 3NaCl + {H_2}O\) 0,32 mol 0,08 mol \( \to \) Tổng số mol \(CrC{l_3}\): 0,14 mol. Câu 10. Chọn B. \(\begin{array}{l}Fe,Cr + 2HCl \to FeC{l_2},CrC{l_2} + {H_2} \uparrow \\{n_{hh}} = 52{n_{Cr}} + 56{n_{Fe}} = 1,08gam\\ \to {n_{{H_2}}} = {n_{Cr}} + {n_{Fe}} = 0,02mol\\{n_{Cr}} = {n_{Fe}} = 0,01mol.\end{array}\) Loigiaihay.com
|














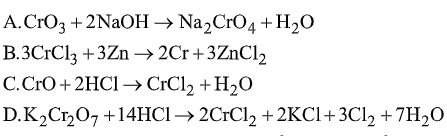
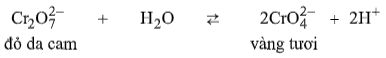






Danh sách bình luận