Đề số 60 - Đề thi thử THPT Quốc gia môn Hóa họcĐáp án và lời giải chi tiết Đề thi thử THPT Quốc gia môn Hóa học đề trắc nghiệm. Quảng cáo
Đề bài Cho biết khối lượng nguyên tử ( theo đvC) của các nguyên tố: H = 1; Li = 7; C =12; N = 14; O = 16; Na = 23 ; Mg = 24; Al = 27; S = 32; Cl = 35,5; K = 39; Ca = 40; Cr = 52, Mn = 55, Fe = 56 ; Cu = 64; Zn = 65; Br = 80; Ag = 108; Sn = 119; Ba = 137; Pb = 207. Câu 1: Cho 0,78g benzen vào ống nghiệm chứa sẵn hỗn hợp HNO3 và H2SO4 đặc ( vừa đủ) và lắc mạnh, giả sử phản ứng thu được nitro benzen là một chất lỏng nặng màu vàng nhạt, mùi hạnh nhân. Khối lượng chất lỏng đó là: A. 1,23 gam B. 0,984 gam C. 0,615 gam D. 1,08 gam Câu 2: Chọn câu đúng nhất trong số các câu sau đây: A. Những dd có pH < 7 thì làm quỳ tím hóa đỏ. B. giá trị pH tăng thì độ axit của dung dịch tăng. C. Giá trị pH tăng thì độ axit của dung dịch giảm. D. Những dd có pH > 7 thì làm quỳ tím hóa xanh. Câu 3: Công thức nào sau đây không thể là công thức đơn giản của một este no, mạch hở? A. C8H10O8. B. C5H8O2. C. C5H10O. D. C5H9O2. Câu 4: Nếu chỉ được dùng nước không thể nhận biết được các chất trong đáp án nào sau đây? A. MgCO3, Al, Na2O. B. Al(OH)3, Mg(OH)2, NaOH. C. Na, Al, Al2O3. D. KOH, CaCO3, Mg(OH)2. Câu 5: Cho X là một Aminoaxit ( có 1 nhóm chức –NH2 và một nhóm chức –COOH) điều khẳng định nào sau đây không đúng? A. Hợp chất X phải có tính lưỡng tính. B. X không làm đổi màu quỳ tím. C. Khối lượng phân tử của X là một số chẵn. D. Khối lượng mol phân tử của X ≥ 75. Câu 6: Khi cho kim loại Na vào dung dịch CuSO4 loãng thì sẽ xảy ra hiện tượng: A. Chỉ sủi bọt khí. B. Ban đầu có sủi bọt khí, sau đó có tạo thành kết tủa xanh, rồi kết tủa tan ra, dung dịch trong suốt. C. Ban đầu có xuất hiện kết tủa xanh, sau đó kết tủa tan ra, dung dịch trong suốt. D. Ban đầu có sủi bọt khí, sau đó có tạo thành kết tủa xanh. Câu 7: Cho các chất sau đây: metan, etilen, propin, stiren, m – xilen, isopren, toluen, vinylaxetilen. Số chất tác dụng được với dung dịch brom là? A. 4. B. 5. C. 7. D. 6. Câu 8: Chọn phát biểu sai trong các đáp án sau: A. Trong dung dịch, saccarozo tồn tại chủ yếu ở dạng mạch hở. B. Có thể dùng nước brom để phân biệt saccarozo và glucozo. C. Trong môi trường bazo, glucozo và fructozo có thể chuyển hóa lẫn nhau. D. Trong dung dịch, saccarozo và mantozo đều hòa tan Cu(OH)2 ( ở t0 thường) cho dung dịch màu xanh lam. Câu 9: Khi cho nước tác dụng với oxit axit thì axit sẽ không được tạo thành, nếu oxit axit đó là: A. Đinitơ pentaoxit. B. Cacbon đioxit. C. Silic đioxit. D. Lưu huỳnh đioxit. Câu 10: Sau bài thực hành hóa học, trong một số chất thải ở dạng dung dịch chứa các ion: Cu2+, Zn2+, Fe3+, Pb2+, Hg2+…. Dùng chất nào sau đây để xử lí sơ bộ chất thải trên? A. Etanol. B. Nước vôi trong dư. C. Giấm ăn. D. HNO3. Câu 11: Hãy sắp xếp các ion Cu2+, Hg2+, Fe2+, Pb2+, Ca2+ theo chiều tính oxi hóa tăng dần? A. Hg2+ < Cu2+ < Pb2+ < Cu2+. B. Ca2+ < Fe2+ < Pb2+ < Cu2+ < Hg2+. C. Ca2+ < Fe2+ < Cu2+ < Pb2+ < Hg2+ D. Ca2+ < Fe2+ < Pb2+ < Cu2+. Câu 12: Cho phản ứng hóa học: Mg + CuSO4 → MgSO4 + Cu Quá trình nào dưới đây biểu thị sự oxi hóa của phản ứng trên: A. Mg → Mg2+ + 2e. B. Cu → Cu2+ + 2e C. Cu2+ + 2e → Cu D. Mg2+ + 2e → Mg Câu 13: Phát biểu nào sau đây không đúng khi so sánh tính chất hóa học của sắt và crom? A. Sắt và crom đều phản ứng với clo ở nhiệt độ cao theo cùng tỉ lệ số mol B. Sắt là kim loại có tính khử yếu hơn crom. C. Sắt và crom đều bị thụ động hóa trong các dung dịch axit đặc nguội. D. Sắt và crom đều tan trong dung dịch loãng khi đun nóng của axit HCl và H2SO4 tạo muối sắt (II) và muối crom (II) khi không có không khí. Câu 14: Lượng Br2 và NaOH tương ứng được sử dụng để oxi hóa hoàn toàn 0,01 mol CrO2- thành CrO42- là: A. 0,015 mol và 0,08 mol B. 0,030 mol và 0,04 mol C. 0,030 mol và 0,08 mol D. 0,015 mol và 0,04 mol Câu 15: Cho 0,1 mol FeCl3 tác dụng hết với dung dịch Na2CO3 dư, thu được một chất khí và một kết tủa. Lấy kết tủa nung ở nhiệt độ cao đến khối lượng không đổi thì khối lượng chất rắn thu được là: A. 16 gam B. 12 gam C. 4 gam D. 8 gam. Câu 16: Trong một cốc nước có chứa 0,01 mol Na+ , 0,02 mol Ca2+, 0,01 mol Mg2+, 0,05 mol HCO3, 0,02 mol Cl-, nước trong cốc là: A. Nước mềm. B. Nước cứng toàn phần. C. Nước cứng vĩnh cửu. D. Nước cứng tạm thời. Câu 17: Các chất hiđrocacbon: metan, etilen, axetilen, benzen có tính chất hóa học chung là: A. không có tính chất nào chung trong các đáp án. B. có thể tác dụng với dung dịch KMnO4. C. có thể tác dụng với dd nước brôm D. có thể tác dụng với khí clo ở điểu kiện thường. Câu 18: Phát biểu không đúng là: A. Dung dịch natriphenolat tác dụng với CO2 lấy kết tủa vừa tạo ra cho tác dụng với NaOH lại thu được natriphenolat. B. Phenol tác dụng với NaOH lấy muối tạo ra cho tác dụng với HCl lại thu được phenol. C. Hiđrat hóa but – 2-en thu được butan – 2- ol tách nước từ butan – 2- ol lại thu được sản phẩm chính là but – 2-en. D. Tách nước từ butan- 1- ol thu được anken cho anken hợp nước trong môi trường axit lại thu được sản phẩm chính butan – 1- ol. Câu 19: Cho sơ đồ sau:
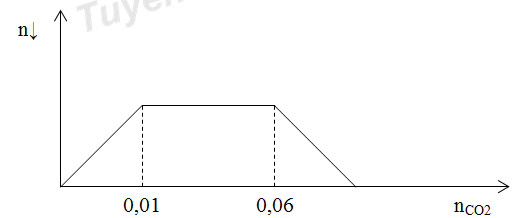
A. polietilen. B. polibutađien. C. poli ( vinyl clorua). D. poliisopren. Câu 20: Vị trí của một số cặp oxi hóa – khử theo chiều tính khử giảm dần từ trái sang phải được sắp xếp như sau: Fe2+/ Fe, Cu2+ / Cu, Fe3+/Fe2+, Ag+/ Ag, Cl2/Cl- Trong các chất sau: Cu, AgNO3, Cl2. Chất nào tác dụng với dung dịch Fe(NO3)2. A. AgNO3. B. AgNO3, Cl2. C. Cả 3 chất. D. Cl2. Câu 21: Trong phòng thí nghiệm để bảo quản dung dịch muối FeSO4 người ta thường: A. Cho vào đó vài giọt dung dịch H2SO4 loãng. B. Cho vào đó một vài giọt dung dịch HCl. C. Ngâm vào đó một đinh sắt. D. Mở nắp lọ đựng dung dịch. Câu 22: Kim loại có tính khử mạnh nhất, trong số các đáp án sau: A. Na. B. Li. C. K. D. Cs. Câu 23: Cho khí CO (dư) đi qua ống sứ đựng hỗn hợp X gồm: Al2O3, MgO, Fe3O4, CuO nung nóng thu được hỗn hợp rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm: A. Một hợp chất và hai đơn chất. B. Hai hợp chất và hai đơn chất. C. Ba hợp chất và một đơn chất. D. Ba đơn chất. Câu 24: Benzyl axetat là một este có trong mùi thơm của hoa nhài. Công thức của benzyl axetat là A. C6H5-CH2-COO-CH3. B. CH3-COO-CH2-C6H5. C. CH3-COO-C6H5. D. C6H5-COO-CH3. Câu 25: Cho một số tính chất: là chất kết tinh không màu (1); có vị ngọt (2); tan trong nước (3); hòa tan Cu(OH)2 (4); làm mất màu nước brom (5); tham gia phản ứng tráng bạc (6); bị thủy phân trong môi trường kiềm loãng nóng (7). Số các tính chất của saccarozo là A. 3. B. 6. C. 4. D. 5. Câu 26: Hòa tan hoàn toàn V lít khí CO2 (đktc) vào 500 ml dung dịch hỗn hợp gồm NaOH aM và Ba(OH)2 bM. Quan sát lượng kết tủa qua đồ thị sau:
Giá trị của a : b là: A. 2,0. B. 1,5. C. 5,0. D. 4,0. Câu 27: Axit cacboxylic X hai chức (có % khối lượng O nhỏ hơn 70%), Y và Z là 2 ancol đồng đẳng kế tiếp (MY<MZ). Đốt cháy hoàn toàn 0,2 mol hỗn hợp gồm X, Y và Z cần vừa đủ 8,96 lít O2 (đktc) thu được 7,84 lít CO2 và 8,1 gam H2O. Nếu đem đun nóng hỗn hợp trên với H2SO4 đặc (H = 100% và tốc độ phản ứng của hai ancol như nhau) thì tổng khối lượng este thu được gần nhất với đáp án nào sau đây? A. 7,05 gam B. 7,92 gam C. 10,20 gam D. 9,66 gam Câu 28: X là một sản phẩm của phản ứng este hóa giữa glixerol với hai axit: axit panmitic và axit stearic. Hóa hơi 59,6 gam este X thu được một thể tích đúng bằng thể tích của 2,8 gam khí nitơ ở cùng điều kiện. Tổng số nguyên tử cacbon trong một phân tử X là? A. 35. B. 54. C. 37. D. 52. Câu 29: Một hỗn hợp X gồm Fe và Zn khi tác dụng với dung dịch NaOH dư cho ra 3,136 lít khí (đktc) và để lại một chất rắn A. Hòa tan hết A trong dung dịch H2SO4 loãng, sau đó thêm NaOH dư được kết tủa B. Nung B ngoài không khí đến khối lượng không đổi được chất rắn nặng 12,8 gam. Tính khối lượng của hỗn hợp X? A. 16,18 gam. B. 17,26 gam. C. 18,24 gam. D. 18,06 gam. Câu 30: Cho 86,3 gam hỗn hợp X gồm Na, K, Ba và Al2O3 (trong đó oxi chiếm 19,47% về khối lượng) tan hết vào nước, thu được dung dịch Y và 13,44 lít khí H2 (đktc). Cho 3,2 lít dung dịch HCl 0,75M vào dung dịch Y. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. Giá trị của m là? A. 10,4. B. 23,4. C. 54,5. D. 27,3. Câu 31: Điện phân nóng chảy hỗn hợp Al2O3 và Na3AlF6 (criolit) với anot làm bằng than chì và catot làm bằng thép. Sau một thời gian tại catot sinh ra 8,1 kg Al và tại anot thấy thoát ra V m3 hỗn hợp khí (đo ở 819oC và áp suất 1 atm) gồm CO2 60%, CO 20% và O2 20% (theo thể tích). Giá trị của V tương ứng là? A. ≈33,6 m3. B. ≈22,4 m3. C. ≈56,0 m3. D. ≈44,8 m3. Câu 32: A là tripeptit Ala-Glu-X và B là pentapeptit Gly-Ala-X-Lys-Glu (X là α-aminoaxit chỉ chứa 1 nhóm –NH2 và 1 nhóm –COOH). Đun nóng 0,2 mol hỗn hợp E chứa A, B cần dùng 450 ml dung dịch NaOH 2M thu được 95,85 gam hỗn hợp muối. Công thức cấu tạo của X là? A. CH3-CH2-CH(NH2)-COOH. B. NH2-CH2-CH2-COOH. C. CH3-CH(NH2)-CH2-COOH. D. CH3-CH(NH2)COOH. Câu 33: Điện phân với điện cực trơ dung dịch chứa 0,4 mol AgNO3 với cường độ dòng điện 4,32A, trong thời gian t giây thu được dung dịch X (hiệu suất quá trình điện phân là 100%). Cho 12,64 gam bột Fe vào X thấy thoát ra khí NO (sản phẩm khử duy nhất) và sau khi các phản ứng xảy ra hoàn toàn thu được 20,4 gam chất rắn. Giá trị của t là? A. 8935,2 giây. B. 5361,1 giây. C. 3574,07 giây. D. 2685 giây. Câu 34: Cho các phát biểu sau: - Chất béo được gọi chung là triglixerit hay triaxylglixerol; - Chất béo nhẹ hơn nước, không tan trong nước nhưng tan nhiều trong các dung môi hữu cơ; - Phản ứng thủy phân chất béo trong môi trường axit là phản ứng thuận nghịch; - Tristearin, triolein có công thức lần lượt là (C17H33COO)3C3H5, (C17H35COO)3C3H5; - Triolein có khả năng tham gia phản ứng cộng hiđro khi đun nóng có xúc tác Ni; - Chất béo bị thủy phân khi đun nóng trong dung dịch kiềm. Số phát biểu đúng là? A. 4. B. 3. C. 5. D. 6. Câu 35: Cho m gam hỗn hợp X gồm Fe, Fe3O4 và Fe(NO3)2 tan hết trong 320 ml dung dịch KHSO4 1M. Sau phản ứng, thu được dung dịch Y chứa 59,04 gam muối trung hòa và 896 ml NO (sản phẩm khử duy nhất của N+5, ở đktc). Y phản ứng vừa đủ với 0,44 mol NaOH. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Fe(NO3)2 trong X có giá trị gần nhất với giá trị nào sau đây? A. 63. B. 18. C. 73. D. 20. Câu 36: Trong các khẳng định sau số phát biểu nào dưới đây không chính xác? 1. Protein phản ứng với Cu(OH)2, tạo ra sản phẩm có màu tím đặc trưng. 2. Protein phản ứng với HNO3 đặc, tạo kết tủa màu vàng. 3. Khi đun nóng dung dịch protein, protein đông tụ. 4. Các protein đều tan trong nước. 5. Cấu trúc bậc I của protein được giữ vững nhờ liên kết peptit. A. 1. B. 2. C. 4. D. 3. Câu 37: Thực hiện các thí nghiệm sau: - Tráng một lớp Zn mỏng lên tấm thép. - Tráng một lớp Sn mỏng lên tấm thép. - Gắn một miếng Cu lên bề mặt tấm thép. - Gắn một miếng Al lên bề mặt tấm thép. - Phủ một lớp sơn lên bề mặt tấm thép. Số trường hợp tấm thép được bảo vệ? A. 4. B. 5. C. 3. D. 2. Câu 38: Dung dịch Z gồm Na2CO3 0,4M, KHCO3 xM. Thêm từ từ 0,5 lít dung dịch Z vào 500 ml dung dịch HCl 1M sau phản ứng hoàn toàn thu được khí và dung dịch Y. Cho dung dịch Ba(OH)2 dư vào dung dịch Y sau phản ứng hoàn toàn thu được 78,8 gam kết tủa. Giá trị x là? A. 1,6. B. 2. C. 0,8. D. 1,2. Câu 39: Hỗn hợp X gồm HCOOH và CH3COOH (tỉ lệ mol 1:1); hỗn hợp Y gồm CH3OH và C2H5OH (tỉ lệ mol 3:2). Lấy 11,13 gam hỗn hợp X tác dụng với 7,52 gam hỗn hợp Y có xúc tác H2SO4 đặc, đun nóng. Khối lượng của este thu được là (biết hiệu suất các phản ứng este đều 75%) A. 14,52 gam B. 10,89 gam C. 11,616 gam D. 11,4345 gam Câu 40: Thực hiện các thí nghiệm sau: - Đun nóng hỗn hợp bột Fe và I2. - Cho Fe vào dung dịch HCl. - Cho Fe(OH)2 vào dung dịch HNO3 loãng, dư. - Đốt dây sắt trong khí clo dư. - Cho Fe3O4 vào dung dịch H2SO4 loãng, dư. Số thí nghiệm tạo ra muối sắt (II) là A. 4. B. 1. C. 2. D. 3. Lời giải chi tiết
Xem thêm: Lời giải chi tiết Đề thi thử THPT Quốc gia môn Hóa học tại Tuyensinh247.com Loigiaihay.com
|














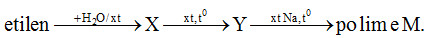






Danh sách bình luận