Đề kiểm tra 45 phút - Đề số 1 - Chương 5 - Hóa học 12Đáp án và lời giải chi tiết đề thi kiểm tra 45 phút - Đề số 1 - Chương 1 - Hóa học 12 Quảng cáo
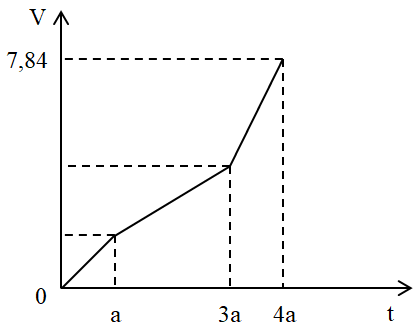
Đề bài Câu 1: Phát biểu nào sau đây là đúng? A. Ở điều kiện thường, các kim loại đều có khối lượng riêng lớn hơn khối lượng riêng của nước. B. Tính chất hóa học đặc trưng của kim loại là tính khử. C. Các kim loại đều chỉ có một số oxi hoá duy nhất trong các hợp chất. D. Ở điều kiện thường, tất cả các kim loại đều ở trạng thái rắn. Câu 2: M là kim loại trong số các kim loại sau: Cu Ba, Zn, Mg. Dung dịch muối MCl2 phản ứng với dung dịch Na2CO3 hoặc Na2SO4 tạo kết tủa, nhưng không tạo kết tủa khi phản ứng với dung dịch NaOH. Kim loại M là A. Mg. B. Cu. C. Ba. D. Zn. Câu 3: Kim loại được dùng phổ biến để tạo trang sức, có tác dụng bảo vệ sức khỏe là : A. Đồng. B. Bạc. C. Sắt. D. Sắt tây. Câu 4: Một cation kim loại M có cấu hình e ở lớp ngoài cùng là 2s22p6. Vậy cấu hình e ở lớp ngoài cùng của nguyên tử kim loại M là : A. 3s2. B. 3s23p1. C. 3s1. D. Cả A, B, C đều đúng. Câu 5: Hòa tan hoàn toàn 1,9 gam hỗn hợp gồm Fe, Mg và Al bằng dung dịch H2SO4 loãng vừa đủ, thu được 1,344 lít H2 (đktc). Khối lượng muối khan thu được khi cô cạn dung dịch sau phản ứng là A. 7,66 gam. B. 7,78 gam. C. 8,25 gam. D. 7,72 gam. Câu 6: Cho m (gam) hỗn hợp Al, Mg tác dụng với dung dịch HCl dư thu được 12,32 lít khí (đktc). Mặt khác, cũng m (gam) hỗn hợp trên cho tác dụng với dung dịch NaOH dư thu được 6,72 lít khí (đktc). Tính giá trị của m? A. 28,2 gam. B. 22,8 gam. C. 14,1 gam. D. 11,4 gam. Câu 7: Dung dịch Fe2(SO4)3 tác dụng với lượng dư kim loại nào tạo dung dịch chứa hai muối? A. Fe B. Zn C. Cu D. Ag Câu 8: Thực nghiệm cho thấy Cu tác dụng được với dung dịch FeCl3 theo phương trình hoá học: Cu + 2 FeCl3 → 2FeCl2 + CuCl2. Như vậy, A. ion Fe3+ có tính khử mạnh hơn ion Fe2+. B. ion Fe3+ có tính oxi hoá yếu hơn ion Cu2+. C. ion Fe2+ có tính oxi hoá mạnh hơn ion Fe3+. D. ion Fe3+ có tính oxi hoá mạnh hơn ion Cu2+. Câu 9: Cho các phát biểu sau : (1) Các kim loại kiềm đều tan tốt trong nước. (2) Các kim loại Mg, Fe, K và Al chỉ điều chế được bằng phương pháp điện phân nóng chảy. (3) Các kim loại Mg, K và Fe đều khử được ion Ag+ trong dung dịch thành Ag. (4) Khi cho Al vào dung dịch FeCl3 dư thu được kim loại Fe. Số phát biểu đúng là A. 4 B. 3 C. 2 D. 1 Câu 10: Cho 4 kim loại Al, Fe, Mg, Cu và 4 dung dịch ZnSO4, AgNO3, CuCl2, Al2(SO4)3. Kim loại khử được cả 4 dung dịch muối đã cho là A. Fe. B. Mg. C. Al. D. Cu. Câu 11: Phản ứng nào dưới đây không xảy ra : A. Ni + Fe2+ → Ni2+ + Fe. B. Mg + Cu2+ → Mg2+ + Cu. C. Pb + 2Ag+ → Pb2+ + 2Ag. D. Fe + Pb2+ → Fe2+ + Pb. Câu 12: Trong pin điện hóa Cu-Ag tại điện cực đồng xảy ra quá trình: A. Oxi hóa H2O. B. Khử Cu2+ C. Khử H2O D. Oxi hóa Cu Câu 13: Dãy nào dưới đây gồm các kim loại sắp xếp theo chiều tăng dần tính oxi hóa ? A. Na+ < Mn2+ < Al3+ < Fe3+ < Cu2+. B. Na+ < Al3+ < Mn2+ < Cu2+ < Fe3+. C. Na+ < Al3+ <Mn2+ < Fe3+ < Cu2+. D. Na+ < Al3+ < Fe3+ < Mn2+ < Cu2+. Câu 14: Phát biểu nào sau đây là sai? A. Trong quá trình điện phân dung dịch, khối lượng dung dịch luôn giảm. B. Trong quá trình điện phân dung dịch, ở catot luôn xảy ra quá trình khử. C. Trong quá trình điện phân dung dịch NaCl (có màng ngăn), pH của dung dịch tăng. D. Trong quá trình điện phân dung dịch, catot luôn thu được kim loại. Câu 15: Có các bán phản ứng sau: (1) Cu2+(dd) + 2e → Cu(r) (2) Cu(r) → Cu2+(dd) + 2e (3) 2H2O + 2e → H2 + 2OH-(dd) (4) 2H2O→ O2 + 4H+ + 4e (5) 2Br-(dd) → Br2(dd) + 2e (6) 2H+(dd) + 2e →H2 Những bán phản ứng xảy ra ở catot trong quá trình điện phân là A. (2), (4), (6). B. (1), (3), (6). C. (2), (4), (5). D. (2), (3), (5). Câu 16: Cho dung dịch chứa các ion: Na+, Al3+, Cu2+, Cl-, SO42-, NO3- . Các ion không bị điện phân khi ở trạng thái dung dịch là: A. Na+, Al3+ , SO42-, NO3- . B. Na+, SO42-, Cl-, Al3+. C. Na+, Al3, Cl-, NO3-. D. Al3+ , Cu2+, Cl-, NO3-. Câu 17: Điện phân dung dịch gồm a mol CuSO4 và 2a mol NaCl sau khi ở catot bắt đầu thoát khí thì dừng lại. Chất tan trong dung dịch thu được sau điện phân là A. CuSO4;Na2SO4. B. CuSO4; NaCl. C. Na2SO4. D. H2SO4; Na2SO4. Câu 18: Thí nghiệm nào sau đây chỉ xảy ra ăn mòn hóa học? A. Nhúng thanh Zn vào dung dịch CuSO4. B. Đốt dây thép (hợp kim sắt-cacbon) trong bình khí oxi. C. Nhúng thanh Fe vào dung dịch H2SO4 loãng (có nhỏ thêm vài giọt dung dịch CuSO4). D. Để đinh sắt (làm bằng thép cacbon) trong không khí ẩm Câu 19: Để chống ăn mòn cho đường ống dẫn dầu bằng thép chôn dưới đất, người ta dùng phương pháp điện hoá. Trong thực tế, người ta dùng kim loại nào sau đây làm điện cực hi sinh ? A. Zn B. Sn C. Cu D. Na Câu 20: Cho các thí nghiệm sau : - TN1: Cho thanh Fe vào dung dịch FeCl3 - TN2: Cho thanh Fe vào dung dịch CuSO4 - TN3: Cho thanh Cu vào dung dịch FeCl3 - TN4: Cho thanh Fe tiếp xúc với thanh Cu rồi cho vào dung dịch HCl. Số trường hợp xuất hiện ăn mòn điện hoá là A. 1 B. 2 C. 4 D. 3 Câu 21: Dãy gồm các kim loại đều có thể điều chế được bằng phương pháp nhiệt luyện là A. Fe, Cu, Pb. B. Fe, Cu, Ba. C. Na, Fe, Cu. D. Ca, Al, Fe. Câu 22: Hỗn hợp bột X gồm BaCO3, Fe(OH)2, Al(OH)3, CuO, MgCO3. Nung X trong không khí đến khối lượng không đối được hỗn hợp rắn A. Cho A vào nước dư khuấy đều được dung dịch B chứa 2 chất tan và phần không tan C. Cho khí CO dư qua bình chứa C nung nóng được hỗn hợp rắn E (Cho các phản ứng xảy ra hoàn toàn). E chứa tối đa: A. 1 đơn chất và 2 hợp chất. B. 3 đơn chất. C. 2 đơn chất và 2 hợp chất. D. 2 đơn chất và 1 hợp chất. Câu 23: Cho 29 gam hỗn hợp gồm Al, Cu và Ag tác dụng vừa đủ với 950 ml dung dịch HNO3 1,5M, thu được dung dịch chứa m gam muối và 5,6 lít hỗn hợp khí X (đktc) gồm NO và N2O. Tỉ khối của X so với H2 là 16,4. Giá trị của m là A. 98,20. B. 97,20. C. 98,75. D. 91,00. Câu 24: Hòa tan hoàn toàn 11,90 gam hỗn hợp 3 kim loại X, Y, Z bằng dung dịch H2SO4 đặc, nóng thu được 7,616 lít khí SO2 (đktc), 0,640 gam S và dung dịch T. Cô cạn dung dịch T thu được m gam muối khan. Giá trị của m A. 50,30. B. 30,50. C. 88,70. D. 46,46. Câu 25: Cho 51,75 gam bột kim loại M hóa trị II vào 200 ml dung dịch CuCl2 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được 51,55 gam hỗn hợp kim loại. Kim loại M là A. Fe B. Mg C. Zn D. Pb Câu 26: Cho m gam bột Cu vào 200ml dung dịch AgNO3 0,2M sau một thời gian thu được 3,12 gam chất rắn X và dd Y. Cho 1,95g bột Zn vào dd Y đến phản ứng hoàn toàn thu được 3,45g chất rắn Z và dd chỉ chứa 1 muối duy nhất. Giá trị của m là: A. 0,64. B. 1,28. C. 1,92. D. 1,6. Câu 27: Điện phân 200 ml dung dịch KOH 2M (D = 1,1 g/cm3) với điện cực trơ. Khi ở catot thoát ra 2,24 lít khí (đktc) thì ngừng điện phân. Biết rằng nước bay hơi không đáng kể. Dung dịch sau điện phân có nồng độ phần trăm là A. 10,27%. B. 10,18%. C. 10,9%. D. 38,09%. Câu 28: Sau một thời gian điện phân 200 ml dung dịch CuCl2 người ta thu được 1,12 lít khí (đktc) ở anot. Ngâm đinh sắt sạch trong dung dịch còn lại sau khi điện phân. Phản ứng xong, nhận thấy khối lượng đinh sắt tăng thêm 1,2 gam. Nồng độ mol ban đầu của dung dịch CuCl2 là A. 1M B. 1,5M C. 1,2M D. 2M Câu 29: Điện phân dung dịch X chứa Cu(NO3)2 và NaCl với điện cực trơ. Tổng thể tích khí thoát ra ở cả 2 điện cực (V lít) phụ thuộc vào thời gian điện phân (t giây) theo đồ thị bên. Nếu điện phân X trong thời gian 3,5a giây thì thu được dung dịch có khối lượng giảm m gam so với dung dịch X. Giả thiết các chất điện phân ra không tan trong dung dịch. Giá trị của m là: A. 31,1 B. 29,5 C. 31,3 D. 30,4 Câu 30: Hòa tan hoàn toàn m gam hỗn hợp X gồm Mg, Al, Zn trong 500 ml dung dịch HNO3 4M, sau phản ứng hoàn toàn thu được dung dịch Y và 4,48 lít (đktc) hỗn hợp gồm hai khí không màu có tỉ khối so với H2 là 18,5 trong đó có 1 khí hóa nâu ngoài không khí. Trung hòa dung dịch Y bằng lượng vừa đủ 100 ml dung dịch NaOH 1M, thu được dung dịch Z. Cô cạn Z, thu được 134,5 gam muối khan. Giá trị của m là A. 30,0. B. 29,4. C. 30,6. D. 29,0. Lời giải chi tiết ĐÁP ÁN:
Câu 1: Đáp án A: Sai vì một số kim loại có khối lượng riêng nhẹ hơn nước (Li, Na, K,...) Đáp án C: Sai vì một số kim loại có nhiều số oxi hóa trong hợp chất (Fe, Cr, Cu,...) Đáp án D: Sai vì ở điều kiện thường, Hg tồn tại ở thể lỏng Đáp án B Câu 2: Dung dịch muối MCl2 phản ứng với dung dịch Na2CO3 hoặc Na2SO4 tạo kết tủa, nhưng không tạo kết tủa khi phản ứng với dung dịch NaOH => Kim loại là Ba BaCl2 + Na2CO3 → BaCO3 ↓ + 2NaCl BaCl2 + Na2SO4 → BaSO4 + 2NaCl BaCl2 + NaOH không xảy ra Đáp án C Câu 3: Kim loại dùng để tạo trang sức, có tác dụng bảo vệ sức khỏe là bạc Đáp án B Câu 4: Cấu hình electron của kim loại có thể có 1, 2 hoặc 3 electron lớp ngoài cùng => các trường hợp thỏa mãn là 1s22s22p63s1 1s22s22p63s2 1s22s22p63s23p1 Đáp án D Câu 5: Sơ đồ: KL + H2SO4 → Muối + H2 Bảo toàn H → nH2SO4 = nH2 = 1,344/22,4 = 0,06 mol Bảo toàn khối lượng → mmuối = mKL + mH2SO4 - mH2 = 1,9 + 0,06.98 - 0,06.2 = 7,66 gam Đáp án A Câu 6: - Khi cho hỗn hợp trên tác dụng với NaOH dư thì chỉ có Al phản ứng: Ta có: \({n_{{H_2}}} = \frac{{6,72}}{{22,4}} = 0,3\left( {mol} \right)\) → nAl = 0,2 mol => mAl = 0,2 * 27 = 5,4 (gam) - Khi cho hỗn hợp trên tác dụng với HCl thì có Al và Mg đều phản ứng: Ta có: \({n_{{H_2}}} = \frac{{12,32}}{{22,4}} = 0,55\left( {mol} \right)\) PTHH: Mg + 2HCl → MgCl2 + H2 0,25 ← 0,55 - 0,3 = 0,25 (mol) → mMg = 0,25. 24 = 6 (g) Vậy m = mAl + mMg = 5,4 + 6 = 11,4 (g) Đáp án D Câu 7: Đáp án A: Fe dư + Fe2(SO4)3 → FeSO4 Đáp án B: Zn dư + Fe2(SO4)3 → ZnSO4 + Fe Đáp án C: Cu dư + Fe2(SO4)3 → FeSO4 + CuSO4 Đáp án D: Không phản ứng Đáp án C Câu 8: Dựa vào quy tắc α: Phản ứng giữa 2 cặp oxi hóa khử xảy ra theo chiều: chất oxi hóa mạnh tác dụng với chất khử mạnh tạo thành chất oxi hóa yếu hơn và chất khử yếu hơn. Ta có: Cu + 2 Fe3+ → 2Fe2+ + Cu2+ C.KH mạnh C.OXH mạnh C.KH yếu C.OXH yếu Vậy ion Fe3+ có tính oxi hoá mạnh hơn ion Cu2+ Đáp án D Câu 9: (1) đúng (2) sai vì Fe có thể điều chế bằng điện phân dung dịch (3) sai K không khử được Ag+ trong dung dịch vì 2K + 2H2O → 2KOH + H2 2OH- + 2Ag+ → Ag2O + H2O (4) sai vì FeCl3 dư : Al + 3FeCl3 → AlCl3 + 3FeCl2 Đáp án D Câu 10: Mg là kim loại mạnh hơn những kim loại trong muối → Mg khử được cả 4 dung dịch muối Phương trình phản ứng Mg + ZnSO4 → MgSO4 + Zn Mg + 2AgNO3 → Mg(NO3)2 + 2Ag Mg + CuCl2 → MgCl2 + Cu 3Mg + Al2(SO4)3 → 3MgSO4 + 2Al Đáp án B Câu 11: Vì tính khử của kim loại Fe mạnh hơn Ni → ta có phương trình : Fe + Ni2+ → Fe2+ + Ni Đáp án A Câu 12: Quá trình hoạt động của pin Cu-Ag : Cu → Cu2+ + 2e (sự oxi hóa) Ag+ + 1e → Ag (sự khử) Đáp án D Câu 13: Theo dãy điện hóa, sắp xếp tính oxi hóa tăng dần : Na+ < Al3+ < Mn2+ < Cu2+ < Fe3+ Đáp án B Câu 14: Đáp án D sai, do một số dung dịch có chứa ion không điện phân được trong dung dịch như: NaCl, K2SO4, MgCl2,... (ion kim loại đứng trước Zn trong dãy hoạt động hóa học) thì khi đó catot sẽ không xuất hiện kim loại mà là khí H2 (nước bị điện phân) Đáp án D Câu 15: Những bán phản ứng xảy ra ở catot trong quá trình điện phân là điện phân cation và nước (1) Cu2+(dd) + 2e →Cu(r) (3) 2H2O + 2e → H2 + 2OH-(dd) (6) 2H+(dd) + 2e →H2 Đáp án B Câu 16: Các ion không bị điện phân khi ở trạng thái dung dịch là: Na+, Al3+ , SO42-, NO3- Đáp án A Câu 17: (1) 2NaCl + CuSO4 → Cu +Cl2 + Na2SO4 Ở (1) NaCl phản ứng vừa đủ với CuSO4 => Dung dịch sau điện phân chỉ có Na2SO4 Đáp án C Câu 18: - A sai vì có phản ứng: Zn + CuSO4 → ZnSO4 + Cu Cu sinh ra bám vào Zn và cùng tiếp xúc với dung dịch điện li nên xảy ra ăn mòn điện hóa. - B đúng vì Fe và C tiếp xúc với nhau nhưng môi trường khí O2 không phải là môi trường chất điện li nên chỉ xảy ra ăn mòn hóa học. - C sai vì có phản ứng: Fe + CuSO4 → FeSO4 + Cu Cu sinh ra bám vào Fe và cùng tiếp xúc với dung dịch điện li nên xảy ra ăn mòn điện hóa. - D sai vì Fe và C tiếp xúc trực tiếp và cùng được đặt trong môi trường chất điện li (không khí ẩm) nên xảy ra ăn mòn điện hóa. Đáp án B Câu 19: Thực tế người ta dùng Zn phải dùng kim loại hoạt động mạnh hơn để hi sinh bên ngoài, bảo vệ kim loại Fe bên trong Đáp án A Câu 20: TN1 : Fe + 2FeCl3 → 3FeCl2 → ăn mòn hóa học vì không hình thành 2 điện cực mới TN2 : Fe + CuSO4 : ăn mòn điện hóa vì hình thành 2 điện cực Fe và Cu. Hai điện cực tiếp xúc với nhau và tiếp xúc với dung dịch điện li \(F{{e}^{2+}},\,\,C{{u}^{2+}}\) TN3 : Cu + FeCl3 : ăn mòn hóa học vì không hình thành 2 điện cực mới TN4: Ăn mòn điện hóa vì có 2 kim loại tiếp xúc với nhau và cùng tiếp xúc với dung dịch chất điện li. Fe là cực (-), Cu là cực (+) Tại cực (-) : \(Fe\to F{{e}^{2+}}+2e\) Tại cực (+) : \(2{{H}^{+}}+2e\to {{H}_{2}}\) → có 2 trường hợp xuất hiện ăn mòn điện hóa Đáp án B Câu 21: Phương pháp nhiệt luyện (dùng kim loại mạnh để đẩy kim loại yếu ra khỏi dung dịch muối) => dùng để điều chế các kim loại từ Mg trở về sau trong dãy điện hóa A. thỏa mãn B. loại Ba C. Loại Na. D. Loại Ca Đáp án A Câu 22: \(\left\{ \begin{gathered} BaC{{\text{O}}_3} \hfill \\ Fe{(OH)_2} \hfill \\ Al{(OH)_3} \hfill \\ CuO \hfill \\ MgC{O_3} \hfill \\ \end{gathered} \right.\xrightarrow{{{t^o}}}\left\{ \begin{gathered} Ba{\text{O}} \hfill \\ F{e_2}{O_3} \hfill \\ A{l_2}{O_3} \hfill \\ CuO \hfill \\ MgO \hfill \\ \end{gathered} \right.\xrightarrow{{ + {H_2}O}}ddB\left\{ \begin{gathered} Ba{(OH)_2} \hfill \\ Ba{(Al{O_2})_2} \hfill \\ \end{gathered} \right. + \downarrow C\left\{ \begin{gathered} F{e_2}{O_3} \hfill \\ CuO \hfill \\ MgO \hfill \\ \end{gathered} \right.\xrightarrow{{ + CO}}E\left\{ \begin{gathered} Fe \hfill \\ Cu \hfill \\ MgO \hfill \\ \end{gathered} \right.\) => E chứa tối đa 2 đơn chất và 1 hợp chất Đáp án D Câu 23: Đặt nNO = amol; nNO2 = b mol => a + b = 0,25 mol (1) ${{\bar{M}}_{X}}=\frac{30a+44b}{a+b}=16,4.2$ (2) Từ (1) và (2) => a = 0,2 mol; b = 0,05 mol Nếu sản phẩm khử chỉ có NO và N2O thì nHNO3 phản ứng = 4nNO + 10nN2O = 1,3 mol Mà theo đầu bài nHNO3 phản ứng = 0,95.1,5 = 1,425 mol > 1,3 mol => trong dung dịch có sản phẩm khử là NH4NO3 (x mol) => nHNO3 phản ứng = 4nNO + 10nN2O + 10nNH4NO3 => 1,425 = 1,3 + 10x => x = 0,0125 mol Bảo toàn e: nNO3 = ne cho = ne nhận = 3nNO + 8nN2O + 8nNH4NO3 = 1,1 mol mmuối = mkim loại + mgốc NO3 + mNH4NO3 = 29 + 1,1.62 + 0,0125.80 = 98,2 gam Đáp án A Câu 24: nSO2 = 0,34 mol; nS = 0,02 mol Ta có : ne nhận = ne cho = 0,34.2 + 0,02.6 = 0,8 mol \({{n}_{SO_{4}^{2-}}}=\dfrac{{{n}_{e\,\,cho}}}{2}=\text{ }0,4\text{ }mol\) => mmuối = mkim loại + mSO4 = 11,9 + 0,4.96 = 50,3 gam Đáp án A Câu 25: nCuCl2 = 0,2.1 = 0,2 (mol) Phản ứng xảy ra hoàn toàn, sau phản ứng thu được hỗn hợp kim loại nên Cu phản ứng hết, M phản ứng dư. M + Cu2+ → M2+ + Cu↓ 0,2 ←0,2 → 0,2 (mol) Khối lượng kim loại giảm = mM pư - mCu sinh ra => 51,75 - 51,55 = 0,2.M - 0,2.64 => M = 65 (Zn) Đáp án C Câu 26: Vì thu được 1 muối duy nhất => dung dịch sau phản ứng chỉ chứa Zn(NO3)2 Do số mol điện tích âm được bảo toàn dù quá trình phản ứng diễn ra nhiều giai đoạn trung gian nên ta có: \({{n}_{Zn\text{ }phản\text{ }ứng}}={{n}_{Z{{n}^{2+}}}}=0,5.{{n}_{A{{g}^{+}}}}\) Bảo toàn khối lượng kim loại: \({{m}_{C{{u}^{2+}}}}+\text{ }{{m}_{A{{g}^{+}}}}+\text{ }{{m}_{Zn\text{ }bd}}=\text{ }{{m}_{X}}+\text{ }{{m}_{Z}}+\text{ }{{m}_{Zn\text{ }phản\text{ }ứng}}\) => m + 0,2.0,2.108 + 1,95 = 3,12 + 3,45 + 65.0,02 => m = 1,6 gam Đáp án D Câu 27: \({n_{{H_2}}} = 0,1mol\) Ở catot: 2H2O + 2e → 2OH- + H2 0,2 0,2 ← 0,1 Ở anot: 4OH- → O2 + 4e + 2H2O 0,2 0,05 ← 0,2 Ta thấy lượng OH- không đổi m dd ban đầu = 200.1,1 = 220 gam \({m_{dd\:sau}} = {m_{dd\:bd}} - {m_{{H_2}}} - {m_{{O_2}}} = 220 - 0,2 - 1,6 = 218,2(g)\) \(C\% = \frac{{{m_{KOH}}}}{{{m_{dd}}}}.100\% = \frac{{22,4}}{{218,2}}.100\% = 10,27\% \) Đáp án A Câu 28: Phương trình điện phân : CuCl2 → Cu + Cl2 0,05 ← 0,05 Gọi nCuCl2 dư = a mol CuCl2 + Fe → FeCl2 + Cu a a a => 64a – 56a = 1,2 => a = 0,15 => nCuCl2 = a + 0,05 = 0,15 + 0,05 = 0,2 mol => CM CuCl2 = 0,2 / 0,2 = 1M Đáp án A Câu 29: Đoạn 1: Chỉ có khí Cl2 thoát ra. Đặt VCl2 = x (lít) Đoạn 2: Chỉ có khí O2 thoát ra. (do khí thoát ra nó thoải hơn so với đoạn 3) Mà ta thấy giá trị V lúc này gấp đôi đoạn tại thời điểm t = a (giây) Do đó VO2 = 2x - x = x (lít) Đoạn 3: Anot có O2 tiếp tục thoát ra. Còn ở catot có H2 thoát ra. Trong đoạn 3 này thời gian bằng nửa đoạn 2 nên VO2 = 0,5x (lít) Bảo toàn electron ta tính được VH2 = x (lít) Tổng cộng 3 đoạn thì khí thoát ra gồm Cl2 (x lít), O2 (1,5x lít) và H2 (x lít) Suy ra x + 1,5x + x = 7,84 → x = 2,24 lít Ban đầu: nNaCl =2.nCl2 = 0,2 mol Ta có: nCu(NO3)2 = nCu = nCl2 + 2.nO2 (đoạn 2) = 0,3 mol Tại thời điểm t = a (giây): ne trao đổi = 2nCl2 = 2.2,24 : 22,4 = 0,2 mol Tại thời điểm 3,5a (giây) (thuộc đoạn 3) ta có: ne trao đổi = 3,5. 0,2 = 0,7 mol Catot: Cu2+ + 2e → Cu 0,3 → 0,6 0,3 mol H2O + 2e → H2 + 2OH- 0,1 → 0,05 mol Anot: 2Cl- -2e → Cl2 0,2 0,2 0,1 mol 2H2O - 4e → O2 + 4H+ 0,5 0,125 mol Khi đó thu được 0,3 mol Cu ; 0,05 mol H2 ở catot và 0,1 mol Cl2 và 0,125 mol O2 ở anot. Khối lượng dung dịch giảm chính là khối lượng các chất thoát ra ở các điện cực. Do đó m = mCu + mH2 + mCl2 + mO2 = 0,3.64 + 0,05.2 + 0,1.71 + 0,125.32 = 30,4 (gam) Đáp án D Câu 30: M khí = 37 Khí hóa nâu ngoài không khí là NO (M = 30) => Khí còn lại có M > 37 Vì khí không màu nên khí đó là N2O Giả sử khí gồm NO (x mol) và N2O (y mol) Giải hệ: n khí = x + y = 0,2 và m khí = 30x + 44y = 0,2.27 được x = y = 0,1 Trung hòa dd Y cần vừa đủ 0,1 mol NaOH nên ta có nHNO3 = nNaOH = 0,1 mol Sơ đồ bài toán: \(m(g)\left\{ \matrix{ + Xét phản ứng của dd Y với NaOH: m ion dd Y = m muối + mH2O - mNaOH = 134,5 + 0,1.18 - 0,1.40 = 132,3 (g) + Ta có công thức: nHNO3 = nHNO3 dư + 4nNO + 10nN2O + 10nNH4NO3 => 2 = 0,1 + 4.0,1 + 10.0,1 + 10nNH4NO3 => nNH4NO3 = 0,05 mol + BTNT "N": nHNO3 = nNH4+ + nNO3- + nNO + 2nN2O => 2 = 0,05 + nNO3- (dd Y) + 0,1 + 2.0,1 => nNO3 (dd Y) = 1,65 mol Ta có: m = mKL = m ion KL = m ion dd Y - mNH4+ - mH+ - mNO3- = 132,3 - 0,05.18 - 0,1 - 1,65.62 = 29 gam Đáp án D Loigiaihay.com
|




















Danh sách bình luận