Đề kiểm tra 45 phút (1 tiết ) - Đề số 1 – Chương 8 – Hóa học 12Đáp án và lời giải chi tiết đề thi kiểm tra 45 phút (1 tiết ) - Đề số 1 – Chương 8 – Hóa học 12 Quảng cáo
Đề bài I. PHẦN TRẮC NGHIỆM (3 điểm) Câu 1. Trong dãy chuyển hóa sau có những có những phản ứng nào không thực hiện được? (mỗi mũi tên một phản ứng). A. (2), (4), (5). B. (1), (5). C. (2), (4). D. (3), (1). Câu 2. Phản ứng nào sau đây viết sai? (không xét đến cân bằng)
A. (1), (2) sai. B. (1), (2), (4) sai. C. (3) sai. D. Tất cả đều sai. Câu 3. Kim loại nào không tan trong dung dịch \({H_2}S{O_4}\) loãng, dư ở nhiệt độ thường nhưng có thể tan hoàn toàn trong dung dịch \({H_2}S{O_4}\) đặc, đun nóng? A. Cr. B. Cu. C. Ni. D. Pb. Câu 4. Ngâm một đinh sắt (dư) vào dung dịch \(AgN{O_3}\) đến phản ứng hoàn toàn, nhấc ra rồi ngâm vào dung dịch \(HN{O_3}\) đặc, nguội thấy khối lượng đinh sắt giảm so với ban đầu là 2,8 gam. Khối lượng dung dịch \(AgN{O_3}\)sẽ A. Tăng 2,8 gam B. Giảm 11,8 gam. C. Giảm 10,4 gam. D. Giảm 8 gam. Câu 5. Trường hợp nào không gây nhiễm độc chì Pb? A. Hít phải khói thải xe chạy xăng pha \(Pb{({C_2}{H_5})_4}\) B. Vỏ đồ hộp hàn bằng chì C. Ăn cá, tôm... nhiễm chì. D. Tật xấu: ngậm đầu bút chì. Câu 6. Trong khi ghi chép kết quả phân tích một dung dịch chứa: \({K^ + };\,F{e^{3 + }};\,Cl;\,NO_3^ - ;\,A{g^ + }\) có ghi thừa một ion là \(A.\,C{l^ - }.\) B. \(F{e^{2 + }}\) \(C.\,A{g^ + }.\) D. \(A{g^ + }\) hoặc \(C{l^ - }\) II. PHẦN TỰ LUẬN (7 điểm) Câu 1. (2 điểm) 1. Chất bột màu lục A thực tế không tan trong dung dịch axit loãng và dung dịch kiềm loãng. Nấu chảy A với kiềm có mặt không khí thu được chất B có màu vàng, dễ tan trong nước. B tác dụng với axit chuyển thành chất C có màu da cam. C bị lưu huỳnh khử thành chất A, tác dụng với axit clohiđric thu được khí clo. Viết các phương trình phản ứng minh họa. 2. Cho riêng rẽ một mẩu gang và một mẩu thép cùng khối lượng vào 2 cốc dung dịch \({H_2}S{O_4}\) loãng dư. So sánh thể tích \({H_2}\) thoát ra trong hai trường hợp và giải thích. Câu 2. (3 điểm) 1. Khí \({N_2}\) lẫn tạp chất \(CO,\,C{O_2}\). Trình bày phương pháp hóa học để loại bỏ tạp chất. 2. Pha loãng 30 ml dung dịch \({H_2}S{O_4}\) chưa biết nồng độ thành 100 ml. Chuẩn độ 30ml dung dịch sau khi pha loãng đã dùng hết 30 ml dung dịch NaOH 0,01M. Chất chỉ thị là phenolphtalein. Nêu hiện tượng xảy khi dừng chuẩn độ và tính nồng độ dung dịch \({H_2}S{O_4}\) ban đầu. 3. Cho các chất sau; DDT, dầu hỏa, heroin, nicotin, cloramin – B, đioxin, mazut, tamiflu. Hãy sắp xếp các chất trên theo nhóm: dược phẩm, nhiên liệu, chất gây nghiện, chất độc. Câu 3. (2 điểm). Một hỗn hợp Fe và kim loại M (có số oxi hóa không đổi), có tỷ lệ \(\dfrac{{{n_{Fe}}}}{{{n_M}}} = \dfrac{1}{4}\) Nếu hòa tan hết hỗn hợp này trong axit HCl thì thu được 15,68 lít \({H_2}.\) Nếu cho cùng lượng hỗn hợp kim loại trên tác dụng hết với \(C{l_2}\) thì phải dùng 16,8 lít \(C{l_2}.\) 1. Tính thể tích khí \(C{l_2}\) đã tham gia phản ứng với kim loại M. 2. Nếu biết khối lượng M trong hỗn hợp là 10,8 gam thì M là kim loại nào? Các thể tích khí ở điều kiện tiêu chuẩn. Lời giải chi tiết I. PHẦN TRẮC NGHIỆM (3 điểm) Câu 1. Chọn C
Câu 2. Chọn D. \(Fe + 2HCl \to FeC{l_2} + {H_2}\) \(Fe + HN{O_3}\) không sinh ra \({H_2}\) và \(Fe{(N{O_3})_3}\) \(\begin{array}{l}F{e_2}{O_3} + 2{H_2}S{O_4}d/n \to F{e_2}{(S{O_4})_3} + {H_2}O\\Fe + CuC{l_2} \to FeC{l_2} + Cu\end{array}\) Câu 3. Chọn D. \(PbC{l_2}\) sinh ra bám trên Pb \( \to \) phản ứng ngừng lại. Nếu đun nóng, \(PbC{l_2}\) tan ra, phản ứng lại tiếp diễn. Câu 4. Chọn D. \(2AgN{O_3} + Fe \to Fe{(N{O_3})_2} + 2Ag.\) 0,1 0,05 0,05 (mol) Ag sinh ra được \(HN{O_3}\) rửa sạch còn Fe không tan do thụ động. Fe phản ứng là 2,8 gam (0,05 mol) Khối lượng dung dịch giảm do dung dịch có 0,1 mol \(A{g^ + }\) được thay thế bằng 0,05 mol \(F{e^{2 + }} \to \) mgiảm = 108.0,1 – 2,8 = 8 gam. Câu 5. Chọn D. Ruột bút chì là than chì (cacbon) nên không bị nhiễm độc chì. Câu 6. Chọn C. \(\begin{array}{l}A{g^ + } + C{l^ - } \to AgCl\\A{g^ + } + F{e^{2 + }} \to F{e^{3 + }} + Ag\end{array}\) \( \to \) Bỏ \(A{g^ + }\) sẽ không còn tương tác hóa học giữa các ion trong dung dịch. II. PHẦN TỰ LUẬN (7 điểm). Câu 1.
2. Miếng thép cho nhiều khí \({H_2}\) hơn miếng gang vì gang có hàm lượng C cao hơn nên hàm lượng Fe sẽ ít hơn thép: \(Fe + {H_2}S{O_4} \to FeS{O_4} + {H_2}\) Câu 2. 1. Dẫn hỗn hợp CuO dư, đun nóng để loại bỏ CO. Dẫn tiếp hỗn hợp khí qua dung dịch NaOH đặc, dư loại bỏ \(C{O_2}\) \(\begin{array}{l}C{O_2} + 2NaOH \to N{a_2}C{O_3} + {H_2}O\\2.2NaOH + {H_2}S{O_4} \to N{a_2}S{O_4} + {H_2}O\end{array}\) Hiện tượng: dung dịch không màu chuyển màu hồng \({n_{{H_2}S{O_4}}} = \dfrac{1}{2}{n_{NaOH}} = 0,00015mol \Rightarrow \) ban đầu có \({n_{{H_2}S{O_4}}} = 0,0075mol\) \({C_{{H_2}S{O_4}}} = \dfrac{{0,00075}}{{0,03}} = 0,025mol/l\) 3. Dược phẩm: cloramin – B, Tamiflu Chất gây nghiện: heroin, nicotin Nhiên liệuL dầu hỏa, mazut Chất độc: DDT, đioxin. Câu 3. Gọi số mol của Fe là x mol, số mol của M là 4x mol \( \Rightarrow {n_{{H_2}}} = x + 2nx = 0,75\) \(\Rightarrow 0,5x = 0,05 \) \(\Rightarrow x = 0,1mol \) \(\Rightarrow {V_{C{l_2}}} = 2,24\) (lít). \(2.x = 0,1 \Rightarrow {m_M} = 0,4M = 10,8 \) \(\Rightarrow M = 27\). M là Al. Loigiaihay.com
|














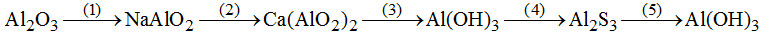
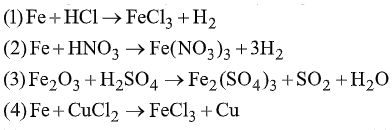
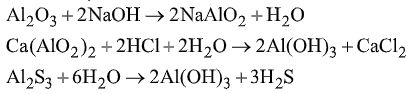
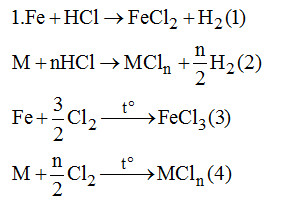






Danh sách bình luận