Lý thuyết tỉ khối của chất khíCông thức tính tỉ khối của: Quảng cáo
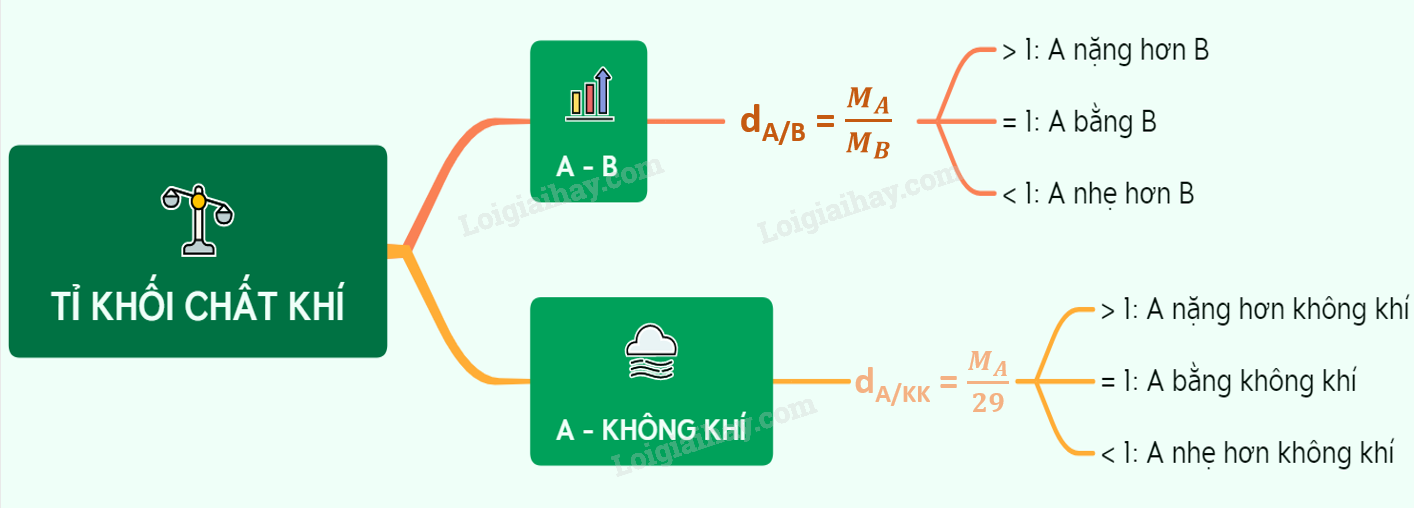
I. Công thức tính tỉ khối - Để so sánh khí A nặng hơn hay nhẹ hơn khí B, người ta dựa vào tỉ khối của chất khí (tỉ khối là tỉ số khối lượng mol của 2 chất khí) - Kí hiệu: dA/B - Công thức: ${{d}_{A/B}}=\frac{{{M}_{A}}}{{{M}_{B}}}$ Trong đó: dA/B là tỉ khối của khí A đối với khí B MA : khối lượng mol của khí A MB : khối lượng mol của khí B - Nếu dA/B > 1 => khí A nặng hơn khí B - Nếu dA/B = 1 => khí A nặng bằng khí B - Nếu dA/B < 1 => khí A nhẹ hơn khí B Ví dụ: Khí cacbonic (CO2) nặng hay nhẹ hơn khí hiđro (H2)? Giải: Khối lượng mol của khí CO2 là: ${{M}_{C{{O}_{2}}}}=12+16.2=44\,g/mol$ Khối lượng mol của khí H2 là: ${{M}_{{{H}_{2}}}}=2.1=2\,g/mol$ Ta có : ${{d}_{C{{O}_{2}}/{{H}_{2}}}}=\frac{{{M}_{C{{O}_{2}}}}}{{{M}_{{{H}_{2}}}}}=\frac{44}{2}=22$ > 1 => Khí cacbonic nặng hơn khí hiđro gấp 22 lần. II. Tỉ khối của khí A so với không khí - Trong sinh học chúng ta đã biết không khí là hỗn hợp gồm nhiều khí, trong đó có hai khí chính là khí N2 chiếm khoảng 80% và khí O2 chiếm khoảng 20%. Do đó, khối lượng của “mol không khí” là khối lượng của 0,8 mol khí nitơ + khối lượng 0,2 mol khí oxi => Mkhông khí = 0,8.28 + 0,2.32 = 28,8 ≈ 29 gam * Công thức tỉ khối của khí A so với không khí: ${{d}_{A/kk}}=\frac{{{M}_{A}}}{29}$ Trong đó: dA/kk : tỉ khối của khí A đối với không khí MA : khối lượng mol của khí A Mkk : khối lượng mol của không khí Ví dụ: Khí cacbonic (CO2) nặng hay nhẹ hơn không khí bao nhiêu lần? Giải: Khối lượng mol của khí CO2 là: ${{M}_{C{{O}_{2}}}}=12+16.2=44\,g/mol$ Ta có : ${{d}_{C{{O}_{2}}/{{H}_{2}}}}=\frac{{{M}_{C{{O}_{2}}}}}{29}=\frac{44}{29}\approx 1,52$ > 1 => khí CO2 nặng hơn không khí 1,52 lần III. Tỉ khối của hỗn hợp khí Xét hỗn hợp khí X chứa: Khí X1 (M1) có a1 mol Khí X2 (M2) có a2 mol … Khí Xn (Mn) có an mol Khi đó: ${{\bar{M}}_{X}}=\frac{{{a}_{1}}.{{M}_{1}}+{{a}_{2}}.{{M}_{2}}+...+{{a}_{n}}.{{M}_{n}}}{{{a}_{1}}+{{a}_{2}}+...+{{a}_{n}}}\,\,=>\,\,{{d}_{X/B}}=\frac{{{{\bar{M}}}_{X}}}{{{M}_{B}}}$ Ví dụ: Tính tỉ khối hỗn hợp khí X gồm N2 (0,02 mol) và O2 (0,01 mol) so với khí oxi. Khí N2 có ${{M}_{{{N}_{2}}}}$= 2.14 = 28 g/mol và có số mol là 0,02 mol Khí O2 có ${{M}_{{{O}_{2}}}}$= 2.16 = 32 g/mol và có số mol là 0,01 mol Áp dụng công thức: ${{\bar{M}}_{X}}=\frac{{{a}_{{{N}_{2}}}}.{{M}_{{{N}_{2}}}}+{{a}_{{{O}_{2}}}}.{{M}_{{{O}_{2}}}}}{{{a}_{{{N}_{2}}}}+{{a}_{{{O}_{2}}}}}=\frac{0,02.28+0,01.32}{0,02+0,01}=\frac{88}{3}$ $=>\,\,{{d}_{X/{{O}_{2}}}}=\frac{{{{\bar{M}}}_{X}}}{{{M}_{{{O}_{2}}}}}=\frac{\frac{88}{3}}{32}=\frac{11}{12}\approx 0,917$ * Nếu hỗn hợp X gồm 2 khí thì: ${{\bar{M}}_{X}}={{M}_{1}}.a+{{M}_{2}}.(1-a)$ với a là phần trăm số mol khí thứ nhất. Ví dụ: hỗn hợp X gồm CO2 (75%) và CO (25%) có ${{\bar{M}}_{X}}=75\%.{{M}_{C{{O}_{2}}}}+25\%.{{M}_{CO}}=0,75.44+0,25.28=40$ Sơ đồ tư duy: Tỉ khối chất khí
|




















Danh sách bình luận