Bài 5. Mol và tỉ khối của chất khí trang 27, 28, 29 SGK Khoa học tự nhiên 8 - Chân trời sáng tạoCác hạt (nguyên tử, phân tử) có kích thước và khối lượng vô cùng nhỏ bé, không thể xác định được bằng các dụng cụ đo thường dùng. Làm thế nào để có thể xác định một cách dễ dàng số nguyên tử, phân tử và khối lượng, thể tích (đối với chất khí) các chất khí? Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
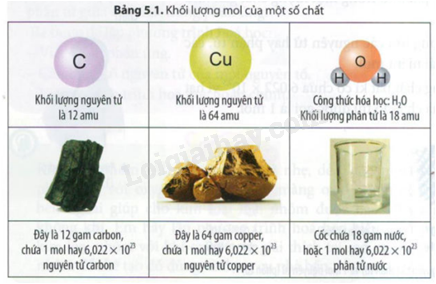
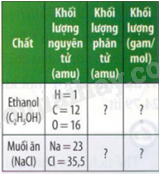
Câu hỏi tr 27 CHMĐ Trả lời câu hỏi mở đầu trang 27 SGK KHTN 8 Chân trời sáng tạo Các hạt (nguyên tử, phân tử) có kích thước và khối lượng vô cùng nhỏ bé, không thể xác định được bằng các dụng cụ đo thừogn dùng. Làm thế nào để có thể xác định một cách dễ dàng số nguyên tử, phân tử và khối lượng, thể tích (đối với chất khí) các chất khí? Phương pháp giải: Dựa vào kiến thức về mol và tỉ khối của chất khí. Lời giải chi tiết: Để đại diện cho một số lượng lớn các nguyên tử hay phân tử, các nhà khoa học đã đưa ra khái niệm mol. Câu hỏi tr 27 CH Trả lời câu hỏi trang 27 SGK KHTN 8 Chân trời sáng tạo Tại sao không thể đếm được chính xác số nguyên tử hay phân tử của một chất? Phương pháp giải: Dựa vào kiến thức về mol. Lời giải chi tiết: Vì sẽ mất rất nhiều thời gian để đếm được số nguyên tử hay phân tử của một chất. Câu hỏi tr 28 LT Trả lời câu hỏi luyện tập trang 28 SGK KHTN 8 Chân trời sáng tạo Hãy cho biết 0,25 mol khí O2 có bao nhiêu phân tử oxygen. Phương pháp giải: Dựa vào 1 mol có chứa 6,022.1023 hạt. Lời giải chi tiết: 0,25 mol khí O2 có số phân tử là: 0,25 x 6,022 x 1023 = 1,5055.1023 Câu hỏi tr 28 CH 1 Trả lời câu hỏi 1 trang 28 SGK KHTN 8 Chân trời sáng tạo Nếu xét cùng 1 mol thì khối lượng của C và Cu có giá trị bao nhiêu gam? Phương pháp giải: Dựa vào công thức tính khối lượng mol. Lời giải chi tiết: Khối lượng của C là 1.12 = 12 gam Khối lượng của Cu là 1.64 = 64 gam Câu hỏi tr 28 CH 2 Trả lời câu hỏi 2 trang 28 SGK KHTN 8 Chân trời sáng tạo Nếu các chất có cùng số mol thì có cùng khối lượng không? Phương pháp giải: Dựa vào khối lượng mol. Lời giải chi tiết: Nếu các chất có cùng số mol thì không cùng khối lượng. Câu hỏi tr 28 CH 3 Trả lời câu hỏi 3 trang 28 SGK KHTN 8 Chân trời sáng tạo So sánh trị số của khối lượng mol nguyên tử, khối lượng mol của phân tử với khối lượng nguyên tử, khối lượng phân tử tương ứng của các chất đã cho trong Bảng 5.1 Phương pháp giải: Dựa vào Bảng 5.1 Lời giải chi tiết: Khối lượng mol nguyên tử hay khối lượng mol phân tử của một chất có cùng trị số với khối lượng nguyên tử hay khối lượng phân tử của chất đó. Câu hỏi tr 29 LT 1 Trả lời câu hỏi luyện tập 1 trang 29 SGK KHTN 8 Chân trời sáng tạo Hãy cho biết khối lượng phân tử và khối lượng mol của các chất trong bảng sau: Phương pháp giải: Dựa vào công thức tính khối lượng phân tử và khối lượng mol. Lời giải chi tiết: Khối lượng phân tử ethanol là: 2.12 + 1.6 + 16 = 46 amu Khối lượng ethanol: 1.46 = 46 gam/mol Khối lượng phân tử NaCl là: 58,5 amu Khối lượng NaCl là: 58,5 gam/mol Câu hỏi tr 29 LT 2 Trả lời câu hỏi luyện tập 2 trang 29 SGK KHTN 8 Chân trời sáng tạo a) Tính khối lượng của 0,5 mol phân tử bromine biết rằng phân tử bromine có 2 nguyên tử và 1 mol nguyên tử bromine có khối lượng 80 gam. b) Tìm khối lượng mol của hợp chất A, biết rằng 0,5 mol của chất này có khối lượng là 22 gam. Phương pháp giải: Dựa vào công thức chuyển đổi giữa số mol và khối lượng. Lời giải chi tiết: a) Khối lượng phân tử bromine là: 0,5.160 = 80g. b) Khối lượng mol của hợp chất A là: 22 : 0,5 = 44 gam/mol Câu hỏi tr 29 CH Trả lời câu hỏi trang 29 SGK KHTN 8 Chân trời sáng tạo Em có nhận xét gì về thể tích của 1 mol các chất khí ở cùng điều kiện về nhiệt độ và áp suất trong Hình 5.3 Phương pháp giải: Dựa vào công thức tính thể tích chất khí. Lời giải chi tiết: Thể tích của các chất khí đều bằng nhau ở điều kiện nhiệt độ và áp suất. Câu hỏi tr 30 CH 1 Trả lời câu hỏi 1 trang 30 SGK KHTN 8 Chân trời sáng tạo Ở nhiệt độ 25oC và áp suất là 1 bar, 1 mol chất khí bất kì có thể tích bằng bao nhiêu lít? Phương pháp giải: Dựa vào công thức tính thể tích chất khí: V = n.24,79 Lời giải chi tiết: Ở nhiệt độ 25oC và áp suất là 1 bar, 1 mol chất khí bất kì có thể tích bằng 24,79 lít. Câu hỏi tr 30 CH 2 Trả lời câu hỏi 2 trang 30 SGK KHTN 8 Chân trời sáng tạo Làm thế nào để tính được thể tích của các chất khí ở điều kiện chuẩn? Phương pháp giải: Dựa vào công thức tính thể tích chất khí. Lời giải chi tiết: Công thức tính thể tích chất khí ở điều kiện chuẩn là: V = n.24,79 (lít) Câu hỏi tr 30 LT Trả lời câu hỏi luyện tập trang 30 SGK KHTN 8 Chân trời sáng tạo a) Hãy cho biết 0,1 mol CO2 ở đkc có thể tích là bao nhiêu lít. b) 4,958 lít khí O2 (đkc) có số mol là bao nhiêu? Phương pháp giải: Dựa vào công thức tính thể tích chất khí V = n.24,79 (lít). Lời giải chi tiết: a) V CO2 (đkc) = 0,1.24,79 = 2,479 lít b) n O2 = 4,958 : 24,79 = 0,2 mol. Câu hỏi tr 30 VD Trả lời câu hỏi vận dụng trang 30 SGK KHTN 8 Chân trời sáng tạo SO2 được sử dụng để bảo quản hoa quả sấy khô, làm hạn chế xuất hiện những vết màu nâu trên vỏ của rau quả tươi. Biết rằng 0,1 gam SO2 ta có thể bảo quản được 1 kg trái vải sấy khô. Nếu ta sử dụng 6,2 lít SO2 (đkc) thì ra có thể bảo quản được bao nhiêu kg trái vải sấy khô? Phương pháp giải: Chuyển đổi số mol SO2 dựa vào thể tích khí đkc. Lời giải chi tiết: n SO2 = 6,2 : 24,79 = 0,25 mol m SO2 = 0,25.64 = 16g Số kg trái vải sấy khô được bảo quản là: 16 : 0,1 = 160kg. Câu hỏi tr 30 CH 3 Trả lời câu hỏi 3 trang 30 SGK KHTN 8 Chân trời sáng tạo Bằng cách nào ta có thể biết được khí A nặng hay nhẹ hơn khí B? Phương pháp giải: Dựa vào công thức tính tỉ khối của chất khí. Lời giải chi tiết: Để biết khí A nặng hay nhẹ hơn khí B bao nhiêu lần, ta so sánh khối lượng của hai thể tích khí bằng nhau ở cùng điều kiện nhiệt độ và áp suất, khi đó, theo định luật Avogadro: \({d_{A/B}} = \frac{{{m_A}}}{{{m_B}}} = \frac{{{M_A}.{n_A}}}{{{M_B}.{n_B}}} = \frac{{{M_A}}}{{{M_B}}}\) Câu hỏi tr 31 LT 1 Trả lời câu hỏi luyện tập 1 trang 31 SGK KHTN 8 Chân trời sáng tạo Hãy cho biết khí oxygen nặng hay nhẹ hơn khí hydrogen bao nhiêu lần? Phương pháp giải: Dựa vào công thức tính tỉ khối của chất khí: \({d_{A/B}} = \frac{{{m_A}}}{{{m_B}}} = \frac{{{M_A}.{n_A}}}{{{M_B}.{n_B}}} = \frac{{{M_A}}}{{{M_B}}}\) Lời giải chi tiết: \({d_{{O_2}/{H_2}}} = \frac{{{M_{O2}}}}{{{M_{H2}}}} = \frac{{32}}{2} = 16\) Vậy khí oxygen nặng hơn khí hydrogen 16 lần. Câu hỏi tr 31 LT 2 Trả lời câu hỏi luyện tập 2 trang 31 SGK KHTN 8 Chân trời sáng tạo Hãy tìm khối lượng mol của những khí có tỉ khối đối với khí oxygen lần lượt là: 0,0625;2. Phương pháp giải: Dựa vào công thức tính tỉ khối của chất khí: \({d_{A/B}} = \frac{{{m_A}}}{{{m_B}}} = \frac{{{M_A}.{n_A}}}{{{M_B}.{n_B}}} = \frac{{{M_A}}}{{{M_B}}}\) Lời giải chi tiết: MA = d.MO2 = 0,0625.32 = 2amu MB = d.MO2 = 2.32 = 64amu Câu hỏi tr 31 VD Trả lời câu hỏi vận dụng trang 31 SGK KHTN 8 Chân trời sáng tạo Có 2 quả bóng được bơm đầy 2 khsi helium và carbon dioxde như hình bên: Nếu buông tay ra thì 2 quả bóng có bay lên được không? Vì sao? Biết không khí có khối lượng mol trung bình là 29 gam/mol. Phương pháp giải: Dựa vào công thức tính tỉ khối của các chất. Lời giải chi tiết: M không khí = 29 Tỉ khối của khí helium so với không khí là: \(\frac{4}{{29}} = 0,138\) Tỉ khối của khí carbon so với không khí là: \(\frac{{44}}{{29}} = 1,517\) Vậy nếu buông tay quả bóng chứa khí helium bay lơn, khí carbon không bay.
|





















Danh sách bình luận