Lý thuyết bài 4: Mô hình nguyên tử và orbital nguyên tửOrbital nguyên tử, mô hình Rutherford – Bohr Quảng cáo
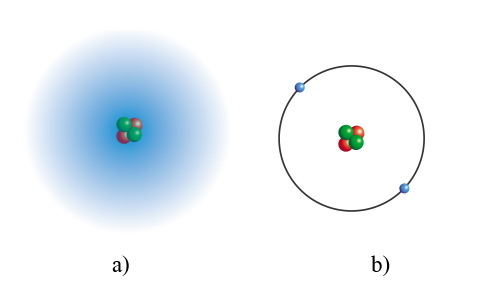
Lý thuyết: Mô hình nguyên tử và orbital nguyên tử I. Mô hình nguyên tử: Hai mô hình nguyên tử của Helium 1. Mô hình Rutherford – Bohr - Nội dung mô hình nguyên tử theo Rutherford – Bohr:
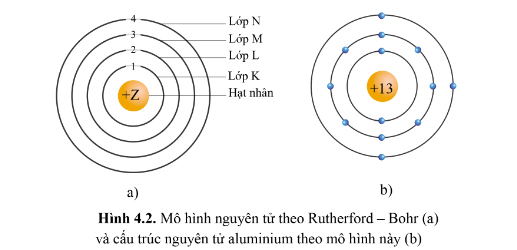
- Theo chiều từ hạt nhân ra ngoài lớp vỏ, các electron được sắp xếp vào các lớp electron: 2. Mô hình hiện đại về nguyên tử: Các electron chuyển động xung quanh hạt nhân không theo những quỹ đạo xác định, chuyển động rất nhanh trong cả khu vực không gian xung quanh hạt nhân giống như một đám mây electron. II. Orbital nguyên tử 1. Khái niệm: Orbital nguyên tử (AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà xác suất tìm thấy electron trong khu vực đó là lớn nhất (khoảng 90%) - Orbital nguyên tử có một số hình dạng khác nhau: hình cầu, hình số tám nổi. 2. Số lượng electron trong một AO - Mỗi AO chỉ chứa tối đa 2 electron, 2 electron này được gọi là cặp electron ghép đôi. Nếu AO chỉ có 1 electron, electron đó được gọi là electron độc thân. - Nếu AO không chứa electron nào thì gọi là AO trống. Sơ đồ tư duy |