Bài 18. Hydrogen halide và hydrohalic acid trang 109, 110, 111, 112, 113, 114 Hóa 10 Cánh diềuTải vềKhi hòa tan mỗi hydrogen halide HF, HCl, HBr và HI vào nước thì thu được các dung dịch hydrohalic acid. Dung dịch nào có tính acid yếu nhất? Vì sao? Giải thích tại sao xu hướng phân cực của các phân tử HX giảm dần từ HF đến HI Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 109 MĐ
Lời giải chi tiết: - Tính acid phụ thuộc vào khả năng tách H của acid. Phân tử nào càng dễ tách H thì tính acid càng mạnh - Trong nhóm halogen, từ F đến I có độ âm điện giảm dần => Khả năng liên kết H-X giảm dần => Khả năng tách H trong HX tăng dần => Tính acid tăng dần => Dung dịch HF có tính acid yếu nhất CH tr 109 CH
Phương pháp giải: Độ âm điện giảm dần Lời giải chi tiết: Trong nhóm halogen, từ F đến I có độ âm điện giảm dần => Sự chênh lệch độ âm điện giữa H và X giảm dần => Độ phân cực H-X giảm dần từ F đến I CH tr 109 CH
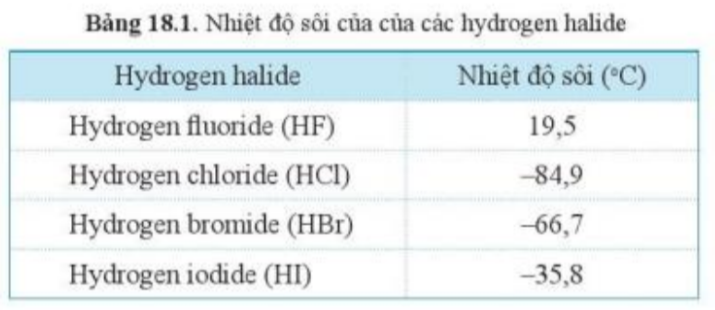
Phương pháp giải: Nhiệt độ sôi = Nhiệt độ hóa lỏng Lời giải chi tiết: - Ở điều kiện thường, nhiệt độ là 25oC, tất cả các hydrogen halide đều ở thể khí => Khi hạ nhiệt độ xuống thấp dần, hydrogen fluoride sẽ được hóa lỏng đầu tiên CH tr 111 CH
Phương pháp giải: Tham khảo Bảng 18.2: Lời giải chi tiết: - Xét phản ứng của NaCl với H2SO4: NaCl(s) + H2SO4(l) \(\xrightarrow{{{t^o}}}\) NaHSO4(s) + HCl(g) => Ion Cl- không thể hiện tính khử, không có sự thay đổi số oxi hóa => Không phải phản ứng oxi hóa – khử - Xét phản ứng của NaI với H2SO4: 8NaI(s) + 9H2SO4(l) → 8NaHSO4(s) + I2(g) + H2S(g) + 4H2O(g) => Ion I- thể hiện tính khử và khử sulfur trong H2SO4 từ số oxi hóa +6 về số oxi hóa -2 trong H2S - Giải thích: Do ion Cl- có tính khử yếu hơn ion I- CH tr 111 LT
Phương pháp giải: Tham khảo Bảng 18.2 Lời giải chi tiết: - Khi potassium bromide phản ứng với sulfuric acid đặc, đun nóng. Ta có phương trình: 2NaBr(s) + 3H2SO4(l) \(\xrightarrow{{{t^o}}}\) 2NaHSO4(s) + Br2(g) + SO2(g) + 2H2O(g) => Sản phẩm tạo thành không có HBr => Không thể điều chế hydrogen bromide từ phản ứng giữa potassium bromide với sulfuric acid đặc CH tr 112 VD
Phương pháp giải: a) Oxide + acid → Muối + Nước b) Giấm ăn, chanh Lời giải chi tiết: a) - Dung dịch hydrochloric acid được dùng để trung hòa môi trường base: oxide base, base => Sử dụng dung dịch hydrochloric acid để tẩy rửa lớp copper(II) oxide tạo thành dung dịch muối và nước - Phương trình hóa học: CuO + HCl → CuCl2 + H2O b) Các dung dịch có sẵn trong gia đình để tẩy rửa copper(II) oxide là: nước chanh, giấm ăn. Vì chúng có tính acid, có thể loại bỏ được lớp copper(II) oxide: Acid + Oxide base → Muối + Nước CH tr 113 TH
Phương pháp giải: - Bước 1: Sử dụng quỳ tím để nhận biết hydrochlodric acid - Bước 2: Sử dụng silver nitrate Lời giải chi tiết: - 4 dung dịch cần nhận biết là: NaCl, NaBr, NaI, HCl - Hóa chất: Giấy quỳ tím, dung dịch silver nitrate - Dụng cụ: 4 ống nghiệm - Tiến hành thí nghiệm và kết quả: Bước 1: Lấy ở mỗi bình khoảng 2 mL dung dịch vào 4 ống nghiệm tương ứng Bước 2: Sử dụng quỳ tím nhúng vào 4 dung dịch trong 4 ống nghiệm. Ống nghiệm nào làm quỳ tím hóa đỏ => Dung dịch hydrochlodric acid Bước 3: Nhỏ khoảng 2 mL dung dịch silver nitrate vào 3 ống nghiệm còn lại và có những hiện tượng sau: Ống nghiệm xuất hiện kết tủa trắng AgCl => Ống nghiệm đó chứa NaCl NaCl + AgNO3 → AgCl↓ + NaNO3 Ống nghiệm xuất hiện kết tủa vàng nhạt AgBr => Ống nghiệm đó chứa NaBr NaBr + AgNO3 → AgBr↓ + NaNO3 Ống nghiệm xuất hiện kết tủa vàng AgI => Ống nghiệm đó chứa NaI NaI + AgNO3 → AgI↓ + NaNO3 CH tr 113 LT
Phương pháp giải: Khi nhỏ dung dịch silver nitrate vào dung dịch chứa ion X- + Nếu xuất hiện kết tủa trắng => Cl- + Nếu xuất hiện kết tủa vàng nhạt => Br- + Nếu không thấy sự biến đổi => F- Lời giải chi tiết: - Khi cho từ từ vài giọt dung dịch silver nitrate vào ống nghiệm chứa từng dung dịch potassium fluoride, hydrochloric acid, sodium bromide: + Ống nghiệm xuất hiện kết tủa trắng AgCl => Ống nghiệm đó chứa HCl HCl + AgNO3 → AgCl↓ + HNO3 + Ống nghiệm xuất hiện kết tủa vàng nhạt AgBr => Ống nghiệm đó chứa NaBr NaBr + AgNO3 → AgBr↓ + NaNO3 + Ống nghiệm không có sự biến đổi do không có phản ứng hóa học xảy ra => Ống nghiệm chứa KF Bài tập 1
Phương pháp giải: Nhiệt độ sôi phụ thuộc vào: + Khối lượng phân tử + Lực van der Waals Lời giải chi tiết: Nhiệt độ sôi của hydrogen bromide cao hơn nhiệt độ sôi của hydrogen chloride được giải thích như sau: + Khối lượng phân tử HBr (81) cao hơn khối lượng phân tử HCl (36,5) + Br có bán kính nguyên tử lớn, có nhiều electron hơn Cl => Tăng khả năng lưỡng cực HX => Làm tăng tương tác van der Waals giữa các phân tử Bài tập 2
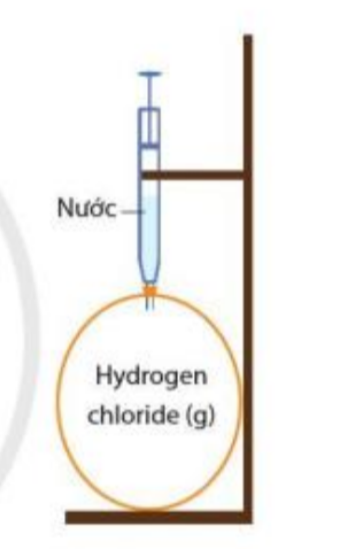
Phương pháp giải: Quả bóng xẹp vào Lời giải chi tiết: Khí hydrogen chloride tan nhiều trong nước tạo thành dung dịch hydrochloric acid => Khi bơm nước vào, khí hydrogen chloride bị hòa tan hết => Quả bóng bị xẹp vào Bài tập 3
Phương pháp giải: - Chất khử là chất nhường electron - Chất oxi hóa là chất nhận electron Lời giải chi tiết: \(4H\mathop {Cl}\limits^{ - 1} {\text{ }} + {\text{ }}\mathop {Mn}\limits^{ + 4} {O_2} \to {\mathop {Cl}\limits^0 _2} + {\text{ }}\mathop {Mn}\limits^{ + 2} C{l_2} + {\text{ }}2{H_2}O\) a) \(\mathop {Mn}\limits^{ + 4} + 2e \to \mathop {Mn}\limits^{ + 2} \) => MnO2 là chất oxi hóa \(\mathop {2Cl}\limits^{ - 1} \to \mathop {C{l_2}}\limits^0 + 2e\) => HCl là chất khử b) HI có tính khử mạnh hơn HCl => HI có thể phản ứng được với MnO2 4HI + MnO2 → I2 + MnI2 + 2H2O Bài tập 4
Phương pháp giải: a) Màu vàng nâu là màu của nước bromine b) Sẽ bị oxi hóa Lời giải chi tiết: a) Khi để lâu trong không khí thì chuyển sang màu vàng nâu => Sản phẩm có sự tạo thành nước Bromine 4HBr + O2 → 2Br2 + 2H2O b) Hydrobromic acid được bảo quản trong các lọ tối màu, nếu để nơi có ánh sáng hoặc trong bình sáng thì khí oxygen sẽ được tạo ra do thành phần của acid HBrO => HBr bị oxi hóa bởi oxygen
|






















Danh sách bình luận