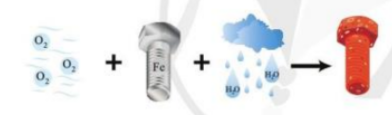
Bài 13. Phản ứng oxi hóa - khử trang 70, 71, 72, 73, 74, 75, 76 Hóa 10 Cánh diềuQuá trình bị gỉ của đinh ốc ngoài không khí được mô tả như hình dưới đây: Xác định số oxi hóa của mỗi nguyên tử nguyên tố trong các hợp chất ion Al2O3, CaF2. Xác định số oxi hóa của mỗi nguyên tử trong hợp chất sau: N = O, CH4. Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 70 MĐ
Phương pháp giải: - Viết PT. - Xác định số oxi hóa của những nguyên tố có số oxi hóa thay đổi. - Viết quá trình nhường electron, nhận electron. Lời giải chi tiết: PT: 3O2 + 4Fe + 6H2O → 4Fe(OH)3↓ Fe → Fe3+ + 3e (nhường electron). O2 + 4e → 2O2- (nhận electron). CH tr 71 LT
Phương pháp giải: - Số oxi hóa của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó. - Cách xác định số oxi hóa + Cách 1: Dựa theo số oxi hóa của một số nguyên tử đã biết. Quy tắc 1. Trong các hợp chất: Số oxi hóa của H là +1 (trừ NaH, CaH2, …); Số oxi hóa của O là -2 (trừ OF2, H2O2, …); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, ..,) là +1, kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, ...) là +2, số oxi hóa của Al là +3. Quy tắc 2. Tổng các số oxi hóa của các nguyên tử trong phân tử bằng 0, của một ion đa nguyên tử bằng chính điện tích của ion đó. + Cách 2: Dựa theo công thức cấu tạo. Cách tính điện tích các nguyên tử trong hợp chất với giả định đó là hợp chất ion dựa vào công thức cấu tạo. Lời giải chi tiết: 1. - Al2O3: Số oxi hóa của O là -2. Gọi a là số oxi hóa của Al. Áp dụng quy tắc 1 và 2 => a.2 + (-2).3 = 0 → x = +3 Vậy số oxi hóa của O là -2, Al là +3 - CaF2 Gọi x là số oxi hóa của F, theo quy tắc 1 và 2 có: 1.(+2) + 2.x = 0 → x = -1. Vậy số oxi hóa của Ca là +2, của F là -1. 2. - N = O có công thức ion giả định là N2+O2- Vậy số oxi hóa của N là +2, O là -2. - CH4 có công thức ion giả định là C4-H4+ Vậy số oxi hóa của C là -4, H là +1. CH tr 71 CH
Phương pháp giải: Quy tắc octet: trong phản ứng hóa học, các nguyên tử có xu hướng hình thành lớp vỏ bền vững như của khí hiếm. Lời giải chi tiết: - Nguyên tử O với cấu hình electron là 1s22s22p4, có 6 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhận thêm 2 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của O là -2. O + 2e → O2- - Nguyên tử kim loại nhóm IA có cấu hình electron chung là ns1, có 1 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhường đi 1 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của kim loại nhóm IA là +1. - Nguyên tử kim loại nhóm IIA có cấu hình electron chung là ns2, có 2 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhường đi 2 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của kim loại nhóm IIA là +2. - Nguyên tử Al với cấu hình electron là [Ne]3s23p1, có 3 electron ở lớp vỏ ngoài cùng nên xu hướng cơ bản là nhường đi 3 electron để đạt được lớp vỏ có 8 electron ở lớp ngoài như khí hiếm ⇒ Vậy số oxi hóa của Al là +3. Al → Al3+ + 3e CH tr 72 LT
Phương pháp giải: - Cách xác định số oxi hóa + Quy tắc 1. Trong các hợp chất: Số oxi hóa của H là +1 (trừ NaH, CaH2, …); Số oxi hóa của O là -2 (trừ OF2, H2O2, …); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, ..,) là +1, kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, ...) là +2, số oxi hóa của Al là +3. + Quy tắc 2. Tổng các số oxi hóa của các nguyên tử trong phân tử bằng 0, của một ion đa nguyên tử bằng chính điện tích của ion đó. Lời giải chi tiết: - Fe2O3 Gọi x là số oxi hóa của Fe, theo quy tắc 1 và 2 có: 2.x + 3.(-2) = 0 → x = +3. Vậy số oxi hóa của Fe là +3, của O là -2. - Na2CO3 Gọi x là số oxi hóa của C, theo quy tắc 1 và 2 có: 2.(+1) + 1.x + 3.(-2) = 0 → x = +4. Vậy số oxi hóa của Na là +1, của C là +4, của O là -2. - KAl(SO4)2 Gọi x là số oxi hóa của S, theo quy tắc 1 và 2 có: 1.(+1) + 1.(+3) + 2[1.x + 4.(-2)] = 0 → x = +6. Vậy số oxi hóa của K là +1, của Al là +3, của S là +6, của O là -2. CH tr 72 LT
Phương pháp giải: - Cách xác định số oxi hóa + Quy tắc 1. Trong các hợp chất: Số oxi hóa của H là +1 (trừ NaH, CaH2, …); Số oxi hóa của O là -2 (trừ OF2, H2O2, …); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, ..,) là +1, kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, ...) là +2, số oxi hóa của Al là +3. + Quy tắc 2. Tổng các số oxi hóa của các nguyên tử trong phân tử bằng 0, của một ion đa nguyên tử bằng chính điện tích của ion đó. Lời giải chi tiết: - NO3- Gọi x là số oxi hóa của N, theo quy tắc 1 và 2 có: 1.x + 3.(-2) = -1 → x = +5. Vậy số oxi hóa của N là +5, của O là -2. - NH4+ Gọi x là số oxi hóa của N, theo quy tắc 1 và 2 có: 1.x + 4.(+1) = +1 → x = -3. Vậy số oxi hóa của N là -3, của H là +1. - MnO4- Gọi x là số oxi hóa của Mn, theo quy tắc 1 và 2 có: 1.x + 4.(-2) = -1 → x = +7. Vậy số oxi hóa của Mn là +7, của O là -2 CH tr 72 LT
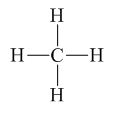
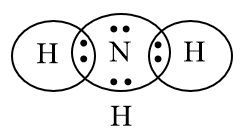
Phương pháp giải: - Viết công thức cấu tạo của NH3 theo công thức Lewis. - Cách tính điện tích các nguyên tử trong hợp chất với giả định đó là hợp chất ion dựa vào công thức cấu tạo. Lời giải chi tiết: Bước 1: Viết cấu hình electron của N (Z = 7) và H (Z = 1) N (Z = 7): 1s22s22p3 H (Z = 1): 1s1 Bước 2: Biểu diễn sự hình thành các cặp electron chung cho NH3 H có 1e ở lớp electron ngoài cùng, N có 5e ở lớp electron ngoài cùng. ⟹ Mỗi nguyên tử góp chung 1e để đạt cấu hình khí hiếm bền vững.
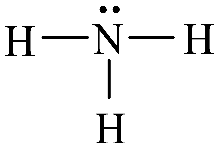
Bước 3: Công thức Lewis của NH3
NH3 có công thức ion giả định là N3-H3+ Vậy số oxi hóa của N là -3, của H là +1. CH tr 72 CH
Phương pháp giải: Trong liên kết giữa nguyên tử A và B, nếu độ âm điện của nguyên tử A nào nhỏ độ âm điện của nguyên tử B thì nguyên tử B mang phần điện tích âm, nguyên tử A mang điện tích dương. Lời giải chi tiết: Độ âm điện của F (3,98) lớn hơn O (3,44) nên nguyên tử F mang phần điện tích âm còn nguyên tử O mang phần điện tích dương. CH tr 73 CH
Phương pháp giải: - Cách xác định số oxi hóa + Quy tắc 1. Trong các hợp chất: Số oxi hóa của H là +1 (trừ NaH, CaH2, …); Số oxi hóa của O là -2 (trừ OF2, H2O2, …); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, ..,) là +1, kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, ...) là +2, số oxi hóa của Al là +3. + Quy tắc 2. Tổng các số oxi hóa của các nguyên tử trong phân tử bằng 0, của một ion đa nguyên tử bằng chính điện tích của ion đó. Chú ý: Số oxi hóa của đơn chất bằng 0. Lời giải chi tiết: 1. (1) 2Ag0 + Cl20 → 2Ag+Cl- Nguyên tố Ag và Cl thay đổi số oxi hóa. (2) 2Ag+N5+O32- + Ba2+Cl2- → 2Ag+Cl- + Ba2+(N5+O32-)2 Không có nguyên tố nào thay đổi số oxi hóa. 2. (3) Cl20 + 2NaOH → Na+O2-Cl+ + Na+Cl- + H2O Nguyên tố Cl thể hiện 3 số oxi hóa trong phản ứng (3). CH tr 74 CH
Phương pháp giải: - Chất khử (chất bị oxi hóa) là chất nhường electron. Na → Na+ + 1e (quá trình oxi hóa) - Chất oxi hóa (chất bị khử) là chất nhận electron. Cl + 1e → Cl- (quá trình khử) Lời giải chi tiết: Al + O2 → Al2O3 Al0 → Al3+ + 3e (quá trình oxi hóa) Al là chất nhường electron → chất khử. O0 + 2e → O2- (quá trình khử) O là chất nhận electron → chất oxi hóa. CH tr 74 CH
Phương pháp giải: Bước 1. Xác định và ghi sự thay đổi số oxi hóa trước và sau phản ứng. Al0 + O20 → Al23+O32- Bước 2. Viết các quá trình oxi hóa và quá trình khử. Al0 → Al3+ + 3e O0 + 2e → O2- Bước 3. Thăng bằng electron bằng cách nhân thêm hệ số vào các bán phản ứng nhường và nhận electron sao cho tổng số electron nhường bằng tổng số electron nhận. Cộng các bán phản ứng (đã nhân hệ số) với nhau sẽ thu được sơ đồ.
⇒ 2Al0 + 3O0 → 2Al3+ + 3O2- Bước 4. Dựa vào sơ đồ để hoàn thành phương trình dạng phân tử. 4Al + 3O2 → 2Al2O3 Lời giải chi tiết: 6. a) Fe2O3 + CO → Fe + CO2 Bước 1. Xác định và ghi sự thay đổi số oxi hóa trước và sau phản ứng. Fe23+O32- + C2+O2- → Fe0 + C4+O22- Bước 2. Viết các quá trình oxi hóa và quá trình khử. Fe3+ + 3e → Fe C2+ → C4+ + 2e Bước 3.
⇒ 2Fe3+ + 3C2+ → 2Fe + 3C4+ Bước 4. Dựa vào sơ đồ để hoàn thành phương trình dạng phân tử. Fe2O3 + 3CO → 2Fe + 3CO2 b) NH3 + O2 → NO + H2O Bước 1. Xác định và ghi sự thay đổi số oxi hóa trước và sau phản ứng. N3-H3+ + O20 → N2+O2- + H2+O2- Bước 2. Viết các quá trình oxi hóa và quá trình khử. O20 + 4e → O2- N3- → N2+ + 5e Bước 3.
⇒ 4N3- + 5O20 → 4N2+O2- + 6O2- Bước 4. Dựa vào sơ đồ để hoàn thành phương trình dạng phân tử. 4NH3 + 5O2 → 4NO + 6H2O 7. Các phản ứng trên thường gặp trong cuộc sống và sản xuất. Những phản ứng này thường diễn ra trong quá trình sản xuất gang và sản xuất acid nitric. CH tr 74 LT
Phương pháp giải: Bước 1. Xác định và ghi sự thay đổi số oxi hóa trước và sau phản ứng. Al0 + O20 → Al23+O32- Bước 2. Viết các quá trình oxi hóa và quá trình khử. Al0 → Al3+ + 3e O0 + 2e → O2- Bước 3. Thăng bằng electron bằng cách nhân thêm hệ số vào các bán phản ứng nhường và nhận electron sao cho tổng số electron nhường bằng tổng số electron nhận. Cộng các bán phản ứng (đã nhân hệ số) với nhau sẽ thu được sơ đồ.
⇒ 2Al0 + 3O0 → 2Al3+ + 3O2- Bước 4. Dựa vào sơ đồ để hoàn thành phương trình dạng phân tử. 4Al + 3O2 → 2Al2O3 Lời giải chi tiết: a) HCl + PbO2 → PbCl2 + Cl2 + H2O H+Cl- + Pb4+O22- → Pb2+Cl2- + Cl20 + H2+O2-
⇒ 2Cl- + Pb4+ → Pb2+ + Cl20 2HCl + PbO2 → PbCl2 + Cl2 + H2O b) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O K+Mn7+O42- + H+Cl- → K+Cl- + Mn2+Cl2- + Cl20 + H2+O2-
⇒ 10Cl- + 2Mn7+ → 2Mn2+ + 5Cl20 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O CH tr 75 VD
Lời giải chi tiết: Sắt bị gỉ trong không khí ẩm có là phản ứng oxi hóa – khử vì có sự trao đổi electron trong đó Fe là chất khử, O2 là chất oxi hóa. 3O2 + 4Fe + 6H2O → 4Fe(OH)3↓ Đề xuất một vài biện pháp hạn chế sự tạo gỉ kim loại nêu trên. - Ngăn không cho kim loại tiếp xúc với môi trường: sơn mạ, bôi dầu mỡ ... lên trên bề mặt kim loại. - Chế tạo hợp kim ít bị ăn mòn: ví dụ như cho thêm vào thép một số kim loại như crom, niken để làm tăng độ bền. CH tr 75 CH
Lời giải chi tiết: CH4 + 2O2 → CO2 + 2H2O C-4H4+ + O20 → C4+O22- + H2+O2- Quá trình thay đổi số oxi hóa C-4 → C4+ + 8e O20 + 4e → 2O2- Bài tập 1
Phương pháp giải: - Cách xác định số oxi hóa + Quy tắc 1. Trong các hợp chất: Số oxi hóa của H là +1 (trừ NaH, CaH2, …); Số oxi hóa của O là -2 (trừ OF2, H2O2, …); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, ..,) là +1, kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, ...) là +2, số oxi hóa của Al là +3. + Quy tắc 2. Tổng các số oxi hóa của các nguyên tử trong phân tử bằng 0, của một ion đa nguyên tử bằng chính điện tích của ion đó. Lời giải chi tiết: a) H2SO3 Gọi x là số oxi hóa của S, theo quy tắc 1 và 2 có: 2.(+1) + 1.x + 3.(-2) = 0 → x = +4. Vậy số oxi hóa của H là +1, của S là +4, của O là -2. b) Al(OH)4- Gọi x là số oxi hóa của Al, theo quy tắc 1 và 2 có: 1.x + 4.[1.(-2) + 1.(+1)] = -1 → x = +3. Vậy số oxi hóa của Al là +3, của O là -2, của H là +1. c) NaAlH4 Gọi x là số oxi hóa của H, theo quy tắc 1 và 2 có: 1.(+1) + 1.(+3) + 4.x = 0 → x = -1. Vậy số oxi hóa của Na là +1, của Al là +3, của H là -1. d) NO2- Gọi x là số oxi hóa của N, theo quy tắc 1 và 2 có: 1x + 2.(-2) = -1 → x = +3. Vậy số oxi hóa của N là +3, của O là -2 Bài tập 2
Phương pháp giải: - Chất khử (chất bị oxi hóa) là chất nhường electron. Na → Na+ + 1e (quá trình oxi hóa) - Chất oxi hóa (chất bị khử) là chất nhận electron. Cl + 1e → Cl- (quá trình khử) Lời giải chi tiết: a) Ag+ + Fe2+ → Ag + Fe3+ Ag+ + 1e → Ag (quá trình khử) Fe2+ → Fe3++ 1e (quá trình oxi hóa) Chất oxi hóa: Ag+ Chất khử: Fe2+ b) 3Hg2+ + 2Fe → 3Hg + 2Fe3+ Hg2+ + 2e → Hg (quá trình khử) Fe → Fe3+ + 3e (quá trình oxi hóa) Chất oxi hóa: Hg2+ Chất khử: Fe c) 2As + 3Cl2 → 2AsCl3 As → As3+ + 3e (quá trình oxi hóa) Cl2 + 2e → 2Cl- (quá trình khử) Chất khử: As Chất oxi hóa: Cl2 d) Al + 6H+ + 3N5+O3- → Al3+ + 3N4+O2 + 3H2O Al → Al3+ + 3e (quá trình oxi hóa) N5+ + 1e → N4+ (quá trình khử) Chất khử: Al Chất oxi hóa: NO3- Bài tập 3
Phương pháp giải: Bước 1. Xác định và ghi sự thay đổi số oxi hóa trước và sau phản ứng. Al0 + O20 → Al23+O32- Bước 2. Viết các quá trình oxi hóa và quá trình khử. Al0 → Al3+ + 3e O0 + 2e → O2- Bước 3. Thăng bằng electron bằng cách nhân thêm hệ số vào các bán phản ứng nhường và nhận electron sao cho tổng số electron nhường bằng tổng số electron nhận. Cộng các bán phản ứng (đã nhân hệ số) với nhau sẽ thu được sơ đồ.
⇒ 2Al0 + 3O0 → 2Al3+ + 3O2- Bước 4. Dựa vào sơ đồ để hoàn thành phương trình dạng phân tử. 4Al + 3O2 → 2Al2O3 Lời giải chi tiết: a) NaBr + Cl2 → NaCl + Br2 Na+Br- + Cl20 → Na+Cl- + Br20
⇒ 2Br- + Cl2→ Br2+ 2Cl- 2NaBr + Cl2 → 2NaCl + Br2 b) Fe2O3 + CO → Fe + CO2 Fe23+O2- + C2+O2- → Fe0 + C4+O22-
⇒ 2Fe3+ + 3C2+ → 2Fe + 3C4+ Fe2O3 + 3CO → 2Fe + 3CO2 c) CO + I2O5 → CO2 + I2 C2+O2- + I25+O52- → C4+O22- + I20
⇒ 5C2+ + 2I25+ → 5C4+ + 2I2 5CO + 2I2O5 → 5CO2 + 2I2 d) Cr(OH)3 + Br2 + OH- → CrO42- + Br- + H2O Cr3+(OH)3- + Br20 + OH- → Cr6+O42- + Br- + H2O
⇒ 2Cr3+ + 3Br20 → 2Cr6+ + 6Br- 2Cr(OH)3 + 3Br2 + 10OH- → 2CrO42- + 6Br- + 8H2O e) H+ + MnO4- + HCOOH → Mn2+ + H2O + CO2 H+ + Mn7+O4- + H1+C2+O2-O2-H1+ → Mn2+ + H2O + C4+O2
⇒ 2Mn7+ + 5C2+ → 2Mn2++5C4+ 6H+ + 2MnO4- + 5HCOOH → 2Mn2+ + 8H2O + 5CO2 Bài tập 4
Phương pháp giải: - Dựa theo công thức cấu tạo. + Cách tính điện tích các nguyên tử trong hợp chất với giả định đó là hợp chất ion dựa vào công thức cấu tạo. Lời giải chi tiết: a) H – O – O – H Số oxi hóa của H là +1 Gọi x là số oxi hóa của O, theo quy tắc 1 và 2 có: 1.(+1) + 1.x + 1.x + 1.(+1) = 0 → x = -1. Vậy số oxi hóa của H là +1, của O là -1 (trường hợp đặc biệt). b) Nguyên tố O gây nên tính oxi hóa của H2O2. 2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2H2O(quá trình oxi hóa) 2Fe3+ + H2O2 + 2OH- → 2Fe2+ + 2H2O + O2 (quá trình khử) Bài tập 5
Lời giải chi tiết: C2H5OH + 4O2 → 3CO2 + 3H2O C22-H5+O2-H+ + O20 → C4+O22- + H2O C2- → C4+ + 6e (quá trình oxi hóa) O20 + 4e → 2O2- (quá trình khử) Phản ứng này có là phản ứng oxi hóa – khử. Nó thuộc loại phản ứng cung cấp năng lượng.
|




















Danh sách bình luận