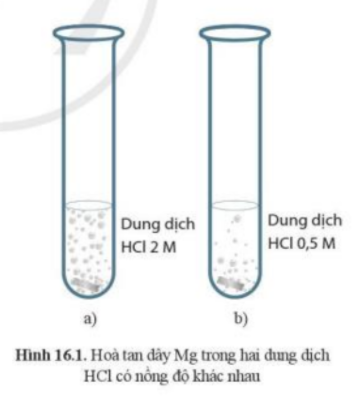
Bài 16. Tốc độ phản ứng hóa học trang 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 Hóa 10 Cánh diềuTải vềCho hai mảnh Mg cùng khối lượng vào hai ống nghiệm chứa cùng thể tích dung dịch HCl dư, nồng độ dung dịch HCl ở ống nghiệm (a) và (b) lần lượt là 2M và 0,5M. 1. Trong cùng một đơn vị thời gian, khối lượng mảnh Mg giảm đi ở thí nghiệm với dung dịch HCl nồng độ nào nhanh hơn? Giải thích 2. Trong cùng một khoảng thời gian, nồng độ của MgCl2 ở dung dịch nào tăng lên nhanh hơn? Giải thích 3. Tốc độ của phản ứng (1) ở dung dịch HCl 2M là nhanh hơn hay chậm hơn so với ở dung dịch HCl 0,5M? Quảng cáo
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
CH tr 88 MĐ
Phương pháp giải: Ở ống nghiệm (a) có hiện tượng sủi bọt khí nhiều hơn Lời giải chi tiết: - Ở ống nghiệm (a) có hiện tượng sủi bọt khí nhiều hơn => Phản ứng ở ống nghiệm (a) xảy ra mãnh liệt hơn => Dây Mg ở ống nghiệm (a) sẽ bị tan hết trước Mg + 2HCl → MgCl2 + H2↑ CH tr 89 CH
Phương pháp giải: Bong bóng khí H2 thoát ra nhanh hơn ở thí nghiệm với dung dịch HCl 2M so với thí nghiệm sử dụng dung dịch HCl 0,5M => HCl (trong dung dịch 2M ban đầu) bị mất đi do phản ứng với Mg nhanh hơn lượng HCl (trong dung dịch 0,5M ban đầu) mất đi do phản ứng với Mg Lời giải chi tiết: 1. - Trong cùng 1 khoảng thời gian, lượng H2 sinh ra ở ống nghiệm chứa dung dịch HCl 2M nhiều hơn lượng H2 sinh ra ở ống nghiệm chứa dung dịch 0,5M => Lượng MgCl2 sinh ra ở ống nghiệm chứa dung dịch HCl 2M nhiều hơn lượng MgCl2 sinh ra ở ống nghiệm chứa dung dịch HCl 0,5M => Nồng độ của MgCl2 ở dung dịch chứa HCl 2M tăng lên nhanh hơn (vì thể tích không đổi) 2. - Vì nồng độ dung dịch MgCl2 ở dung dịch chứa HCl 2M tăng lên nhanh hơn => Tốc độ của phản ứng (1) ở dung dịch HCl 2M nhanh hơn so với ở dung dịch HCl 0,5M CH tr 90 CH
Phương pháp giải: - A, B là chất tham gia - ∆C = Csau - Ctrước - ∆t = tsau - ttrước - Sau khoảng thời gian phản ứng, nồng độ chất tham gia giảm Lời giải chi tiết: - Xét biểu thức - Sau thời gian phản ứng, nồng độ chất tham gia giảm => Csau < Ctrước => ∆C < 0 - Trong khi đó: ∆t = tsau - ttrước => ∆t > 0 => Phải thêm dấu trừ trong biểu thức (3) đối với chất tham gia phản ứng để tốc độ phản ứng có giá trị dương CH tr 90 LT
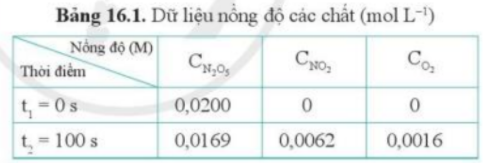
Phương pháp giải: Áp dụng công thức: Lời giải chi tiết:
2. - Nồng độ biến thiên chất không đồng đều sau mỗi khoảng đơn vị thời gian => Ta không thể tính được nồng độ các chất sau 50 giây => Không tính được tốc độ trung bình của phản ứng sau 50 giây CH tr 90 VD
Phương pháp giải: - Khi có sự đốt cháy, tốc độ phản ứng tăng - Phản ứng giữa các chất khí diễn ra nhanh hơn phản ứng diễn ra giữa chất rắn và chất khí Lời giải chi tiết: - Phản ứng (1): diễn ra giữa chất rắn và chất khí, có sự đốt cháy - Phản ứng (2): diễn ra giữa chất rắn và chất khí, không có đốt cháy => Phản ứng (1) diễn ra nhanh hơn phản ứng (2) - Phản ứng (3): diễn ra giữa chất khí và chất khí, có sự đốt cháy => Phản ứng (3) diễn ra nhanh hơn phản ứng (1) => Tốc độ phản ứng theo chiều tăng dần: (2) < (1) < (3) CH tr 91 TH
Phương pháp giải: HCl + CaCO3 → CaCl2 + CO2↑ + H2O => Có khí thoát ra - Nồng độ chất tham gia càng cao => Tốc độ phản ứng diễn ra càng nhanh Lời giải chi tiết: - Ta có phương trình: HCl + CaCO3 → CaCl2 + CO2↑ + H2O => Khi cho mẩu đá vôi tác dụng với dung dịch HCl thì có khí không màu thoát ra, khí đó là carbon dioxide - Nồng độ HCl càng cao thì tốc độ phản ứng diễn ra càng nhanh. - Giải thích: để phản ứng xảy ra, cần phải có sự va chạm giữa HCl và CaCO3. Ở ống nghiệm 2, nồng độ HCl lớn gấp đôi ở ống nghiệm 1, do vậy số va chạm của HCl và CaCO3 (trong cùng 1 đơn vị thời gian) sẽ lớn hơn, từ đó tốc độ phản ứng ở ống nghiệm 2 là lớn hơn CH tr 91 VD
Phương pháp giải: Khi nồng độ chất tham gia càng cao => Tốc độ phản ứng diễn ra càng nhanh Lời giải chi tiết: - Thực phẩm bị ôi thiu là do các phản ứng oxi hóa của oxygen => Người ta bơm N2 hoặc CO2 để giảm nồng độ của oxygen từ 21% xuống còn khoảng 2 -5% => Khi nồng độ oxygen giảm dẫn đến giảm tốc độ quá trình oxi hóa thực phẩm => Hạn chế sự ôi thiu CH tr 92 CH
Phương pháp giải: - Nồng độ chất A và B đều bằng 1M => CA = 1M, CB = 1M Lời giải chi tiết: - Khi nồng độ chất A và B đều bằng 1M => v =k.1a.1b => v = k => Tốc độ phản ứng = hằng số tốc độ phản ứng (phụ thuộc vào nhiệt độ và bản chất các chất tham gia) => Vậy khi nồng độ chất A và B đều bằng 1M thì tốc độ phản ứng = hằng số tốc độ phản ứng CH tr 92 CH
Phương pháp giải: Theo định luật tác dụng khối lượng: v = kCH2.CI2 Lời giải chi tiết: Áp dụng định luật tác dụng khối lượng: v = kCH2.CI2 => Ở một nhiệt độ không đổi, tốc độ phản ứng (6) tỉ lệ thuận với nồng độ của H2 cũng như nồng độ của I2 => Nếu nồng độ của H2 tăng gấp đôi thì tốc độ phản ứng (6) tăng gấp đôi CH tr 93 CH
Phương pháp giải: H2(g) + I2(g) → 2HI(g) Theo định luật tác dụng khối lượng: v = kCH2.CI2 Lời giải chi tiết: Áp dụng định luật tác dụng khối lượng: v = kCH2.CI2 => Ở một nhiệt độ không đổi, tốc độ phản ứng (6) tỉ lệ thuận với nồng độ của H2 cũng như nồng độ của I2 => Nếu nồng độ của H2 và I2 tăng gấp đôi thì tốc độ phản ứng (6) tăng lên 4 lần CH tr 93 VD
Phương pháp giải: a) Coi người và oxygen là chất tham gia phản ứng => Ở nơi đông người, nồng độ oxygen giảm đi nhiều để cung cấp cho con người => Lượng oxygen bị thiếu hụt b) - Oxygen cung cấp sự cháy - Oxygen nguyên chất có nồng độ oxygen cao hơn trong không khí c) - Oxygen duy trì sự sống - Khi bệnh nhân suy hô hấp => Tốc độ hô hấp giảm Lời giải chi tiết: a) Ở nơi đông người, nồng độ oxygen giảm đi nhiều để cung cấp cho con người => Lượng oxygen bị hao hụt và loãng => Con người bị thiếu oxygen nên cảm thấy khó thở và phải thở nhanh hơn để lấy oxygen b) Khi cho tàn đóm vào bình oxygen nguyên chất => Nồng độ oxygen tăng cao (vì oxygen nguyên chất có nồng độ cao hơn nhiều so với oxygen trong không khí) => Giúp cho phản ứng xảy ra nhanh và mạnh hơn => Tàn đón đỏ bùng cháy c) - Khi con người bị suy hô hấp => Tốc độ hô hấp giảm => Không cung cấp đủ khí oxygen cho con người - Áp dụng định luật tác dụng khối lượng => Cần phải tăng nồng độ của chất tham gia (khí oxygen) để tăng tốc độ hô hấp => Bệnh nhân cần phải thở oxygen (nồng độ 100%) thay vì không khí (nồng độ oxygen 21%) CH tr 94 TH
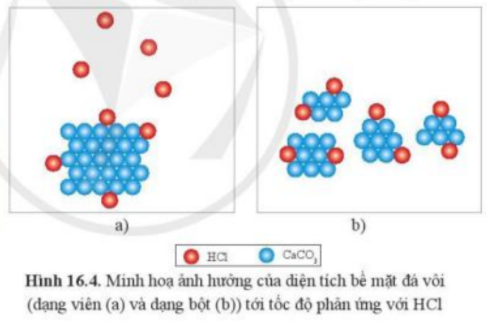
Phương pháp giải: 2HCl + CaCO3 → CaCl2 + CO2↑ + H2O => Có khí thoát ra - Diện tích bề mặt càng lớn, tốc độ phản ứng càng lớn Lời giải chi tiết: - Ta có phương trình: 2HCl + CaCO3 → CaCl2 + CO2↑ + H2O => Khi cho mẩu đá vôi tác dụng với dung dịch HCl thì có khí không màu thoát ra, khí đó là carbon dioxide - Diện tích bề mặt càng lớn, tốc độ phản ứng càng lớn CH tr 94 CH
Phương pháp giải: Ở dạng bột, diện tích tiếp xúc tăng Lời giải chi tiết: Để phản ứng xảy ra, cần phải có sự tiếp xúc giữa HCl và CaCO3. Ở dạng bột, các phân tử CaCO3 tiếp xúc nhiều với các phân tử HCl hơn là CaCO3 ở dạng hạt => Tốc độ phản ứng ở dạng bột sẽ nhanh hơn CH tr 94 VD
Phương pháp giải: Khi chẻ nhỏ thanh củi làm tăng diện tích tiếp xúc giữa thanh củi và oxygen Lời giải chi tiết: - Khi chẻ nhỏ thanh củi làm tăng diện tích tiếp xúc giữa thanh củi và oxygen - Khí oxygen giúp duy trì sự cháy, làm sự cháy diễn ra mãnh liệt =>Thanh củi chẻ nhỏ hơn thì sẽ cháy nhanh hơn CH tr 95 TH
Phương pháp giải: 2HCl + Fe → FeCl2 + H2↑ => Có khí thoát ra - Nhiệt độ càng cao, tốc độ phản ứng càng lớn Lời giải chi tiết: - Ta có phương trình: 2HCl + Fe → FeCl2 + H2↑ => Khi cho đinh sắt tác dụng với dung dịch HCl thì có khí không màu thoát ra, khí đó là hydrogen - Nhiệt độ càng cao, tốc độ phản ứng càng lớn CH tr 95 CH
Phương pháp giải: Kim loại + Acid → Muối + H2↑ Lời giải chi tiết: 2HCl + Fe → FeCl2 + H2↑ CH tr 95 CH
Phương pháp giải:
Lời giải chi tiết:
CH tr 96 TH
Phương pháp giải: 2H2O2 → 2H2O + O2↑ => Có khí thoát ra - Nhiệt độ càng cao, tốc độ phản ứng càng lớn Lời giải chi tiết: - Ta có phương trình: 2H2O2 → 2H2O + O2↑ => Dung dịch H2O2 3% ở điều kiện thường phân hủy chậm và có khí không màu thoát ra, khí đó là Oxygen - Khi có chất xúc tác, khí thoát ra nhiều hơn => Chất xúc tác MnO2 làm tăng tốc độ phân hủy H2O2 CH tr 97 VD
Phương pháp giải: Enzyme protease, lipase và amylase là các chất xúc tác đẩy nhanh quá trình tiêu hóa chất đạm, chất béo và tinh bột Lời giải chi tiết: - Khi nhai kĩ, thức ăn được nghiền nhỏ giúp tăng diện tích tiếp xúc giữa thức ăn và enzyme amylase, lipase có trong nước bọt - Mà enzyme protease, lipase và amylase là các chất xúc tác đẩy nhanh quá trình tiêu hóa chất đạm, chất béo và tinh bột => Giúp chúng ta dễ dàng tiêu hóa thức ăn Bài tập 1
Phương pháp giải:
Lời giải chi tiết:
Bài tập 2
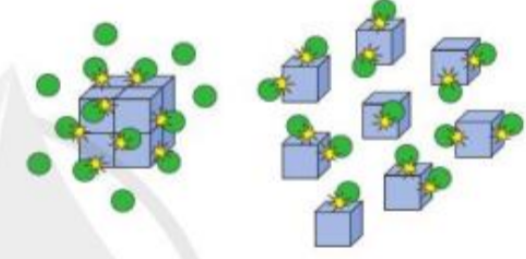
Phương pháp giải: Các yếu tố ảnh hưởng đến tốc độ phản ứng: nồng độ, áp suất, diện tích bề mặt, nhiệt độ, chất xúc tác Lời giải chi tiết: - Hình thứ nhất mô tả: chất tham gia ở dạng khối lớn - Hình thứ hai mô tả: chất tham gia được chia nhỏ ra => Tăng diện tích tiếp xúc bề mặt giữa các chất tham gia => Hình ảnh mô tả ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng Bài tập 3
Phương pháp giải: Các yếu tố ảnh hưởng đến tốc độ phản ứng: nồng độ, áp suất, diện tích bề mặt, nhiệt độ, chất xúc tác Lời giải chi tiết: - Các biện pháp khác nhau để làm tăng tốc độ điều chế khí H2 là: + Nồng độ: Tăng nồng độ của HCl + Áp suất: Không được vì chất tham gia không tồn tại ở dạng khí + Diện tích bề mặt: Cắt nhỏ miếng sắt + Nhiệt độ: Đun nóng dung dịch HCl + Chất xúc tác: Không có Bài tập 4
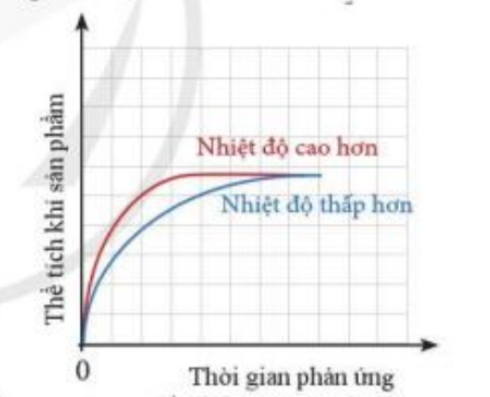
Phương pháp giải: a) Nhiệt độ càng cao, tốc độ phản ứng diễn ra càng nhanh b) Sau một thời gian, phản ứng diễn ra hoàn toàn, chất tham gia phản ứng hết Lời giải chi tiết: a) - Đường màu đỏ biểu diễn tốc độ phản ứng ở nhiệt độ cao hơn - Đường màu xanh biểu diễn tốc độ phản ứng ở nhiệt độ thấp hơn - Trong phản ứng hóa học, nhiệt độ càng cao, tốc độ phản ứng diễn ra càng nhanh => Đường màu đỏ ban đầu cao hơn đường màu xanh b) - Sau 1 thời gian, phản ứng diễn ra hoàn toàn, chất tham gia phản ứng hết - Vì lượng chất tham gia là như nhau => Lượng chất sản phẩm tạo thành là bằng nhau => Sau một thời gian, hai đường đồ thị chụm lại với nhau (thể tích khí H2 là bằng nhau) Bài tập 5
Phương pháp giải:
Lời giải chi tiết: a) b) - Ta nhận thấy, tốc độ phản ứng ở phút thứ nhất (v1) nhanh hơn tốc độ phản ứng ở phút thứ 2 (v2) - Sau một khoảng thời gian bất kì, nồng độ chất tham gia giảm Mà tốc độ phản ứng phụ thuộc vào nồng độ (nồng độ càng cao, tốc độ phản ứng càng nhanh) => Sau 1 khoảng thời gian phản ứng, tốc độ phản ứng giảm dần và không bằng nhau
|














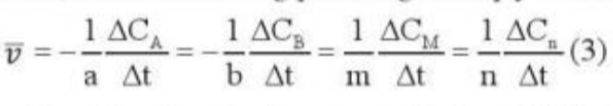
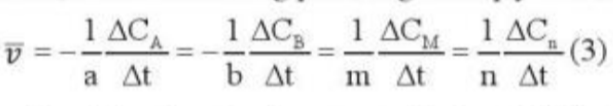
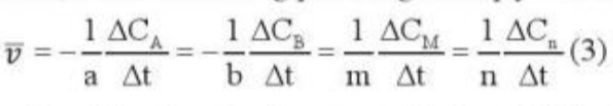

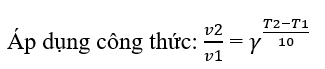



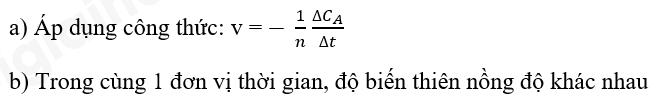







Danh sách bình luận